茶渣多肽制备及其对羟自由基的清除能力
2011-04-06罗红玉岳鹏翔王丽璞黎星辉
罗红玉,郁 军,岳鹏翔,陈 暄,王丽璞,黎星辉,*
(1.南京农业大学茶叶科学研究所,江苏 南京 210095;2.大闽食品(漳州)有限公司博士后科研工作站,福建 漳州 363000)
茶渣多肽制备及其对羟自由基的清除能力
罗红玉1,2,郁 军2,岳鹏翔2,陈 暄1,王丽璞1,2,黎星辉1,*
(1.南京农业大学茶叶科学研究所,江苏 南京 210095;2.大闽食品(漳州)有限公司博士后科研工作站,福建 漳州 363000)
分别以酸性蛋白酶、中性蛋白酶、碱性蛋白酶以及复合蛋白酶水解茶渣粗蛋白制备茶渣多肽,并对多肽的羟自由基清除能力进行考察。通过单因素试验证明:复合蛋白酶的效果最好,其最佳水解工艺条件为粗蛋白液质量分数0.5%、加酶量600U/g、温度55℃、pH8.0、水解5h,在此条件下,多肽对羟自由基的清除能力达27.3%;碱性蛋白酶的效果也较好,其最佳工艺为蛋白液质量分数0.5%、加酶量400DU/g、pH8.5、温度50℃、时间1.0h,在此条件下,多肽对羟自由基的清除能力达25.3%,与前者的清除能力没有显著差异,但用时少4h;利用碱性蛋白酶作为酶源制得茶渣多肽粗品中含有蛋白质、多肽、游离氨基酸分别为28.4%、11.0%、1.5%,其对羟自由基的半清除率IC50为8.432mg/mL,相同条件下VC的IC50为0.897mg/mL。
茶渣蛋白;蛋白酶;水解;多肽;羟自由基
在正常的生理代谢过程中,人体会产生自由基,如超氧阴离子自由基、羟自由基等。过多的自由基会直接氧化破坏蛋白质,从而损伤组织、细胞以及DNA[1-2]。多肽是一类由氨基酸构成但又不同于蛋白质而具有蛋白质特性的中间产物。具有抗氧化性的多肽被称为抗氧化活性肽,是生物活性肽的一种,通过减少自由基以及抑制脂质过氧化从而达到抗氧化作用[3-4]。作为基础营养物质,活性肽比蛋白质更易吸收,生物利用度更高;同时,部分活性肽具有调节人体生理机能的功效。这些特性往往是蛋白及游离氨基酸所不具备的。
目前,活性肽获得途径主要有两种:一是直接从生物体中提取内源活性肽,如肌肽、谷胱甘肽;二是人工合成,可通过酸法水解、酶法水解、发酵法、重组DNA技术合成。其中,酶法生产安全性高,条件温和,可定位生成特定肽,如易吸收肽、抗氧化活性肽、降血压肽等,该法成本低,已成为活性肽最主要的生产方法。现已通过酶法获得多种活性肽,如具有抗氧化活性的大豆多肽[5-7]、花生多肽[8]、玉米多肽[9]以及魔芋多肽[10]以及其他多肽[11]。
研究表明,酶法所得多肽的氨基酸序列、组成及分子质量大小共同决定着其抗氧化能力[4,12]。随着蛋白水解过程的进行,水解度逐渐增大,水解产物中蛋白质、肽、氨基酸的组成、含量也发生相应的变化。张强等[13]研究报道,随着水解度的增加,米糠多肽的抗氧化活性逐步增强。但在陈力宏等[14]对蚕茧层抗氧化肽的研究中,水解液的抗氧化活性未随水解度的增加而增加。由于不同蛋白质具有不同的结构性质,因此要获得具有较好抗氧化活性的多肽,其合适的水解度需要通过具体实验才能确定。
张红城等[15]研究表明,茶花花粉多肽具有很强的抗氧化能力。龚吉军等[16]报道,茶籽多肽对超氧阴离子自由基和羟自由基具有强烈的清除作用。王洪新等[17]通过酸-盐法提取茶粗蛋白,并经丙酮脱色、超滤脱盐后所得的产品能清除超氧阴离子自由基。茶叶中含有20%~30%的蛋白质,其中大部分由于不溶于水而残留于茶渣中。茶渣主要被用作饲料、肥料,更多被自由排放,不仅浪费资源还造成环境污染。目前,对其中的蛋白质研究主要集中在初步提取纯化及理化性质改性阶段[18],对具有抗氧化活性的茶渣多肽研究未见报道。本实验采用酶法水解茶渣蛋白制备茶渣多肽,以所得多肽对羟自由基的清除能力为指标,对不同的蛋白酶进行筛选,旨在为制备抗氧化茶渣多肽寻找合适的酶源和工艺。
1 材料与方法
1.1 材料与试剂
纯度为41.0%的茶渣粗蛋白粉 实验室自制;Protex 6L碱性蛋白酶(最适pH9.5、最适温度60℃、酶比活力58000DU/g) 无锡杰能科生物工程有限公司;Protease M“Amano”G酸性蛋白酶(最适pH4.5、最适温度50℃、酶比活力5500U/g)、Protease A“Amano”2G中性蛋白酶(最适pH7.0、最适温度50℃、酶比活力20000U/g)、ProteAX复合蛋白酶(最适pH7.0、最适温度60℃~70℃、酶比活力1250U/g) 日本天野酶制品株式会社;硫酸、氢氧化钠、定氮催化剂、硼酸、盐酸、水杨酸、七水合硫酸亚铁、无水乙醇、30%过氧化氢和三氯乙酸(均为分析纯)。
1.2 仪器与设备
PL 203电子天平 梅特勒-托利多仪器(上海)有限公司;pHS-3 C pH计 上海精科实业有限公司;数显恒温水浴锅 江苏省金坛市江南仪器厂;TU-1800S紫外-可见分光光度计 北京普析通用仪器有限责任公司;RJTDL-5A低速台式大容量离心机 无锡市瑞江分析仪器有限公司;KDN-08定氮装置 上海新嘉电子有限公司。
1.3 方法
1.3.1 蛋白质、游离氨基酸的测定
蛋白质:GB/T 5009.5—2003《食品中蛋白质的测定》;游离氨基酸:GB/T 8314—2002《茶:游离氨基酸总量测定》。
1.3.2 多肽的制备
定量称取蛋白酶制品,加入少许蒸馏水于其最适温度下预热5min,再加入到已配制好的茶渣粗蛋白水溶液中,调节混合液pH值,并于相应温度下水解一定时间(密闭条件下,每10min搅拌1次),水解完后于100℃加热5min钝化酶活性,水解液经浓缩再冷冻干燥即得茶渣多肽粗品。
1.3.3 蛋白酶的水解
酸性蛋白酶、中性蛋白酶和复合蛋白酶,在各自最适温度和pH值条件下,以1000U/g粗蛋白的加酶量加入到质量分数0.5%的粗蛋白水溶液中酶解5h,碱性蛋白酶在其最适条件下加酶量为400DU/g粗蛋白,水解3h。酶解完成后在100℃加热5min钝化酶活性,定溶至50mL,备测。
1.3.4 对羟自由基的清除能力测定
采用水杨酸法[19-21]。经优化后的方法为:在10mL的比色管中依次加入0.5mL 10mmol/L水杨酸-乙醇溶液、0.5mL 10mmol/L 七水合硫酸亚铁溶液、0.5mL 3.0mg/mL样液(控制pH7.0)、8mL蒸馏水,最后加入0.5mL 10mmol/L H2O2启动Fenton反应,摇匀后于室温静置20min,以蒸馏水作为参比于510nm处测定其吸光度。羟自由基清除能力计算公式如下:

式中:C为多肽对羟自由基的清除能力;A1为加入样液后的吸光度;A2为以蒸馏水替代水杨酸后的吸光度;A3为以蒸馏水替代样液的吸光度。样品对羟自由基的半数清除浓度IC50计算方法为:制作浓度-清除能力曲线,建立线性回归方程,根据方程求得IC50。
1.3.5 酶解工艺条件优化
采用单因素试验法对复合蛋白酶和碱性蛋白酶的水解条件进行优化。在复合蛋白酶水解过程中,控制基本条件为粗蛋白液质量分数0.5%,加酶量500U/g粗蛋白,温度65℃,pH7.0,水解3h,分别研究粗蛋白液质量分数(0.5%、0.8%、1.1%、1.4%、1.7%)、加酶量(100、200、300、400、500、600、700、800、900U/g粗蛋白)、酶解温度(35、45、55、65、75℃)、酶解pH(6.0、6.5、7.0、7.5、8.0)、酶解时间(1、2、3、4、5h)对多肽清除羟自由基能力的影响。
在碱性蛋白酶水解过程中,控制基本条件为粗蛋白液质量分数0.5%,加酶量400DU/g,温度60℃,pH9.5,水解3h,分别考察粗蛋白液质量分数(0.5%、0.8%、1.1%、1.4%、1.7%)、加酶量(100、200、400、800、1200、1600DU/g粗蛋白)、酶解温度(30、40、50、60、70)、 酶解pH值(7.5、8.0、8.5、9.0、9.5、10.0、10.5)、酶解时间(0.5、1.0、2.0、3.0、4.0、5.0h)对多肽清除羟自由基能力的影响。
1.3.6 多肽粗品组成成分分析
多肽、水解度测定采用TCA法[22]。吸取40mL样液,加入10% TCA溶液10mL,摇匀静置10min,将溶液定量转移,4000r/min离心10min,取20mL上清液,按蛋白质含量测定法测定含氮量。
所得多肽中蛋白质含量/%= (粗蛋白中总氮含量-酶解后氨基态氮含量)×6.25×100
多肽/%=(酶解液中氨基态氮含量-酶解液中游离氨基酸含量) ×6.25×100

式中:N0为茶渣粗蛋白酶解前总氮含量;N1为茶渣粗蛋白酶解前氨基态氮含量;N2为茶渣粗蛋白酶解后氨基态氮含量。
1.3.7 统计方法
试验采用SPSS 17.0进行统计分析。
2 结果与分析
2.1 蛋白酶的筛选

表1 不同蛋白酶水解产物对羟自由基清除能力的比较Table 1 Scavenging capacity of different protease hydrolysates against hydroxyl free radicals
由表1可知,粗蛋白本身对羟自由基具有一定的清除能力,一是因为蛋白可具有一定抗氧化性,另与茶渣粗蛋白中含有多酚、多肽以及抗氧化酶,如氧化氢酶有关;当加入蛋白酶水解后,所得产物对羟自由基的清除能力明显增强;但不同的蛋白酶所得产物清除能力不同,这与不同蛋白酶与蛋白的作用位点不同有关,所得多肽的N末端、C末端氨基酸组成、以及排序、分子质量大小也存在差异,产物的构象也有所不同,因此表现出水解产物清除自由基能力的差异。其中复合蛋白酶水解物能力最强为16.9%,中性蛋白酶水解物能力最弱为9.8%。因此,试验初步确定以复合蛋白酶为最佳酶选。
2.2 酶解条件的优化
由于碱性蛋白酶的比活力单位不同于其他酶类,在2.1节基础上,选择复合蛋白酶和碱性蛋白酶水解茶渣蛋白制备多肽,通过单因素试验以其产物的羟自由基清除能力为测定指标进行水解条件的优化。
2.2.1 粗蛋白液质量分数对羟自由基清除能力的影响

图1 蛋白液质量分数对羟自由基清除能力的影响Fig.1 Effect of substrate concentration on hydroxyl free radical scavenging activity
从图1可知,在一定范围内,随着粗蛋白液质量分数增加,清除羟自由基能力变化很小,说明蛋白液质量分数对水解过程无明显影响;当质量分数为0.5%时,能力相对较高,复合蛋白酶和碱性蛋白酶所得多肽对羟自由基的清除能力分别为23.6%、26.3%;因此试验确定粗蛋白的合适质量分数为0.5%。
2.2.2 蛋白酶加量对羟自由基清除能力的影响
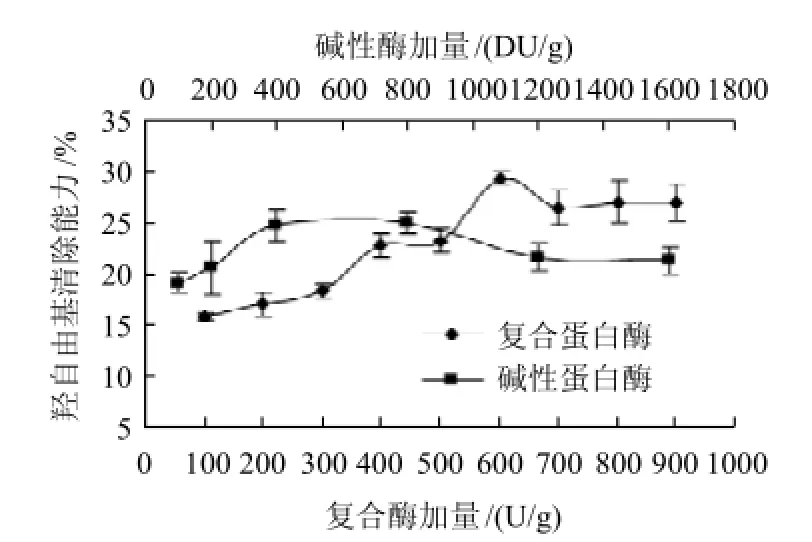
图2 加酶量对羟自由基清除能力的影响Fig.2 Effect of enzyme dosage on hydroxyl free radical scavenging activity
由图2可知,随着酶量的增加,多肽对羟自由基的清除能力逐渐增强再减弱最后趋于稳定,因为随着酶量增加,酶与蛋白结合的程度也增加,从而蛋白水解度增加,由此产生更短肽段,由于肽段的氨基酸排序和分子量大小不同从而影响着多肽的清除能力,说明当水解程度较低时,多肽对羟自由基的清除能力会随着水解度的增加而增加。当粗蛋白中复合蛋白酶加量为600U/g时,产物清除羟自由基能力最大为29.3%;当碱性蛋白酶加量为400DU/g时,清除能力为24.7%,与加量为800DU/g时的清除能力25.0%无显著差异;因此试验确定粗蛋白中复合蛋白酶和碱性蛋白酶的最适加量分别为600U/g、400DU/g。
2.2.3 温度对羟自由基清除能力的影响

图3 温度对羟自由基清除能力的影响图Fig.3 Effect of hydrolysis temperature on hydroxyl free radical scavenging activity
由图3可知,在一定范围内,随着温度的升高,多肽对羟自由基的清除能力先增强再减弱,一是因为温度对对蛋白酶活的影响,当温度较低时,蛋白酶活性会随着温度升高而增强,当温度过高时,会使酶失活,二是高温会引起蛋白自身水解,三是因为高温会使多肽变性失活。当温度为55℃时,复合蛋白酶所得多肽的清除能力最强为25.6%,当温度为50℃时,碱性蛋白酶所得多肽的清除能力最强为24.4%。因此,试验确定复合蛋白酶和碱性蛋白酶的最佳水解温度分别为55、50℃。
2.2.4 pH值对羟自由基清除能力的影响

图4 pH值对羟自由基清除能力的影响Fig.4 Effect of pH on hydroxyl free radical scavenging activity
由图4可知,在复合蛋白酶水解过程中,在一定pH值范围内,所得多肽对羟自由基的清除能力随着pH的增加缓慢增强,说明较高pH值可以激活该蛋白酶,使粗蛋白进一步水解;当pH8.0时,多肽的清除能力达最高即24.3%。在碱性蛋白酶水解过程中,所得多肽的清除能力随着pH值增加呈先增强再减弱最后又增强的趋势,当pH8.5时,多肽的清除能力最强为26.0%。因此,试验确定两种蛋白酶的最佳水解pH值分别为8.0、8.5。
2.2.5 水解时间对羟自由基清除能力的影响

图5 水解时间对羟自由基清除能力的影响Fig.5 Effect of hydrolysis time on hydroxyl free radical scavenging activity
由图5可知,在复合蛋白酶水解过程中,随着时间的延长,多肽对羟自由基的清除能力也增强,在碱性蛋白酶水解过程中,多肽的清除能力先增强再逐渐减弱。因为不同的蛋白酶与蛋白的结合位点不同,所得产物结构也不同;碱性蛋白酶与复合蛋白酶的酶比活单位不同,因此无法控制两者加量一致,与复合蛋白酶相比,当加入碱性蛋白酶时,蛋白水解程度相对更大,随着时间的推进,多肽再度分解为分子质量更小的小肽和氨基酸,从而使其羟自由基清除能力下降。复合蛋白酶和碱性蛋白酶水解蛋白所得多肽最强的清除能力分别为24.8%、24.5%,水解时间分别为5、1h。因此,试验确定两种蛋白酶的最佳水解时间分别为5、1h。
通过单因素试验可知,采用复合酶水解茶渣粗蛋白制备抗氧化多肽的最佳工艺为粗蛋白液质量分数0.5%、加酶量600U/g、温度55℃、pH8.0、水解5h,碱性蛋白酶水解的最佳工艺为粗蛋白液质量分数0.5%、加酶量400DU/g、温度50℃、pH8.5、水解1h。
2.3 复合蛋白酶和碱性蛋白酶水解产物对羟自由基清除能力的比较
在单因素试验基础上,以各酶最佳工艺条件下比较复合蛋白酶和碱性蛋白酶水解产物对羟自由基清除能力。由表2可知,两种酶中前者的水解效果略好于后者,经t检验表明两者没有显著差异,但水解时间却为后者的5倍。本着经济原则,试验确定以碱性蛋白酶作为制备茶渣多肽的合适酶源。

表2 复合蛋白酶和碱性蛋白酶水解产物对羟自由基清除能力的比较Table 2 Comparison of hydroxyl free radical scavenging capacity of crude polypeptide samples obtained by hydrolysis with protamex and alkaline protease
2.4 碱性蛋白酶水解产物多肽粗品与VC对羟自由基清除能力的比较

图6 多肽粗品和VC对羟自由基清除能力的比较Fig.6 Comparison of hydroxyl free radical scavenging capacity of crude peptide sample obtained by protamex hydrolysis and vitamin C
由图6可知,多肽的抗氧化能力总体均不及VC;随着两者质量浓度的增加,抗氧化能力增强;当VC质量浓度达到1.97mg/mL时,清除能力已经最大为100%,当多肽粗品质量浓度为6.6mg/mL时,其清除能力为37.2%,仍然有继续升高的趋势;经统计分析,当清除体系50%的羟自由基时,所需多肽粗品的IC50为8.432mg/mL,而VC的IC50则为0.897mg/mL。
2.5 碱性蛋白酶水解产物多肽粗品组成分析
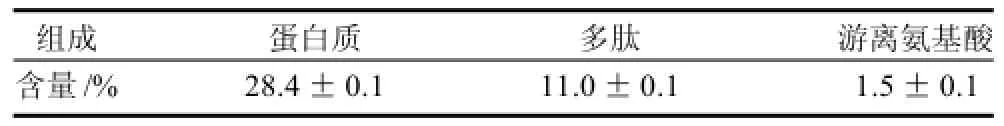
表3 多肽粗品组成分析Table 3 Contents of protein, polypeptide and free amino acid of crude polypeptide sample obtained by alkaline protease hydrolysis
从表3数据可知,纯度为41.0%的粗蛋白经过蛋白酶水解后所得的多肽粗品中,蛋白含量为28.4%,多肽含量为11.0%,游离氨基酸含量为1.5%,总氨基态氮含量为12.5%,粗蛋白的水解度为21.8%。
3 结论与讨论
因为碱性蛋白酶的比活单位不同于酸性蛋白酶、中性蛋白酶以及复合蛋白酶,试验首先对其余3种蛋白酶进行筛选,发现采用复蛋白酶水解茶渣蛋白所得多肽对羟自由基的清除能力最强为16.9%。再对该酶和碱性蛋白酶的水解工艺条件进行优化,通过单因素试验证明:复合蛋白酶效果较好,其最佳工艺为粗蛋白液质量分数0.5%、加酶量600U/g、温度55℃、pH8.0、水解5h,在此条件下多肽对羟自由基清除能力达27.3%;碱性蛋白酶的效果也较好,其最佳水解工艺为蛋白液质量分数0.5%、加酶量400DU/g、pH8.5、温度50℃、时间1.0h,在此条件下多肽对羟自由基清除能力达25.3%,经统计分析与复合蛋白酶水解最佳工艺条件下并无差异,但用时却比复合蛋白酶少了4h。因此,以碱性蛋白酶作为制备茶渣多肽的合适酶源。以此酶制得的茶渣多肽粗品中,蛋白质、多肽和游离氨基酸含量分别为28.4%、11.0%、1.5%。与VC比较结果显示:当VC质量浓度达到1.97mg/mL时,对羟自由基的清除能力达最大为100%,当多肽粗品质量浓度为6.6mg/mL时,其能力为37.2%;两者抗氧化的IC50值分别为0.897、8.432mg/mL。
蛋白酶对茶渣蛋白的水解主要受加酶量、温度、pH值、水解时间4个因素的影响。其中,加酶量的增加会促使体系水解速度与程度增大,从而生成不同大小、长短的多肽以及氨基酸;温度对催化反应的影响一方面是对酶活的影响,另一方面是对产物蛋白和多肽的影响,因为高温会引起蛋白自身水解以及导致多肽变性失活从而影响其清除能力;在水解过程中,pH值不但会影响酶活力,而且还会影响多肽性质,由于多肽在不同的pH值下离子状态会发生变化,从而影响其构象的稳定性;不同蛋白酶最适宜的催化时间不同,而且随着时间的延长,蛋白质的水解度也相应增加,从而使多肽进一步水解成小肽和氨基酸,最终使得产物对羟自由基的清除能力也逐渐减弱。
试验中每一种蛋白酶原有的最适催化条件不一定就是实际催化反应的最佳条件,蛋白酶最适条件多以水解度为准,而此时水解产物对羟自由基清除能力并不一定最好,因此试验中所得各酶最佳参数与其最适条件并不一致;多肽的氨基酸序列、所暴露的基团等直接关系着其清除自由基的能力,关于试验所得多肽粗品对羟自由基的清除机理还有待深入研究。
[1]SCHYMAN P, ERIKSSON L A, ZHANG R B, et al. Hydroxyl radical -thymine adduct induced DNA damage[J]. Chemical Physics Letters, 2008, 458(1/3)∶ 186-189.
[2]JIN B J, EUL W S, HYUNG J J. Effect of extracts from pine deedle against oxidative DNA damage and apoptosis induced by hydroxyl radical via antioxidatant activity[J]. Food and Chenmical Toxicology, 2009, 47(8)∶ 2135-2141.
[3]吴继卫, 何海伦, 路敬涛, 等. 海洋生物蛋白的酶解及酶解产物的抗氧化活性[J]. 海洋科学, 2005, 29(3)∶ 76-80.
[4]周小理, 李红敏. 植物抗氧化(活性)肽的研究进展[J]. 食品工业, 2006 (3)∶ 11-13.
[5]KIM H J, BAE I Y, AHN C W, et al. Purification and identification of adipogenesis inhibitory peptide from black soybean protein hydrolysate [J]. Peptides, 2007, 28(11)∶ 2098-2103.
[6]KUBA M, TANA C, TAWATA S, et al. Production of angiotenisin Ⅰ-converting enzyme inhibitory peptides from soybean protein with Monascus purpureus acid proteinase[J]. Process Biochemical, 2005, 40(6)∶ 2191-2196.
[7]陈湘宁, 张艳艳, 范俊峰, 等. 大豆多肽的凝胶性及抗氧化性研究[J].食品科学, 2005, 26(5)∶ 71-75.
[8]HWANG J Y, SHYU Y S, WANG Y T, et al. Antioxidative properties of protein hydrolysate from defatted peanut kernels treated with esperase [J]. Food Science and Technology, 2010, 43(2)∶ 285-290.
[9]朱艳华, 谭军. 玉米多肽对大鼠体外抗氧化作用的研究[J]. 食品科学, 2008, 29(3)∶ 463-465.
[10]王莉, 徐怀德, 王兴等. 魔芋多肽的物理特性和抗氧化特性[J]. 西北农业学报, 2009, 18(4)∶ 218-222.
[11]GUO H, KOUZUMA Y, YONEKURA M. Structures and properties of antioxidative peptides derived from royal jelly protein[J]. Food Chem, 2009, 113(1)∶ 238-245.
[12]张昊, 任发政. 天然抗氧化肽的研究进展[J]. 食品科学, 2008, 29(1)∶443-447.
[13]张强, 周正义, 王松华. 从米糠中制备抗氧化肽的研究[J]. 食品工业科技, 2007, 28(7)∶ 145-147.
[14]陈力宏, 董英, 孙艳辉. 酶法制备蚕茧层抗氧化多肽水解液的研究[J]. 蚕业科学, 2006, 32(3)∶ 443-444.
[15]张红城, 李慧岩, 董捷, 等. 茶花花粉蛋白酶解物抗氧化性的研究[J]. 食品科学, 2007, 28(8)∶ 58-61.
[16]龚吉军, 李忠海, 钟海雁, 等. 茶籽多肽的制备及抗氧化活性研究[J].食品研究与开发, 2007, 28(10)∶ 59-61.
[17]王洪新, 胡昌云. 茶叶蛋白质的改性及其功能性质研究[J]. 食品科学, 2005, 26(6)∶ 135-140.
[18]胡晓倩, 杨代群. 茶叶蛋白的研究现状分析及发展对策研究[J]. 资源开发与市场, 2010, 26(1)∶ 4-6.
[19]BENATTI C T, TAVARES C R G, GUEDES T A. Optimization of Fenton,s oxidation of chemical laboratory wastewaters using the response surface methodology[J]. Journal of Environmental Management, 2006, 80(1)∶ 66-74.
[20]丁利君, 周国栋. 莲子水溶性糖的提取及其对自由基清除能力的研究[J]. 食品科学, 2002, 23(8)∶ 252-254.
[21]JIN B J, BEN O D L, HYUNG J J. Lunasin peptide purified from Solanum nigrum L. protects DNA from oxidative damage by suppressing the generation of hydroxyl radical via blocking fenton reaction[J]. Cancer Letters, 2010, 293(1)∶ 58-64.
[22]宋晓燕, 高彦祥, 袁芳. 响应面法优化羊胎粉中抗氧化多肽制备工艺的研究[J]. 食品科技, 2008, 33(11)∶ 237-240.
Preparation and Hydroxyl Free Radical Scavenging Activity of Tea Residue Polypeptides
LUO Hong-yu1,2,YU Jun2,YUE Peng-xiang2,CHEN Xuan1,WANG Li-pu1,2,LI Xing-hui1,*
(1. Tea Research Institute, Nanjing Agricultural University, Nanjing 210095, China;2. The Post-Doctoral Research Station, Damin Food (Zhangzhou) Co. Ltd., Zhangzhou 363000, China)
In order to establish an enzymatic method to hydrolyze crude tea residue protein to prepare tea residue polypeptides with higher hydroxyl free radical scavenging activity, the effects of enzymes (acidic protease, neutral protease, alkaline protease and protamex), substrate concentration, enzyme dosage, temperature, pH, hydrolysis time on hydroxyl free radical scavenging activity were studied. Protamex was the best enzyme for the preparation of tea residue polypeptides with hydroxyl free radical scavenging activity, followed by alkaline protease and the optimal substrate concentration, enzyme dosage, hydrolysis temperature, pH and hydrolysis time were 0.5%, 600 U/g, 55 ℃, 8.0 and 5 h for protamex hydrolysis, and 0.5%, 400 DU/g, 8.5, 50 ℃ and 1.0 h for alkaline protease hydrolysis, resulting in a hydroxyl free radical scavenging rate of 27.3% and 25.3%, respectively. Compared with protamex hydrolysis, alkaline protease hydrolysis resulted in a decrease in time consumption by 4 h despite showing no significant difference in hydroxyl free radical scavenging capacity. The polypeptide sample obtained by alkaline protease hydrolysis contained 28.4% protein, 11.0% polypeptide and 1.5% free amino acids and indicated an IC50of 8.432 mg/mL against hydroxyl free radicals compared with 0.897 mg/mL for vitamin C.
tea residue protein;protease;hydrolysis;polypeptide;hydroxyl free radical
S571.1;TQ936.1
A
1002-6630(2011)14-0061-06
2010-12-05
“十一五”国家科技支撑计划项目(2006BAD06B01);科技部科技人员服务企业行动项目(2009GJC10031);
福建自然科学基金“杰出青年”资助项目(31096123);江苏省科技计划项目(BE2010345;BM2008144);
苏州市科技计划项目(SZGD201067;WNZ1002;吴政抄2009字65号);
国家现代农业产业技术体系建设专项(CARS-23);江苏高校优势学科建设工程专项
罗红玉(1985—),女,硕士研究生,研究方向为茶叶化学与制茶工程。E-mail:roye2008324@126.com
*通信作者:黎星辉(1962—),男,教授,博士,研究方向为茶树种质创新、茶叶化学与制茶工程。E-mail:lxh@njau.edu.cn
