22R序列loop和泡突变对GFP报告基因表达的作用
2011-04-06王红钢王予东
王红钢,王予东
(1.河南大学医学院 生物化学与分子生物学教研室,河南 开封 475004;2.河南大学医学院 预防医学教研室,河南 开封 475004)
22R序列loop和泡突变对GFP报告基因表达的作用
王红钢1,王予东2
(1.河南大学医学院 生物化学与分子生物学教研室,河南 开封 475004;2.河南大学医学院 预防医学教研室,河南 开封 475004)
目的:我们研究室的前期工作在猴空泡病毒40(SV40)早期mRNA PolyA序列(SV40PolyA)中发现1个活化基因的原件22R(5′-GTGAAAAAAATGCTTTATTTGT-3′),该片段可以解除 Alu串连序列(或 Line-1重复序列)对GFP报告基因的抑制作用。我们研究22R突变对GFP报告基因表达的作用。方法:将22R及其突变片段插入pEGFP-C1质粒,构建表达载体,瞬时转染HeLa细胞,荧光显微镜下计数观察GFP荧光阳性细胞数。结果:AAG、AGA、TGT、TTG和 TGC(22R,野生型)5个质粒促进基因表达作用比较明显。VECT、VEGT、VETA、VETC、VETG和VETT明显促进GFP基因表达。结论:22Rloop和泡的突变对其活化GFP报告基因作用有重要影响。
SV40PolyA;22R;GFP;茎环结构;转染
非编码序列在真核生物基因组中广泛存在,而且在进化上有强制性,所有的真核生物物种及其中的每一个个体都有大量的非编码序列。遗传学有一个著名的命题,即凡是有利的基因被强制保留,凡是有害的基因被强制剔除,凡是无害也无利的基因出现多态性。非编码序列在基因组中强制存在,一定有其重要的生物学功能[1-4]。尽管已经深入研究了非编码序列的功能,但其中大部分序列的功能还不清楚[5]。茎环结构一般都具有保守性,参与多种生物学过程,比如病毒复制、转录终止和 mRNA 成熟[6-10]。
我们课题组以前的研究表明,在pEGFP-C1质粒的GFP基因下游插进含有14个Alu同向重复的片段(Alu14),GFP基因表达明显受到抑制[11]。再将SV40PolyA正反序列插到GFP和Alu14间,结果GFP基因表达明显增强[12]。SV40PolyA序列中哪个片段能够促进GFP基因表达?将SV40PolyA分成4段,经实验证明,第二段2F2R(60bp)有基因活化 作 用,2F2R 中 的 22bp 片 段 (5′-GTG AAAAAAATGCTTTATTTGT)也能活化基因。
1 材料和方法
1.1 材料
pAlu14质粒为本研究室前期工作构建,系将14个Alu元件同向、正向串连插入pEGFP-C1质粒的GFP基因下游。pEGFP-C1质粒为空载体,不含有插入序列。pEGFP-C1质粒、DH5α菌株和HeLa细胞均为我们实验室保存。
1.2 方法
1.2.1 22R序列茎环结构 用软件分析22R序列,该序列可形成茎环结构,包括1个loop(TGC)、2个茎(AAA/TTT)和1个泡(A/A),见图1。文中将loop碱基突变和泡碱基突变的22R插入pEGFP-C1-Alu14质粒,对GFP报告基因表达的影响。
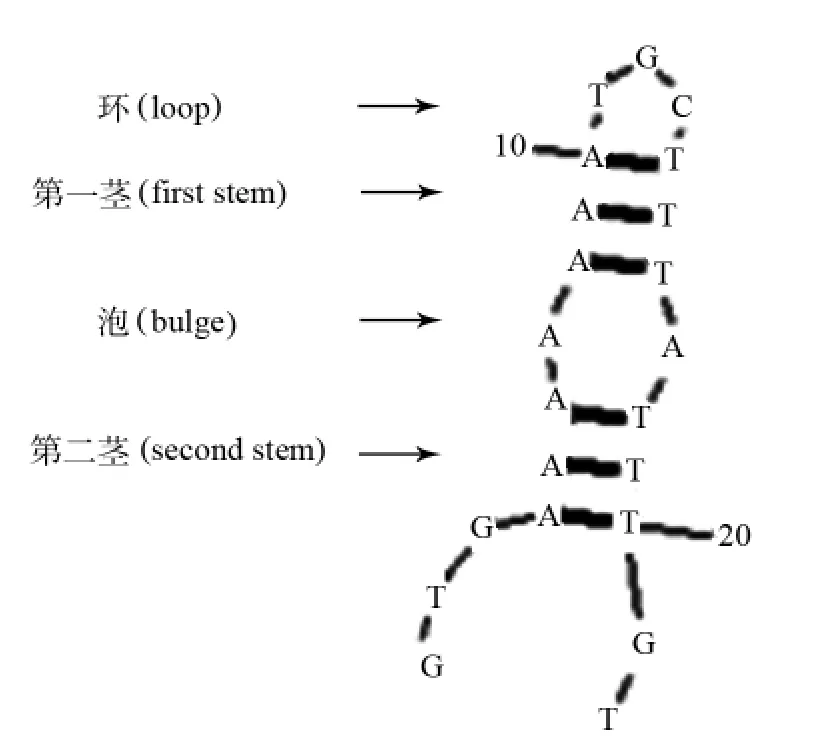
图1 22R经软件分析的茎环结构
1.2.2 表达载体的构建 合成带有22R突变位点的模板序列,见表1、表2。用带有酶切位点引物PCR扩增合成的模板,引入酶切位点。将突变序列插入pEGFP-C1质粒,利用XbaⅠ和NheⅠ酶切位点可使T4DNA连接酶连接但是连接以后对2种酶均不敏感的特性,制成带有22R突变序列的2串联质粒,将突变的插入序列切下连入C1-Alu14质粒(pEGFP-C1-Alu14)的 GFP基因和 Alu串联序列之间,测序正确后用于实验。
1.2.3 细胞培养 HeLa细胞常规培养于含体积分数为10%的灭活新生小牛血清和抗生素的DMEM培养液中,于37℃、体积分数5%的CO2培养箱培养,用质量分数为0.25%的胰酶消化,培养瓶温箱培养3d,使细胞处于对数生长期,进行实验。
1.2.4 细胞转染 用质粒(包括重组表达载体和pEGFP-C1)0.4μg和 Lipofectamine TM 2000(Invitrogen Carlsbad,USA)2μL瞬时转染培养于24孔板的HeLa细胞,于37℃、体积分数5%的CO2环境中继续培养36h,用于荧光细胞计数。
1.2.5 荧光细胞计数 细胞转染36h后取出,甩干培养基,每孔加入0.5mL体积分数为4%多聚甲醛PBS固定,固定20min后用PBS洗2遍。在100倍视野白光下计数细胞总数,同样视野紫兰光下计数荧光阳性细胞数,计数细胞总数至少500个,按以下公式计算荧光细胞阳性率。实验数据以均数±标准差()表示。

2 结果
2.1 22R序列loop突变对GFP报告基因的表达作用
将HeLa细胞用胰酶消化,用DMEM完全培养基配成2×105/mL加入24孔培养板中,每孔0.5mL,于37℃、体积分数5%的CO2条件下培养24h,用构建的插入loop突变序列的质粒转染,每孔转染量均为0.4μg质粒/2μL脂质体。转染后培养36h,固定细胞用荧光显微镜观察荧光阳性细胞的比例,结果见表3。loop的碱基类型显著影响GFP基因表达,AAG、AGA、TGT、TTG和 TGC(22R,野生型)5个质粒促进基因表达作用比较明显(表3中字体斜体加粗标出)。AAA质粒活化基因的作用最弱。
2.2 22R序列泡突变对GFP报告基因的表达作用
HeLa细胞用胰酶消化,用DMEM完全培养基配成2×105/mL加入24孔培养板中,每孔0.5mL,于37℃、体积分数5%的CO2条件下培养24h,用构建的插入泡突变序列的质粒转染,每孔转染量均为0.4μg质粒/2μL脂质体。转染后培养36h,固定细胞用荧光显微镜观察荧光阳性细胞的比例,结果见表4。泡的碱基类型显著影响GFP基因表达,有2个质粒,即VECT、VEGT,促进基因表达与22R(VEAA,野生型)类似,其荧光阳性率分别为2.70%和1.73%,连同22R用空心字体标出(表4)。VETA、VETC、VETG和VETT 4个质粒更加明显地促进GFP基因表达,荧光阳性率分别为5.60%、2.96%、12.76%和20.34%,在表4中,字体斜体加粗标出。这几个插入序列具有高度活化GFP基因作用的质粒,有1个共同的特点,即均含有“AAATAAA”片段,这段序列在活化基因中是否有重要作用,又构建AA、TT、7pieA 和7pieT序列,插入 C1-Alu14质粒的GFP基因和Alu串连序列之间,结果发现,AA序列(GTGAAATAAATGCAAATAAAGT)明显活化基因(表4,序列号17),TT、7pieA和7pieT插入序列活化基因作用较弱或不能活化GFP基因。

表1 构建22R环的突变表达载体的引物或模板

表2 构建22R泡的突变表达载体的引物或模板

表3 22R环的突变对GFP基因表达的影响
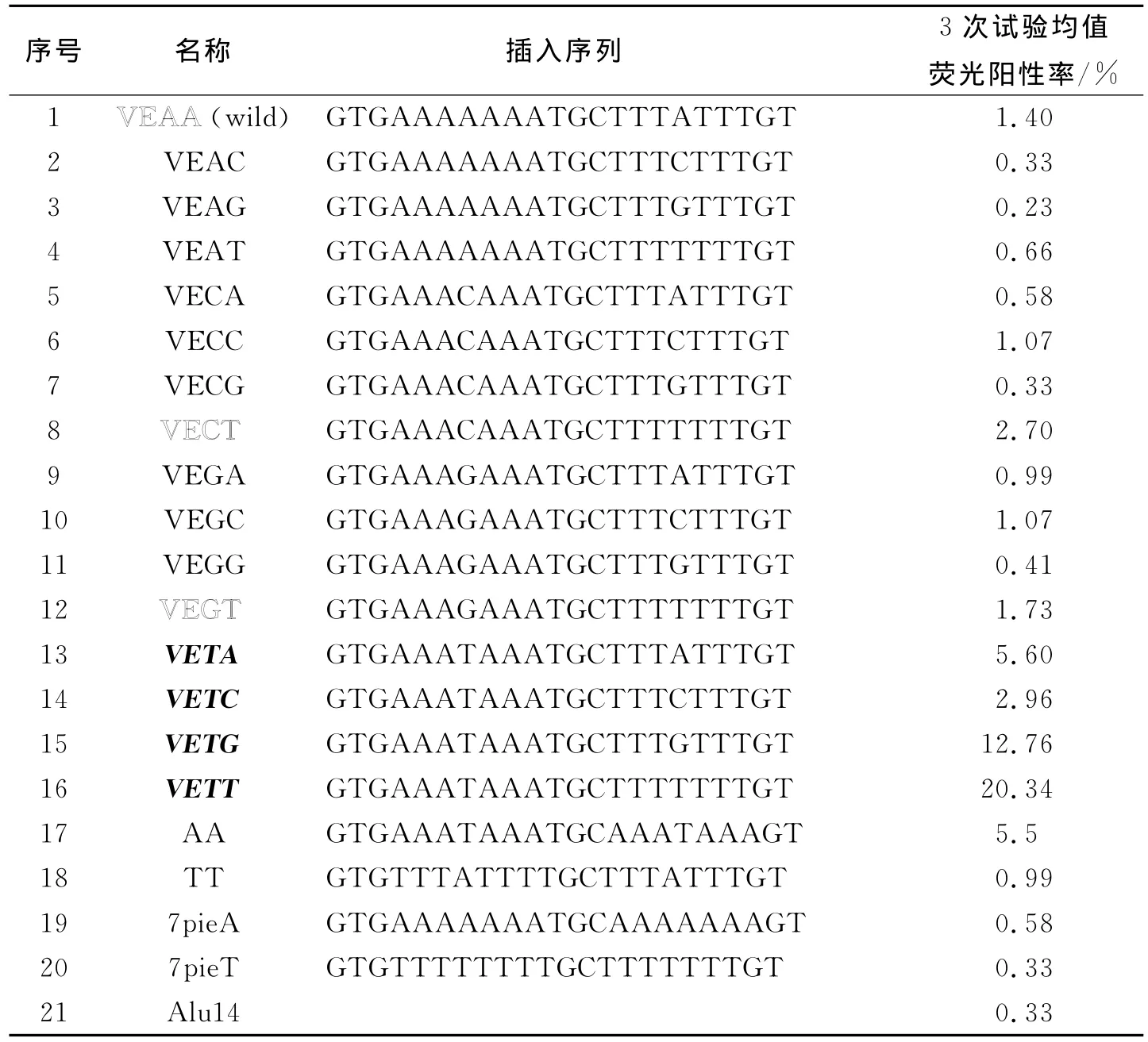
表4 22R泡的突变对GFP基因表达的影响
3 讨论
我们查阅到的有关茎环结构对生物学功能影响的文献,其中多数使用病毒作为研究实体。噬菌体N4启动子区含有多个5~7bp长的反向重复序列,反向重复序列间隔3个碱基(形成环),这样的序列可形成茎环结构,是噬菌体生存所必需的[13-14]。
我们观察到22R序列的loop碱基突变中,AAG、AGA、TTG和TGT活化基因作用最强,这4个序列以AG或TG为主,其中AAG与TTG类似,AGA与TGT类似,这样的序列和结构是否有助于活化基因,有待于进一步研究。
我们也查阅到了泡的改变,影响病毒复制工作。有专家[15]报道,病毒的第35个碱基 A(A35)与其他碱基不互补,可形成该区域茎环结构的泡,如果删除A35,它所在区域的序列就完全互补,病毒就无法复制[15]。文中对22R的泡部位全部可能的突变42=16种排列组合,均作了观察,发现有2个质粒,即VECT、VEGT,促进基因表达与22R(VEAA,野生型)类似,其荧光阳性率分别为2.70%和1.73%(表4),这2个质粒均有 TTTTTTT片段。有TTTTTTT片段的质粒共有4个,即VEAT、VECT、VEGT及VETT,其中除了VEAT(过度互补)以外均可以活化基因。重要的是发现了,VETA、VETC、VETG和VETT插入片段的4个质粒更加明显地促进GFP基因表达,荧光阳性率分别为5.60、2.96、12.76和20.34(表4)。这几个具有高度活化GFP基因作用的质粒有一个共同的特点,即均含有“AAATAAA”序列片段,这段序列在活化基因中是否有重要作用,又构建AA、TT、7pieA及7pieT序列,插入C1-Alu14质粒的GFP基因和Alu串连序列之间,结果发现,AA序列(GTGAAATAAATGCA AATAAAGT)明显地活化基因(表4,序列号17),但是活化基因作用低于VETT序列(GTGAAATAA ATGCTTTTTTTGT,4TMI),看来AAA TAAA 需要和其他序列搭配才可以发挥最好的活化基因作用。我们实验结果初步证明,茎环结构环和泡的突变均影响其生物学功能,只有适当的茎环结构才能活化基因。
[1]Hüttenhofer A,Vogel J.Experimental approaches to identify non-coding RNAs[J].Nucleic Acids Res,2006,34(2):635-646.
[2]Morey C,Avner P.Employment opportunities for noncoding RNAs[J].FEBS Lett,2004,567(1):27-34.
[3]Mallory A C,Vaucheret H.MicroRNAs:something important between the genes[J].Curr Opin Plant Biol,2004,7(2):120-125.
[4]Fedorova L,Fedorov A.Introns in gene evolution[J].Genetica,2003,118(2/3):123-31.
[5]Shabalina S A,Spiridonov N A.The mammalian transcriptome and the function of non-coding DNA sequences[J].Genome Biol,2004,5(4):105.
[6]Lommel S A,Weston-Fina M,Xiong Z,et al.The nucleotide sequence and gene organization of red clover necrotic mosaic virus RNA-2[J].Nucleic Acids Res,1988,16(17):8587-8602.
[7]Iwakawa H O,Kaido M,Mise K,et al.Cis-acting core RNA elements required for negative-strand RNA synthesis and cap-independent translation are separated in the 3′-untranslated region of Red clover necrotic mosaic virus RNA1[J].Virology,2007,369(1):168-181.
[8]Frolov I,Hardy R,Rice C M.Cis-acting RNA elements at the 5′end of Sindbis virus genome RNA regulateminus-and plus-strand RNA synthesis[J].RNA,2001,7(11):1638-1651.
[9]Zuker M.Mfold server for nucleic acid folding and hybridization prediction[J].Nucleic Acids Res,2003,31(13):3406-3415.
[10]Rosskopf J J,Upton J H 3rd,Rodarte L,et al.A 3′terminal stem-loop structure in Nodamura virus RNA2 forms an essential cis-acting signal for RNA replication[J].Virus Res,2010,150(1/2):12-21.
[11]Wang X F,Wang X Y,Liu J,et al.Alu tandem sequences inhibit GFP gene expression by triggering chromatin wrapping[J].Gene & Genomics,2009,31(3):209-215.
[12]Yin K,Wang X,Ma H,et al.Impact of copy number of distinct SV40PolyA segments on expression of GFP report gene[J].Sci China Life Sci,2010,53(5):606-612.
[13]Gleghorn M L,Davydova E K,Rothman-Denes L B,et al.Structural basis for DNA-hairpin promoter recognition by the bacteriophage N4virion RNA polymerase[J].Mol Cell,2008,32(5):707-717.
[14]Dai X,Kloster M,Rothman-Denes L B.Sequence-dependent extrusion of a small DNA hairpin at the N4virion RNA polymerase promoters[J].Jmol Biol,1998,283(1):43-58.
[15]Li L,Kang H,Liu P,et al.Structural lability in stemloop 1drives a 5′UTR-3′UTR interaction in coronavirus replication[J].Jmol Biol,2008,377(3):790-803.
[责任编辑 时 红]
Effect of 22R loop and vesical base mutation on GFP gene expression
WANG Hong-gang1,WANG Yu-dong2(1.Department of Biochemistry and molecular Biology,Medical College,Henan University,Kaifeng,Henan 475004,China;2.Department of Preventive Medicine,Medical College,Henan University,Kaifeng Henan 475004,China)
Objective:Our work previously reported one activating gene sequences in early mRNA SV40PolyA,namely 22R(5′-GTGAAAAAAATGCTTTATTTGT-3′)which can relieve the inhibition of GFP gene induced by Alu tandem sequences.In this study,we mutated 22Rto study the role of DNA structure in its activating GFP gene expression.Methods:The 22Rand its mutated fragments were inserted into downstream of GFP gene in pAlu14to construct expression vector,transfected with HeLa cells and the expression of green fluorescence protein was observed.Results:The changing loop of 22R,AAG、AGA、TGT、TTG and TGC(22R,wild type)had the effects on significantly activating GFP gene expression (marked in black bold);changing vesical,VECT,VEGT,VETA,VETC,VETG and VETT could obviously activate GFP gene expression.Conclusion:The loop and vesical of 22R are important for 22Ractivating GFP gene.
SV40PolyA;22R;GFP;Stem-loop structure;Transfection
Q786
A
1672-7606(2011)04-0255-05
2011-09-30
王红钢(1975-),男,河南 开封 人,博士,副教授,从事基因表达调节的研究工作。
