盐藻高效遗传转化方法的确立
2011-04-05冯书营谷辉辉
冯书营 ,刘 岷 ,谷辉辉
(1.河南科技大学医学技术与工程学院,河南洛阳 471003;2.河南省中医学院第一附属医院,河南郑州 450000;3.郑州大学生物工程系,河南郑州 450001)
0 前言
盐藻是生活在海洋中的一种单细胞真核绿藻,其自身无毒无害、营养价值高,又属于真核生物、无细胞壁,便于进行遗传转化以生产外源性蛋白[1-2],目前已被开发作为一种新型的生物反应器[3]。该新型生物反应器在生产外源性功能蛋白时,遗传转化环节成为其主要限制性因素之一。关于盐藻的转化研究有文献报道,其转化方法有基因枪法[4]和电击法[5],但二者方法都存在操作繁琐、转化率低等缺点,限制了二者的应用。鉴于该研究现状,本文作者借鉴于其他藻类的转化方法[6],在盐藻中建立起新型的玻璃珠转化法,并实现了外源报告基因 GUS的有效表达[7]。结合前期工作基础,本文进行了玻璃珠法与基因枪法、电击法等不同方法的对比研究,在转化效率、细胞损伤程度以及各方法优缺点等方面进行了比较,旨在确立一种最为适合盐藻反应器的转化方法。同时,对可能影响盐藻玻璃珠转化效率的若干因素进行了分析探讨,为进一步提高转化效率和尽早实现外源基因在盐藻中的高效表达提供有力工具和借鉴参考。
1 材料与方法
1.1 材料
1.1.1 盐藻细胞及其培养条件
盐藻藻株购自美国德州大学,培养基为 PKS液体培养基[8]。培养条件为:温度 26℃;光暗比14∶10;光照强度为50 lx。实验所用盐藻细胞是固体培养基上挑取单藻落,接种 5 mL液体培养基培养10 d,然后扩大培养至细胞浓度 106个/m L备用。
1.1.2 转化所用质粒
转化所用表达质粒为pBI221-bar,由中国科学院遗传研究所孙勇如教授惠赠。该质粒包含报告基因GUS和筛选标记BAR盒,用于筛选实验和染色观察,二者均由CaMV35S启动子驱动,结构如图1所示。
1.1.3 主要仪器及实验耗材

图1 质粒pBI221-bar结构示意图
1.2 方法
盐藻的转化分别采用基因枪法[4]、电击法[5]和玻璃珠法[7]3种方法进行,转化后按照Jefferson法[9]对细胞进行固定染色,镜检观察,计算转化细胞数。在转化实验中,每实验组设有 3组重复,实验重复 3次。同时,实验设有阴性对照组,即没有加入质粒,其余操作过程均相同的处理组。
盐藻在进行 3种不同方法转化时,分别在转化后的 12 h、24 h、36 h和 48 h计算空白组(即没有加入质粒,又没有进行转化操作的对照组)与各个转化组的细胞存活数目,比较不同转化方法对细胞的损伤程度的最低。
此外,为获得更加理想的转化结果,对玻璃珠法的转化过程操作、转化过程中转化试剂的选择和注意事项、盐藻的生长状态和生长阶段等关键环节进行了相关探讨。
1.3 数据的统计学分析
无论在不同转化方法转化效率的比较实验中,还是在转化方法对盐藻损伤程度分析性实验中,其细胞的转化数和细胞存活数均采用统计学分析软件SPSS 11.0进行了 t检验处理,检验水准 P<0.01,记录结果。
2 结果
2.1 不同转化方法对盐藻的转化结果
采用基因枪法、电击法和玻璃珠法对盐藻分别进行了转化,均取得了阳性转化结果。经组织化学染色后镜检观察,未转化的阴性对照组细胞呈浅黄色(见图2a);而转化的阳性细胞呈现蓝色(见图2b,箭头所示),说明外源质粒已成功转入盐藻细胞,并且得到了有效表达。虽然 3种转化方法均有阳性转化细胞的获得,但转化细胞的数目差别很大。通过对每种转化方法阳性转化细胞的计数,转化率以转化细胞数/转化总细胞数表示,玻璃珠法转化率最高,能够达到59%;基因枪法转化率最低,仅有0.01%;电击法转化率居中,约为 2%。造成转化率差异如此之大的主要原因与各种方法对细胞的损伤程度不一样有关。为此,本研究接下来进行了 3种方法对细胞的损伤性分析。
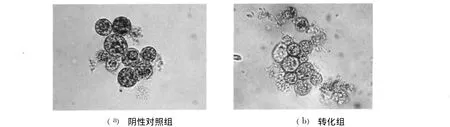
图2 GUS基因在盐藻细胞表达后的组织化学染色(400×)
2.2 不同转化方法对盐藻细胞的损伤性分析
用 3种转化方法分别对盐藻进行转化后,结果如图3所示。从图3可以看出:空白组没有进行任何转化处理操作,盐藻数目随着培养时间的延长,细胞数目在逐渐的增加。玻璃珠转化组在转化后的 12 h时,细胞数量变化不明显,存活细胞数约为90%,在随后培养的 36 h中,细胞数目变化也不明显,呈现平稳趋势。电击转化组在转化后的 12 h时,细胞数量的减少明显低于玻璃珠法转化组,但高于基因枪转化组,约有 58%的细胞存活。基因枪转化组在转化后的 12 h时,细胞数量明显减少,下降幅度最大,存活细胞数仅占 26%。由此可见,玻璃珠法转化后盐藻细胞存活数最高,电击法次之,基因枪法最低,这与三者方法的转化率高低是相对应的,直接反映出 3种方法转化率不同的原因所在。

图3 不同转化方法对盐藻细胞存活数目的影响
2.3 影响盐藻玻璃珠转化法转化效率的其他因素分析
玻璃珠转化法原理是利用微小玻璃珠在旋转体系中对宿主细胞的研磨作用,使得在细胞表面造成小而短暂的孔隙,以便外源基因进入细胞进而得以表达。在盐藻的玻璃珠法转化过程中,玻璃珠直径大小、使用量和处理方法等方面的选择对转化结果都有着较大的影响。选择直径0.5mm左右的玻璃珠,取占转化体积 30%左右的玻璃珠量对转化较为有利[6]。转化前玻璃珠的处理要科学规范,使用浓酸浸泡数小时后高温烘干,达到洁净玻璃珠表面,去除污物和油污的影响,进而增加玻璃珠的摩擦作用。在转化过程中试剂的添加也较为重要,如聚乙二醇(PEG)的使用,PEG具有较强的聚合作用,在外源质粒经细胞表面的孔隙进入细胞内部后,能够使其与细胞内部结构粘合,增加附着力,易于质粒与细胞基因组的整合。为此,在转化中选择合适类型的PEG以及PEG的浓度显得十分重要。选择聚合作用强、性能稳定的PEG产品较为有利,如PEG6000或PEG8000等。同时,PEG的使用浓度过低或过高都会造成转化率下降[7]。
盐藻细胞不同的生长阶段对转化率同样有着较大的影响。盐藻细胞的生长阶段可分为生长缓慢期、生长快速期和生长稳定期 3个时期,呈典型的 S型生长曲线[10]。在生长缓慢期,盐藻细胞生长缓慢,生命力不强,运动较活泼;而进入生长快速期时,细胞生长旺盛,运动活泼,细胞呈较大的椭圆形、绿色,生命力最强,容易吸收和容纳外界物质(见图4a);到生长稳定期时,细胞生长基本上处于停滞状态,运动受限,细胞呈圆形,颜色浅黄(见图4b)。为此,选择处于生长快速期的细胞对获得高转化率有利。在实际研究工作中,大量的转化实验研究证实了该点结果。同时,在收集盐藻细胞时,细胞的分层也要把握好。选择悬浮于培养瓶中上层的细胞为好,该层细胞运动活泼,代谢旺盛,易于转化工作。处于中下层的细胞,由于其聚集作用的产生,运行性较差,生长受限等原因,不宜选择。
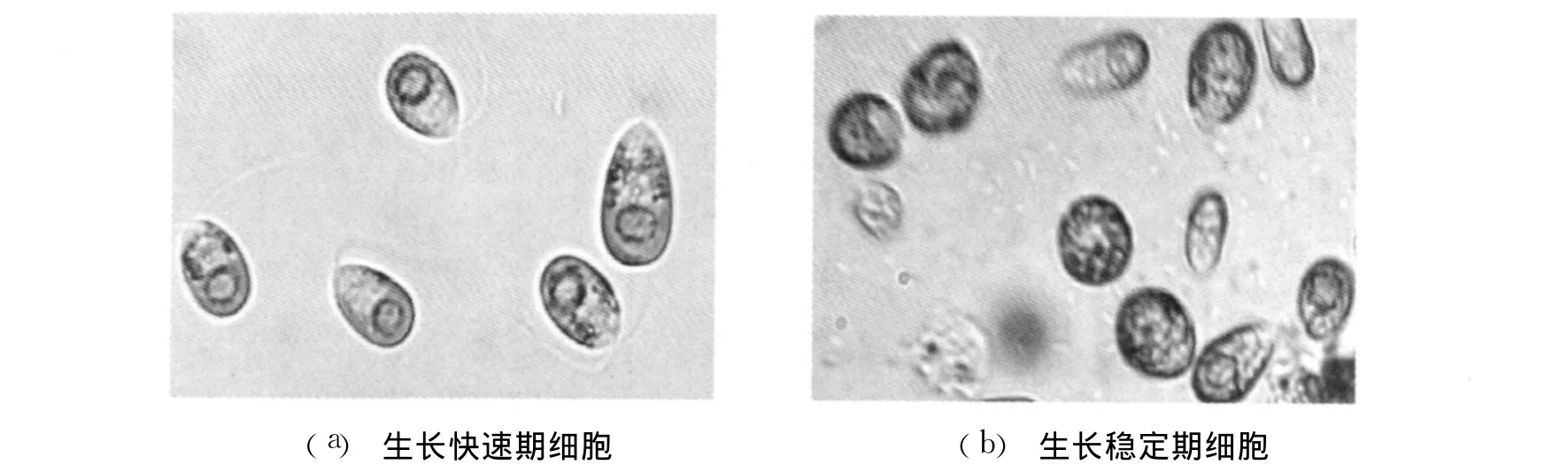
图4 处于不同生长阶段的盐藻细胞形态(400×)
3 讨论
盐藻作为一种新型的生物反应器,当前受转化环节的影响大大限制了盐藻反应器的开发利用。为此,确立一种高效的转化方法是当前亟待解决的关键环节。为克服当前存在的基因枪法和电击法的不足之处,作者尝试建立起了盐藻的玻璃珠转化法[7]。但该方法没有与基因枪法、电击法进行系统性比较分析。因此,本研究对此进行了比较研究。不仅对不同转化方法的转化效率进行了比较,而且在每种方法对细胞的损伤程度上也进行了比较。通过对 3种转化方法转化效率的比较,结果表明:玻璃珠法转化效率最高,达到59%;而基因枪法和电击法的转化效率很低,分别仅有0.01%和2%。该 3种转化方法转化效率的高低在其他不同藻类研究中存在相似性[11]。而 3种转化方法对细胞的损伤程度比较结果显示:基因枪法的损伤程度最为严重,转化后仅有 26%的细胞存活,其原因是由于受高压气体的直接冲击,造成多数细胞的破碎,使得细胞存活数目急剧下降,这也是该方法转化效率低下的重要原因所在。玻璃珠法对细胞的损伤程度最轻,转化后约有 90%的细胞存活,这也是决定其高转化效率的重要基础。电击法对细胞的损伤程度介于二者方法之间,约有 58%的细胞存活,也客观反映了电击法转化效率高于基因枪法的原因。由此可见,转化方法对细胞的损伤程度直接影响着转化效率的高低。
此外,本文还进行了影响盐藻玻璃珠法转化结果的其他因素探讨。在盐藻玻璃珠转化法整个操作过程的把握、转化试剂的选择和使用、盐藻自身的状态等方面都给出了注意事项和把握要点,力求最大程度上提高转化效率。同时,在盐藻的转化过程中,尽可能减少不必要的操作步骤,尽可能的缩短对细胞的操作时间,对盐藻的转化也较为有利。
综上所述,通过对盐藻 3种不同转化方法的比较,玻璃珠法不仅具有较佳的转化效率、对宿主细胞的损伤作用小,而且还具有较高的经济性、重复性和可控性好等优点,最为适合盐藻细胞的遗传转化研究。同时,针对此 3种方法从不同方面又进行了各自优缺点的分析(见表1),希望为今后盐藻的转化工作提供参考。盐藻玻璃珠转化法的确立为加快盐藻生物反应器的研究步伐,及早实现外源物质在该反应器中的表达起到了积极推动作用。

表1 盐藻不同转化方法优缺点的比较
[1] Walker T L,Purton S,Becker D K,et al.Mocroalgae as Bioreactors[J].Plant Cell Rep,2005,24(11):629-641.
[2] Nikookar K,Moradshahi A H.Physiological Responses of Dunaliella Salina and Dunaliella Tertiolecta to Copper Toxicity [J].Biomol Eng,2005,22(4):141-146.
[3] 薛乐勋,潘卫东,姜国忠,等.转基因盐藻生物反应器:中国,CN 00131217.0[P].2002-07-03.
[4] Tan C,Qin S,Zhang Q,et al.Establishment of a Micro-particle Bombardment Transformation System for Dunaliella Sa lina [J].Microbiol,2005,43(4):361-365.
[5] Sun Y,Yang Z,Gao X,etal.Expression of Foreign Genes in Dunaliella by Electroporation[J].Mol Biotechnol,2005,30 (3):185-192.
[6] Kindle K L.H igh-frequency Nuclear Transformation of Ch lamydomonas Reinhardtii[J].Proc Natl Acad Sci USA,1990,87: 1228-1232.
[7] Feng S Y,Xue L X,Liu H T,et al.Improvement of Efficiency of Genetic Transformation for Dunaliella Salina by Glass BeadsMethod[J].Mol Biol Rep,2009,36:1433-1439.
[8] Fisher M,Pick U,Zamir A.A Salt-induced 60-kilodalton Plasma Membrane Protein Plays a Potential Role in the Extreme H lotolerance of the Aga Dunaliella[J].Plant Physiol,1994,106:1359-1365.
[9] Jefferson R A,Knvanagh T A,Bevan M W.GUSFsions:β-glucuronidase as a Sensitive and Versatile Gene Gusion Marker in H igher Plants[J].EMBO J,1987,6:3901-3907.
[10] 蔡卓平,段舜山.杜氏盐藻和亚心型扁藻混合培养生长的初步研究[J].水产科学,2008,27(7):330-333.
[11] Brown L E,Sp recher SL,Keller L R.Introduction of Exogenous DNA into Chlamydomonas Reinhardtiiby Electroporation [J].Mol Cell Biol,1991,11:2328-2332.
