均匀设计法优化廉价型牛凝乳酶工程菌发酵培养基
2011-04-01惠丰立程民杰赵金梅
袁 伟,惠丰立*,柯 涛,程民杰,赵金梅
(1.河南师范大学生命科学学院,河南 新乡 453007;2.南阳师范学院生命科学与技术学院,河南 南阳 473061)
均匀设计法优化廉价型牛凝乳酶工程菌发酵培养基
袁 伟1,2,惠丰立2,*,柯 涛2,程民杰2,赵金梅2
(1.河南师范大学生命科学学院,河南 新乡 453007;2.南阳师范学院生命科学与技术学院,河南 南阳 473061)
为了获得生产用廉价型牛凝乳酶工程菌发酵培养基,通过单因素试验考察发酵培养基中各组分对产酶的影响。结果显示:葡萄糖、玉米浆、酵母提取物、尿素质量浓度对产酶影响显著。以上述因素作为随机因子,进行均匀设计试验,采用逐步回归方法对试验结果进行分析。结果表明:在葡萄糖45g/L、玉米浆17g/L、酵母提取物6g/L、尿素12g/L的条件下,凝乳酶活性达342.86SU/mL,比优化前提高了1.22倍。所得培养基为重组牛凝乳酶的高效低成本生产提供了参考。
凝乳酶;工程菌;均匀设计;培养基
凝乳酶是从未断奶的小牛皱胃中提取的一种天冬氨酸蛋白酶,它可以特异性裂解牛乳中的κ-酪蛋白的Phe105-Met106之间肽键,导致牛乳凝结,因此被广泛用于干酪制造业[1-2]。凝乳酶是世界第二大酶制剂,其产量占全世界酶制剂总量的15%[3]。传统的凝乳酶是通过宰杀未断奶小牛,从其皱胃中提取的。随着小牛数量的逐年减少,这种传统而昂贵的制备方法已无法满足世界干酪需求量不断增长的需要。
利用微生物生物工程技术生产凝乳酶可以获得高纯度的凝乳酶,生产成本低,来源稳定[3]。目前全世界用于干酪生产的凝乳酶约50%以上是生物工程酶制剂,生物工程凝乳酶也得到了消费者的广泛接受[4-9]。我国尚无凝乳酶生物工程产品的生产,除少量从小牛皱胃中提取外,干酪生产所用凝乳酶主要依赖进口。凝乳酶匮缺已成为制约我国干酪生产的重要因素。
本实验室已成功将小牛凝乳酶原基因与乳酸克鲁维酵母表达载体pKLAC1相连接形成重组质粒pKLAC1-Prochy,并将其转化至非营养缺陷型工业菌株乳酸克鲁维酵母GG799中,获得了具有分泌表达重组凝乳酶能力的基因工程菌Chy1。培养基组成是决定重组凝乳酶经济可行的关键因素之一。由于目前多数生物工程凝乳酶生产培养基采用牛肉膏、蛋白胨、酵母膏等基质[5-7],但这些材料的价格较高,导致生产成本较高。因此筛选廉价型培养基,对于降低生产成本、提高生产效益具有重要意义。
均匀设计是在正交设计的基础上发明的一种新的设计方法。其特点是不考虑整齐可比性,而且完全保证均匀性,让实验点在实验范围内充分的均匀分散,这样可以大大减少实验点,且仍能得到反映实验体系主要特征的实验结果[10]。近年来采用均匀设计法对发酵培养基进行优化已有一些报道,并取得了较好的优化结果[11-14]。前期通过大量实验已筛选到适合牛凝乳酶工程菌发酵的主要培养基成分,如玉米浆、酵母提取物、尿素等,本实验进一步在单因素试验的基础上,采用均匀设计法优化牛凝乳酶工程菌发酵的廉价培养基组成,以提高其酶活性,为规模化生产凝乳酶提供依据。
1 材料与方法
1.1 菌种
牛凝乳酶重组菌株Chy1,由本实验室构建。
1.2 培养基
斜面培养基(g/L):葡萄糖20、蛋白胨20、酵母粉10、琼脂20,pH5.8~6.0;种子培养基(g/L):葡萄糖20、蛋白胨20、酵母粉10,pH5.8~6.0;发酵基础培养基(g/L):葡萄糖40、玉米浆20、酵母膏5、尿素15。
1.3 培养方法及培养条件
挑取单菌落转接于斜面培养基,待长出丰满菌落后挑取一环接种于50mL种子培养基中,200r/min、28℃摇床培养20h,再以10%的接种量接入50mL液体发酵培养基中(250mL摇瓶),180r/min、28℃摇床培养96h。
1.4 重组凝乳酶活性检测
将重组酵母培养液以3000r/min离心5min,上清液pH值用1mol/L H2SO4调整至2,室温条件下放置2h,然后用2mol/L Tris将上清液的pH值调至6,用于凝乳酶活性的检测。
采用Arima等[15]的方法进行凝乳酶活性的测定。用0.01mol/L CaCl2溶液配制10g/100mL脱脂乳。此溶液配制后在室温下放置40min后使用,取5mL 10g/100mL脱脂乳于35℃保温10min,加入适量稀释的酶制剂,振荡均匀并开始计时,观察管壁上开始出现凝乳颗粒为终点,记录凝乳时间(t)。在上述条件下,40min凝结1mL 10g/100mL脱脂乳的酶量定义为一个Soxhlet单位(SU)。
1.5 实验设计
1.5.1 单因素试验
根据前期大量实验筛选到适合牛凝乳酶工程菌发酵的主要培养基成分,以凝乳酶活性为考核指标,确定葡萄糖、玉米浆、酵母提取物、尿素对发酵产酶的影响及适宜质量浓度范围。
1.5.2 均匀设计试验
根据单因素试验结果,选择葡萄糖质量浓度X1、玉米浆质量浓度X2、酵母提取物质量浓度X3、尿素质量浓度X44个因素水平构建U10(1010)(中心偏差CD=0.12597)进行参数优化试验,用DPS数据处理系统软件对试验结果进行统计分析。
2 结果与分析
2.1 单因素试验
2.1.1 葡萄糖质量浓度对酶活性的影响
葡萄糖质量浓度分别为10、20、30、40、50g/L,研究葡萄糖质量浓度对酶活性的影响,结果见图1。
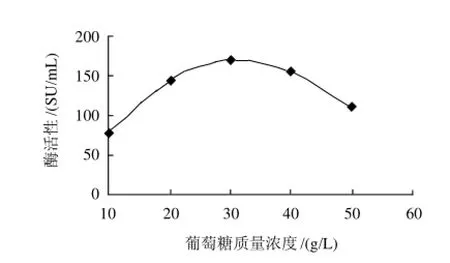
图1 葡萄糖质量浓度对酶活性的影响Fig.1 Effect of glucose concentration on chymosin activity
由图1可见,葡萄糖发酵凝乳酶的最佳质量浓度是30g/L。当葡萄糖质量浓度小于30g/L时,随着葡萄糖质量浓度的增加,凝乳酶的酶活性急剧增加,在30g/L时达到最大;而葡萄糖质量浓度大于30g/L时,随着葡萄糖质量浓度的增加,凝乳酶活性呈下降趋势。分析原因可能是碳源过多对凝乳酶的酶活性产生了抑制作用。
2.1.2 玉米浆质量浓度对酶活性的影响
玉米浆质量浓度分别为 15、20、25、30、35g/L,考察玉米浆质量浓度变化对酶活性的影响,结果见图2。当玉米浆的质量浓度提高时,体系营养增加,有利于菌体生长繁殖,使得发酵液中凝乳酶活性增加;但玉米浆的质量浓度超过25g/L时,致使加入的营养过多,抑制了菌体生长从而影响了凝乳酶的酶活性。因此玉米浆的最佳质量浓度为25g/L。
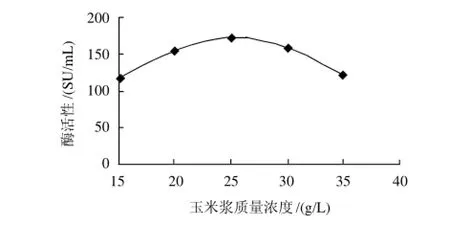
图2 玉米浆质量浓度对酶活性的影响Fig.2 Effect of corn syrup concentration on chymosin activity
2.1.3 酵母提取物质量浓度对酶活性的影响
对酵母提取物的质量浓度进行了研究,设酵母提取物的质量浓度分别是4、6、8、10、12g/L,实验结果见图3。
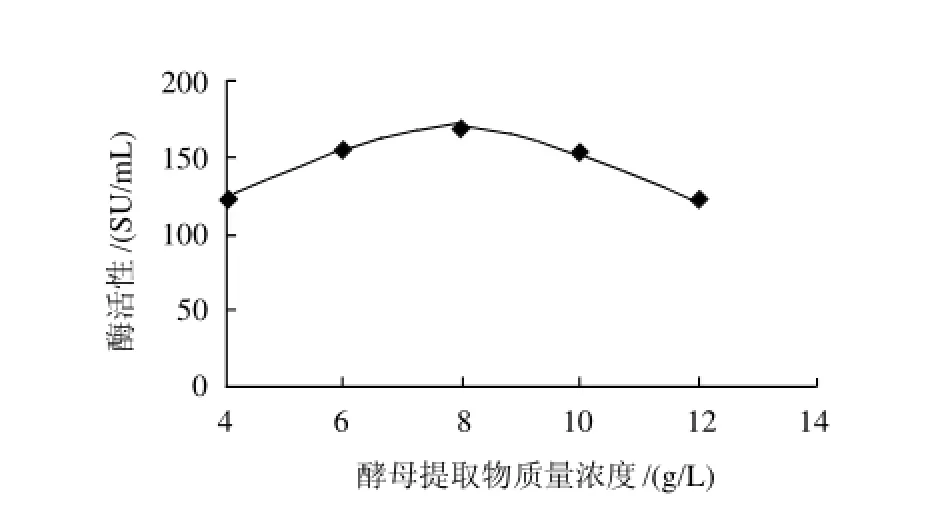
图3 酵母提取物质量浓度对酶活性的影响Fig.3 Effect of yeast extract concentration on chymosin activity
从图3可以看出,当酵母提取物的质量浓度范围在4~8g/L时,随着酵母提取物质量浓度的增加,凝乳酶活性增加很快;酵母提取物的质量浓度为8g/L时,凝乳酶的酶活性最高为169.52SU/mL;而当酵母提取物的质量浓度大于8g/L时,凝乳酶活性呈下降趋势。
2.1.4 尿素质量浓度对酶活性的影响

图4 尿素质量浓度对酶活性的影响Fig.4 Effect of urea concentration on chymosin activity
设定尿素的质量浓度分别是5、10、15、20、25g/L,尿素质量浓度对酶活性影响的实验结果如图4所示。尿素的质量浓度在15g/L时,酶活性最高;质量浓度低于15g/L时,凝乳酶活性随着尿素质量浓度的增加而显著增加,而高于15g/L时凝乳酶活性反而降低。因此尿素的最佳质量浓度是15g/L。
2.2 均匀设计优化发酵培养基
2.2.1 回归模型
为进一步探讨葡萄糖质量浓度、玉米浆质量浓度、酵母提取物质量浓度、尿素质量浓度4个参数及其交互作用对凝乳酶的酶活性的影响,以凝乳酶的酶活性为考核指标进行优化试验。表1为优化试验方案与结果。
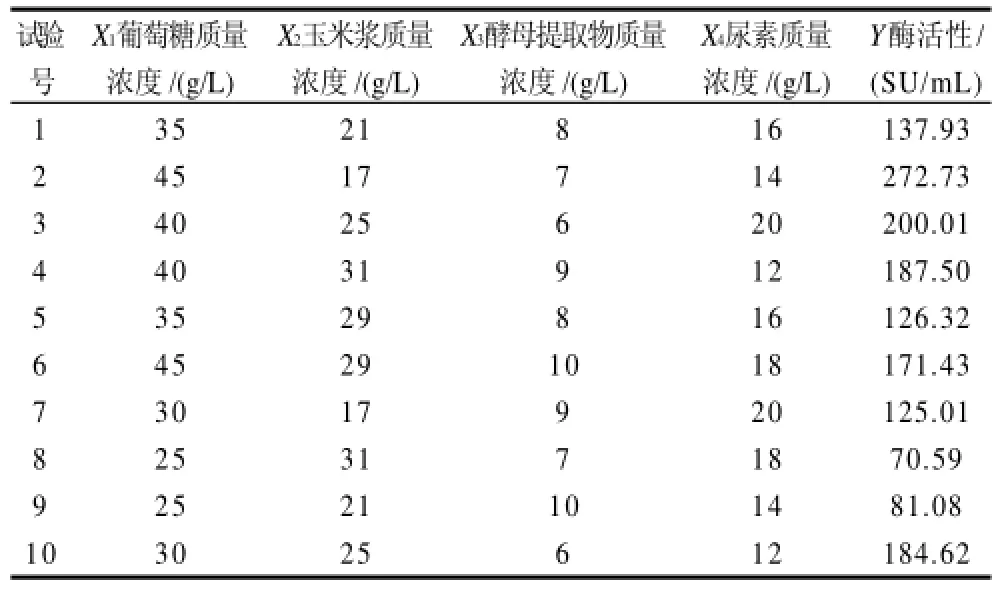
表1 U10(1010)试验方案与试验结果Table 1 Scheme and results of uniform design
利用DPS数据处理系统对试验数据进行回归分析处理,得到凝乳酶活性与各因素的回归方程为:Y=1294.9+246.75X1-532.54X2-2312.9X3+1.6264X4-26.151X12+103.48X22+1343.5X32-19.578X42。其中相关系数R为0.9999,F值为9870,作F检验,F>F0.05(8,1)=238.9,回归方程显著。由表2可知,观测值与拟合值误差非常小,准确度高。
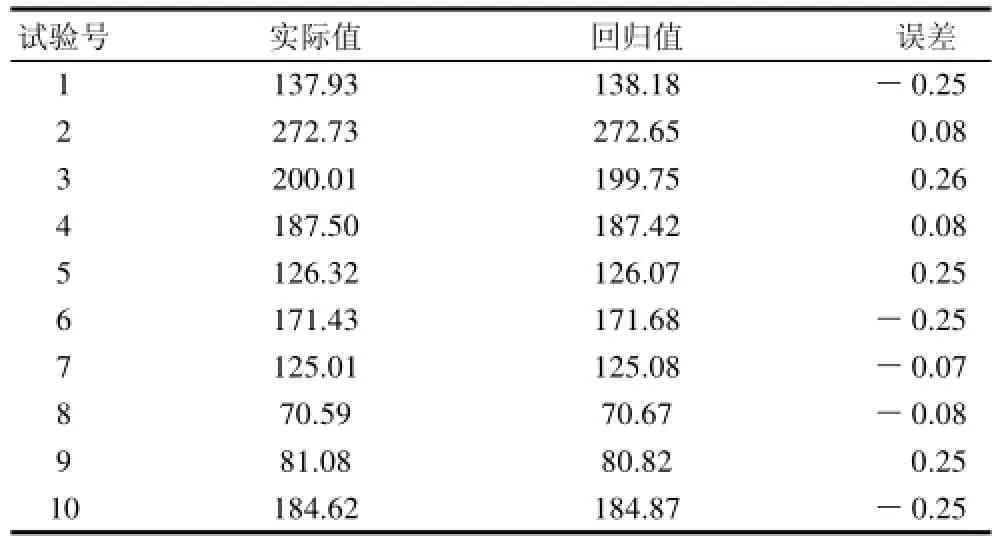
表2 回归方程预测效果Table 2 Predicted and experimental values of chymosin activity
2.2.2 单因子效应分析
根据回归方程的通径系数分析方法将相关系数分解为直接作用系数和间接作用系数,以揭示各个因数对因变量的相对重要性。用DPS数据处理系统计算X1、X2、X3、X44个参数对凝乳酶活性通径系数为:X1(0.8276)>X3(-0.3649)>X2(-0.2834)>X4(-0.2783),即在选定的4个参数中,葡萄糖对酶活性的影响最大,其次是酵母提取物和玉米浆,尿素的影响最小。
2.2.3 参数优化及验证实验
通过回归模型对培养基进行优化,得到培养基最优的试验条件,葡萄糖45g/L、玉米浆17g/L、酵母提取物6g/L、尿素12g/L,预期指标最大值(339.14±8.18) SU/mL。
为了检测模型和优化结果的准确性,配制计算得到的最优培养基进行发酵实验,3次实验的平均结果为342.86SU/mL,在模型允许的误差范围之内。说明该方法对牛凝乳酶发酵培养基优化是可行的,模型能较好地预测实际发酵情况,得到的结果可以在实践中应用。
3 结 论
3.1 通过单因素试验考察了发酵培养基各组分对产酶的影响,结果显示葡萄糖、玉米浆、酵母提取物、尿素对产酶影响显著,最佳质量浓度分别为葡萄糖30g/L、玉米浆25g/L、酵母提取物8g/L、尿素15g/L。
3.2 应用均匀设计试验对以上成分进行优化,分析结果表明,牛凝乳酶原工程菌最佳发酵培养基配方为:葡萄糖45g/L、玉米浆17g/L、酵母提取物6g/L、尿素12g/L。在此培养条件下,乳酶活性达342.86SU/mL,与模型预测值非常接近,表明该模型能很好地预测实际的发酵情况。
3.3 实验结果证明,采用均匀设计实验优化牛凝乳酶原工程菌发酵培养基组分准确可靠。由于葡萄糖、玉米浆及尿素比乳糖、蛋白胨和酵母膏等基质便宜得多。因此,本研究获得的廉价型培养基具有重要的实际应用价值,为化牛凝乳酶的工业化生产提供可靠的前提条件。
[1] WILLIAMS M G, WILSHER J, NUGENT P, et al. Mutagenesis, biochemical characterization and X-ray structural analysis of point mutants of bovine chymosin[J]. Protein Eng, 1997, 10(9): 991-997.
[2] MOHANTY A K, MUKHOPADHYAY U K, GROVER S, et al. Bovine chymosin: production by rDNA technology and application in cheese manufacture[J]. Biotechnol Adv, 1999, 17(2/3): 205-217.
[3] THAMES P. Bioteehnolngieal innovation in food processing[M]. England: Butterworth Heinenan Ltd., 2001: 113-145.
[4] CULLEN D, GRAY G L, WILSON L J, et al. Controlled expression and secretion of bovine in Aspergillus nidulans[J]. Nat Biotech, 1987, 5 (3): 369-376.
[5] EMTAGE J S, ANGAL S, DOEL M T, et al. Synthesis of calf prochymosin (prorenmin) in Escherichia coli[J]. Proc Natl Acad Sci USA, 1983, 80 (12): 3671-3675.
[6] MELLOR J. Efficient synthesis of enzymatically active calf chymosin in Saccharomyces cerevisiae[J]. Gene, 1983, 24(1): 1-14.
[7] VANDEN B J A. Kluyveromyces as a host for heterologous gene expression: expression and secretion of prochymosin[J]. Biotechnology, 1990, 8(2): 135-139.
[8] WARD M, WILSON L J, KODAMA K H, et al. Improved production of chymosin in Aspergillus by expression as a glucoamylase-chymosin fusion[J]. Biotechnology, 1990, 8(5): 435-440.
[9] 张莉, 姜媛媛, 张健, 等. 牛凝乳酶基因在毕赤酵母中的重组表达[J].生物工程学报, 2009, 25(8): 1160-1165.
[10] 王兆军. 均匀设计在参数设计中的应用[J]. 南开大学学报, 2000, 33 (2): 57- 60.
[11] 王剑锋, 李江, 王璋. 均匀设计法优化烟管菌产漆酶培养基[J]. 微生物学通报, 2007, 34(4): 625-628.
[12] 关亚鹏, 娄忻, 张莉, 等. 均匀设计法优化咪唑立宾发酵培养基配方[J]. 中国抗生素杂志, 2008, 33(8): 471-473.
[13] 代志凯, 唐嘉婕, 阮征, 等. 均匀设计优化节杆菌产β-呋喃果糖苷酶发酵培养基[J]. 食品科学, 2009, 30(19): 218-222.
[14] 李永红, 刘波, 赵宗保, 等. 圆红冬孢酵母菌发酵产油脂培养基及发酵条件的优化研究[J]. 生物工程学报, 2006, 22(4): 650-656.
[15] ARIMA K, YU J, IWASAKI S. Milk-clotting enzyme from Mucor pusillus var. Lindt[M]//PERLMAN G E, LORAND L. Methods in enzymology. New York and London: Academic Press, 1970: 446-459.
Optimization of Fermentation Medium for Genetically Engineered Chymosin Strain by Uniform Design Methodology
YUAN Wei1,2,HUI Feng-li2,*,KE Tao2,CHENG Min-jie2,ZHAO Jin-mei2
(1. College of Life Science, Henan Normal University, Xinxiang 453007, China;2. College of Life Science and Technology, Nanyang Normal University, Nanyang 473061,China)
In order to obtain a low-cost fermentation medium for recombinant chymosin strain Chy1 in a large scale, the effects of glucose, corn syrup, yeast extract and urea concentration on chymosin production by recombinant chymosin strain Chy1 were explored by single factor tests. The results indicated that the effects of glucose, corn syrup, urea and yeast extract on chymosin production were significant. The optimal fermentation medium was optimized by uniform design tests to be glucose of 45 g/L, corn syrup of 17 g/L, yeast extract of 6 g/L and urea of 12 g/L. Under these optimal conditions, the activity of chymosin can reach up to 342.86 SU/mL, which exhibited a 1.22 fold enhancement when compared with original medium. This optimal fermentation medium provided a basis for massive chymosin production by recombinant chymosin strain Chy1 with high efficiency and low cost.
chymosin;recombinant strain;uniform design methodology;low-cost medium
Q949.9
A
1002-6630(2011)07-0258-04
2010-07-03
河南省科学技术厅基础与前沿技术研究计划项目(102300410146);河南省教育厅自然科学基金项目(2010A180017)
袁伟(1987—),男,硕士研究生,主要从事微生物资源与微生物技术研究。E-mail:microbiology@yeah.net
*通信作者:惠丰立(1965—),男,教授,主要从事微生物资源与微生物技术研究。E-mail:huifl@126.com
