p38MAPK在低能 ESW和间歇 rhPTH1-34促进 ROB成骨的信号转导中的作用
2011-04-01刘长剑罗宗键
王 李,刘长剑,罗宗键
(1.大连市友谊医院医学影像科,辽宁 大连 116001;2.大连医科大学附属第一医院骨科,辽宁 大连 116011;3.长春中医药大学附属医院 骨科,吉林长春 130021)
p38MAPK在低能 ESW和间歇 rhPTH1-34促进 ROB成骨的信号转导中的作用
王 李1,刘长剑2,罗宗键3
(1.大连市友谊医院医学影像科,辽宁 大连 116001;2.大连医科大学附属第一医院骨科,辽宁 大连 116011;3.长春中医药大学附属医院 骨科,吉林长春 130021)
[目的]探讨低能体外冲击波(ESW)和间歇人重组甲状旁腺素(rhPTH 1-34)刺激引起的体外培养大鼠成骨细胞(ROB)成骨的细胞内信号转导中 p38MAPK的作用。[方法]分别用有效的低能ESW刺激和间歇 rhPTH 1-34作用于 ROB,并设立加入 p 38MAPK抑制剂 SB203580组,来观察 ROB增殖、成骨指标及 Western Blot检测的p38MAPK磷酸化激活变化。[结果]p38MAPK抑制剂 SB203580能明显抑制 120次 0.18m J/mm2ESW刺激引起的ROB细胞增殖和成骨作用(P<0.05);但不能明显抑制 10-11mol/L间歇rhPTH 1-34刺激引起的体外培养 ROB细胞增殖及成骨作用(P>0.05)。ESW应力刺激可促进 p-p38MAPK表达,但间歇 rhPTH 1-34不能促进 pp38MAPK表达。[结论]适当的ESW应力刺激可通过激活p 38MAPK促进体外培养ROB增殖和成骨;但p38MAPK并不参与 10-11mol/L间歇 rhPTH 1-34刺激引起的 ROB细胞增殖和成骨的细胞信号转导。
成骨细胞;体外冲击波;rhPTH 1-34;p38MAPK
现已知多种理化因素能参与影响体内、外成骨过程的各个环节,各种因素在此过程中并非只是单独调节骨形成或骨吸收,而是对骨吸收和骨形成在不同的组织、不同的时间段起不同的作用,经综合、交叉作用后共同完成对成骨的调节。体外冲击波(extracorporeal shock wave,ESW)和甲状旁腺素(parathyroid hormone,PTH)对成骨细胞的作用引人注目。ESW可以一种机械能的形式进入骨折部位,骨组织对高频率、低强度的机械刺激敏感,而低能量的 ESW正好可持续给予骨折部位的骨组织这种应力刺激;大量研究证明,频率、能量强度适合的 ESW可促进骨愈合[1,2]。PTH是成骨调节的重要因素,连续给予较高剂量 PTH可使实验动物破骨细胞数量和活性增加,促进骨吸收;而周期性低剂量给予PTH可使动物活体成骨作用增加[3,4]。但是,ESW和PTH作用的信号机制并不清楚。研究表明,p38MAPK参与多种细胞增殖分化的细胞信号转导,本研究对 p38MAPK是否参与 ESW和间歇rhPTH1-34促进体外培养大鼠成骨细胞(ROB)增殖、成骨的信号转导进行了探讨。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:出生 24 h内 Wistar大鼠乳鼠(大连医科大学实验动物中心,雌雄不拘,清洁级)每次取 6只大鼠乳鼠颅骨消化分离成骨细胞,分瓶培养、扩增进行实验。
1.1.2 试 剂:PI染液、RNA酶(北京鼎国生物技术公司),ALP活性检测试剂盒(南京建成公司),高糖 DMEM培养基(美国 Hyclone公司),胎牛血清(杭州四季青公司),SB203580(美国 sigma生物),细胞全蛋白提取试剂盒(凯基生物),蛋白定量试剂盒(凯基生物),磷酸化 P38 MAPK一抗(美国 Santa Cruze生物),ECL放射显影试剂盒(美国 Amershan生物),其它试剂均为国产分析纯。
1.1.3 主要仪器和设备:体外冲击波碎石机(MODELKDE-2001A,北京中科建安公司),流式细胞仪(B.D.FACSAria,美国 B.D.公司),恒温二氧化碳培养箱(SeriesⅡ Waterern Jacketed CO2Incubator,美国 Thermo Electron公司),超净工作台 (Forma ClassⅡ A2 Biological Safety Cabinet,美国 Thermo E-lectron公司),立式灭菌器 (LMQ.R-4060,山东新华医疗仪器公司),Western Blot放射显影曝光暗室及洗片机,电泳仪(EC120 Mini Vertical Gel System,美国 Thermo Electron)。
1.2 实验方法
细胞培养,参见作者以前报道的方法[5]。简要程序如下:取出生 24 h内 Wistar大鼠乳鼠,浸泡于75%酒精中 5~10min,在超净工作台中取出颅骨,仔细刮除表面附着的软组织,剔除骨缝之间软骨,用128 U/mL庆大霉素浸泡冲洗骨块 3次,用 DHank's液冲洗 2次,至骨块发白透亮,置于另一无菌平皿中;用 0.1%I型胶原酶覆盖骨块,消化 20 min,吸弃上清及消化掉的细胞,用眼科手术剪将骨块剪碎至 1 mm3甚至更小,加入 0.1%I型胶原酶消化 30m in,透过纱布吸取消化液,移至装有 DMEM的离心管中终止消化,再次加入 0.1%I型胶原酶消化 30 min,重复消化共 3次。将获得的细胞用 DHank's液洗 2次,悬浮于含 10%胎牛血清的DMEM中,调整细胞浓度至 104~105个 /m L,接种于中培养瓶中(视细胞数目一般可接种 2~3瓶),置 5%CO2、37℃培养箱中培养,3~5 d换液,细胞长致融合状态时消化传代(1∶2)。
1.2.1 刺激方式及分组:取体外培养第 3代 ROB,刺激之前将 ROB培养于不含血清的培养基中 24 h,使培养的细胞同步化,然后更换含去类固醇血清的培养基。
10-11mol/L间歇 rhPTH1-34刺激方式:在每24 h的前 8 h刺激,共循环 2个 24 h。ESW刺激方式:将 MODEL KDE-2001体外液波碎石机调整形成能量密度为 0.18m J/mm2的低能冲击波。将目标细胞装入细胞冻干瓶中,然后通过 C型臂 X射线透视装置将冻干瓶定位在半椭圆形的第 2焦点处,用该能量的冲击波分别作用含有 ROB细胞悬液(5×105/m L)的细胞冻存管 120次(剂量参照作者前部分实验已经发表的论文)[5],每组设 3个样本。
分组:

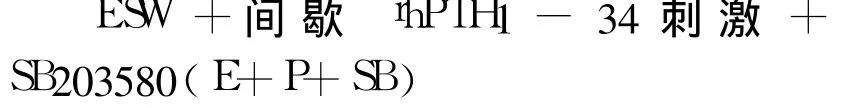
1.2.2 MTT(噻唑兰)法检测细胞增殖:分组刺激后,将细胞培养于含 10%去类固醇 FBS的高糖DMEM中 48 h;然后将培养液弃去,每孔加入 MTT应用液 20μL,继续培养 4 h,每孔加入 150μL二甲基亚砜(DMSO)孵育 20 min。调整酶标仪波长为490 nm,测定每孔吸光度。
1.2.3 流式细胞术(FCM)进行 DNA倍体分析检测ROB增殖指数:取第 3代成骨细胞,分组刺激后,培养于含 10%去类固醇 FBS的高糖 DMEM中 24 h。收集细胞,离心弃培养液,70%乙醇固定,置 4℃冰箱过夜。检测前加 RNA酶溶解 RNA,加 PI染液,避光孵育 30 min,按试剂盒说明上机检测。用 Modfit分析软件分析图像,得出处于各个细胞周期的细胞比例,计算 ROB细胞增殖指数(PI指数):PI=S%+G2%。
1.2.4 酶标仪检测 ROB细胞内 ALP活性:分组刺激,将细胞悬浮于含 10%去类固醇 FBS的高糖DMEM中,调整细胞浓度为 2×104/mL,加入 96孔板,培养于 37℃、5%CO2和饱和湿度的恒温培养箱内 72 h。按试剂盒操作步骤处理 96孔板中的细胞,在 405 nm波长下测定各孔的吸光度。按如下公式计算样品中碱性磷酸酶(ALP)活性:
ALP活性(金氏单位/100 mL)=(测定管吸光度 /标准管吸光度)×0.005×(100/0.05)
1.2.5 Western Blot检测 p38MAPK磷酸化激活状态的变化:探讨 p38MAPK在 ESW和间歇 rhPTH 1-34促进体外培养大鼠成骨细胞(ROB)成骨的细胞信号转导中的作用。
1.3 统计学方法
所有数据采用 SPSS13.0统计分析软件分析。数据均以 mean+SD表示,根据方差齐性与否,组间差异采用 ANOVA方差分析或校正方差分析,组间比较采用 LSD法。P<0.05为差异有统计学意义。
2 结 果
2.1 MTT法检测细胞增殖
可见 10-11mol/L间歇 rhPTH 1-34刺激可显著增加 A490值(P<0.01),这种促进作用不能被p38MAPK抑制剂 SB203580所明显抑制,提示 10-11mol/L间歇 rhPTH 1-34刺激并不通过激活p38MAPK促进 ROB增殖;0.18 mJ/mm2ESW冲击120次可显著增加 A490值(P<0.01),而这种促进作用能被SB203580所明显抑制(P<0.05),提示 ESW是通过激活 p38MAPK促进 ROB增殖;同样,ESW+PTH刺激可显著增加 A490值(P<0.01),而这种促进作用能被抑制剂 SB203580所明显抑制(P<0.05),提示 ESW是通过激活 p38MAPK起作用,详见表 1。
2.2 流式细胞术(FCM)进行 DNA倍体分析检测ROB增殖指数(PI指数)
可见 10-11mol/L间歇 rhPTH1-34刺激可显著增加 FCM检测到 ROB的 PI值(P<0.01),这种促进作用不能被 p38MAPK抑制剂 SB203580所明显抑制,提示 10-11mol/L间歇 rhPTH1-34刺激并不通过激活 p38MAPK促进 ROB增殖;0.18 mJ/mm2ESW冲击 120次可显著增加 ROB的 PI值(P<0.01),而这种促进作用能被 SB203580所明显抑制(P<0.05),提示 ESW是通过激活 p38MAPK促进ROB增殖;同样,ESW+PTH刺激可显著增加 PI值(P<0.01),而这种促进作用能被抑制剂 SB203580所明显抑制(P<0.05),提示 ESW是通过激活p38MAPK起作用,见表 1。
2.3 酶标仪检测 ROB细胞内 ALP活性
可见 10-11mol/L间歇 rhPTH1-34刺激可显著增加 ROB的细胞内 ALP活性(P<0.01),这种促进作用不能被 p38MAPK抑制剂 SB203580所明显抑制,提示 10-11mol/L间歇 rhPTH1-34刺激并不通过激活 p38MAPK促进 ROB成骨;0.18 mJ/mm2ESW冲击 120次可显著增加 ALP活性(P<0.01),而这种促进作用能被 SB203580所明显抑制(P<0.05),提示 ESW是通过激活 p38MAPK促进 ROB成骨;同样,ESW+PTH刺激可显著增加 ALP活性(P<0.01),而这种促进作用能被抑制剂 SB203580所明显抑制(P<0.05),提示 ESW是通过激活p38MAPK起作用,见表 1。
2.4 Western Blot检测 p38MAPK磷酸化激活状态
可见 10-11mol/L间歇 rhPTH1-34刺激并不能促进磷酸化激活的 p-p38MAPK表达;0.18 mJ/mm2ESW冲击 120次可显著增加 p-p38MAPK表达(P<0.01),提示 ESW是通过激活 p38MAPK促进 ROB成骨;同样,ESW+PTH刺激可显著增加p-p38MAPK表达(P<0.01)。见图 1~3。

表 1 SB203580对 ESW刺激和间歇性rhPTH 1-34(10-11mol/L)刺激对ROB成骨分化的影响Tab 1 Effectof SB 203580 to ESW and rhPTH 1-34 stimulations'affection to ROB
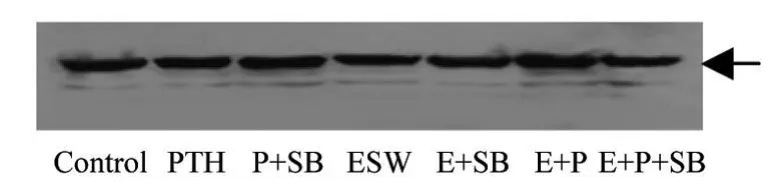
图1 内参 β-tubulin(54 kD)Fig 1 Exp ression ofβ-tubu lin(54 kD)

图2 磷酸化p38MAPK(38 kD)Fig 2 Expression of p 38MAPK(38 kD)
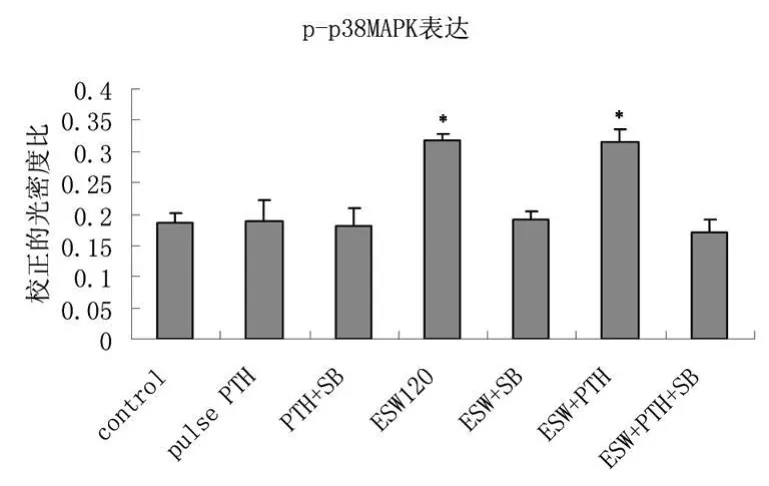
图3 用 Western Blot检测 p-p 38MAPK表达Fig 3 P-p38MAPK expression detected by WB*与对照和加入SB 203580组比较,P<0.01
3 讨 论
PTH是参与调节体内成骨的重要因素。常人PTH分泌呈日节律波动,6AM最高,4PM最低,PTH浓度于 1~5×10-12mol/L之间波动。人体内 PTH的分泌遵循两种时相原则:①PTH分泌量在频繁活动中,这种浓度特点可以调节血钙平衡;②PTH分泌状态高度稳定,每天的分泌次数、分泌量都有一定规律,这一浓度特点有助于维持正常骨量及骨代谢。此两种时相被某种生理“开关”控制,在需要时会相互转换,因而不同的 PTH使用方案会有截然不同的影响体内成骨的效果[6]。体内骨质的溶解和重塑是处在一个动态平衡之中,这种动态平衡又依赖于成骨细胞(OB)和破骨细胞(OC)功能之间的平衡。PTH对 OB和 OC功能的平衡调节是非常精细和微妙的,在某一低浓度范围内,OB和 OC分化和功能处于平衡状态,所以骨代谢保持平衡;如果 PTH浓度持续升高,OC的重吸收作用继续增加,而 OB的成骨作用却相对减弱或消失,结果会导致骨质吸收增加[7-9]。研究表明,高浓度持续 PTH刺激可引起骨质疏松,这种情况可见于甲旁亢所引起的骨质疏松[10];而低剂量间歇 rhPTH1-34刺激却被证明可促进成骨。本实验用已经证明可促进 ROB增殖成骨[11]的 10-11mol/L间歇低剂量 rhPTH1-34刺激作用于 ROB,用 p38MAPK抑制剂 SB203580来试图抑制其促进 ROB成骨的作用,发现 SB203580并不能抑制 10-11mol/L间歇低剂量rhPTH 1-34刺激促进ROB增殖成骨的作用,说明低剂量间歇 rhPTH1-34刺激并非通过激活 p38MAPK促进ROB成骨。
适当的应力刺激可以促进体内、外成骨,因而近来在骨组织工程构建方式上提出应力化、持续灌流构建的概念[12-14]。多个关于 ESW的研究证实,ESW可以使作用部位的流体力学状态改变并对处于作用范围中的细胞产生流体剪切应力(FSS)和牵拉作用[15,16];成骨细胞和骨细胞一直被认为是主要的应力感受细胞,实验表明适当的0.18mJ/mm2ESW刺激可显著促进ROB增殖和成骨分化。本实验采用已经证明可明显促进 ROB成骨的 ESW刺激[11]作用于ROB,并借助p38MAPK抑制剂 SB203580来观察 ESW是否通过 p38MAPK起作用;发现,SB203580可明显抑制 ESW促进 ROB增殖成骨的作用,更进一步Western Blot检测证实了 ESW可促进 ROB中磷酸化激活的 p38MAPK的表达,说明 ESW刺激确实通过激活 p38MAPK促进 ROB成骨。
在人体环境中,成骨细胞处于生理剂量 PTH作用和持续不断的应力刺激之下,这两种因素共同作用对 ROB增殖、分化的影响和机制尚不清楚。本研究采用间歇 rhPTH1-34(1×10-11mol/L,每 24 h的前 8 h刺激,连续刺激 2个 24 h)与 0.18 mJ/mm2ESW(120次)刺激共同作用于体外培养的 ROB(为尽量排除血液中其他活性成分的干扰,实验过程中采用去类固醇血清),结果发现,rhPTH 1-34间歇刺激 +0.18 m J/mm2ESW(120次)刺激作用最强,能明显促进 ROB体外增殖和成骨分化,作用显著强于 0.18 mJ/mm2ESW(120次)组和 rhPTH1-34(1×10-11mol/L间歇刺激);这也有助于解释为什么体育锻炼和低剂量间歇 PTH注射可以促进骨质形成。这种促进作用也可被 p38MAPK抑制剂SB203580所明显抑制,这也印证了 p38MAPK参与ESW+PTH促进 ROB成骨的作用过程,与前面的结论相印证。
在体内环境中(PTH和应力刺激并存),骨吸收和骨形成保持平衡。如果出现抑制骨形成、促进骨吸收的因素,如甲旁亢造成持续超生理剂量 PTH刺激或者缺乏运动等因素,这一平衡会向骨质吸收倾斜,出现骨质疏松等表现;如果出现促进骨形成、抑制骨吸收的因素,如低剂量间歇 PTH刺激和适当的应力刺激等,这一平衡会向骨质形成倾斜。虽然,低剂量间歇 PTH刺激和适当的应力刺激被观察到可促进体外培养的 ROB增殖、成骨分化,并且p38MAPK参与 ESW作用的信号转导,但这些作用的详细分子机制远未明了,尚需进一步研究。
[1]Yeung-Jen Chen,Yur-Ren Kuo,Kuender D,et al.Activation of extracellular signal-regulated kinase(ERK)and p 38 kinase in shock wave-promoted bone formation of segmental defect in rats[J].Bone,2004,34(3):466-477.
[2]FSWang,KD Yang,YR Kuo,et al.Temporal and spatial exp ression of bonemorphogenetic proteins in extracorporeal shock wave-promoted healing of segmental defect[J].Bone,2003,32(4):387-396.
[3]Saito M,Marumo K,Kida Y,et al.Changes in the contents of enzymatic immature,mature,and non-enzymatic senescent cross-links of collagen after once-weekly treatment with human parathyroid hormone(1-34)for 18 months contribute to improvement of bone strength in ovariectom ized monkeys[J].Osteoporos Int,2010 Oct 20.[Epub ahead ofprint]
[4]Fujita T.Parathyroid hormone in the treatment ofosteoporosis[J].Biodrugs,2001,15:721-728.
[5]刘长剑,刘建国,于铁成,等.I型胶原酶阶段消化法体外培养、纯化及鉴定大鼠成骨细胞[J].中国老年学杂志,2007,6(27):525-527.
[6]YaoGQ,Wu JJ,Troiano N,etal.Targeted overexpression of Dkk1 in osteoblasts reduces bonemass but does not impair the anabolic response to interm ittent PTH treatment in mice[J].J Bone Miner Metab,2010 Jul 3.[Epub ahead of print]
[7]Borba VZ,Maas NC.The use of PTH in the treatmentof osteoporosis[J].Arq Bras Endocrinol Metabol,2010,54(2):213-219.
[8]Kamo K,Miyakoshi N,Kasukawa Y,et al.Intermittent weekly administration of human parathyroid hormone(1-34)improves bone-hydroxyapatite block bonding in ovariectomized rats[J].J Bone Miner Metab,2010,28(6):634-640.
[9]DA Dossing,JM Radeff,JSanders,et al.Parathyroid hormone stimulates translocation of protein kinase C isozymes in UMR-106 osteob lastic osteosarcoma cells[J].Bone,2001,29(3):223-230.
[10]Rowshan HH,Parham MA,Baur DA,etal.Effect of intermittent systemic administration of recombinant parathyroid hormone(1-34)on mandibu lar fracture healing in rats[J].JOral Maxillofac Surg,2010,68(2):260-267.
[11]刘长剑,刘建国,于铁成,等.低能体外冲击波(ESW)和低剂量间歇rhPTH 1-34刺激对体外培养成骨细胞增殖分化的影响[J].中华创伤骨科杂志,2007,9(11):1062-1067.
[12]Aleksyniene R,Thomsen JS,Eckard t H,et al.Parathyroid hormone PTH(1-34)increases the volume,mineral content,and mechanical properties of regenerated m ineralizing tissue after distraction osteogenesis in rabbits[J].Acta Orthop,2009,80(6):716-723.
[13]Sethi BK,Chadha M,Modi KD,etal.Efficacy of teriparatide in increasing bone mineral density in postmenopausal women with osteoporosis-an Indian experience[J].JAssoc Physicians India,2008,56:418-424.
[14]Sugiyama T,Saxon LK,Zaman G,etal.Mechanical loading enhances the anabolic effects of intermittent parathyroid hormone(1-34)on trabecular and corticalbone in mice[J].Bone,2008,43(2):238-248.
[15]Ling Qin,Pikkwan Fok,Hongbin Lu,et al.Low intensity pu lsed u ltrasound increases the matrix hardness of the healing tissues at bone-tendon insertion-a partial patellectomy model in rabbits[J].Clin Biomech,2006,21:387-394.
[16]McManus JF,Davey RA,Maclean HE,et al.Intermittent Fugu parathyroid hormone 1(1-34)is an anabolic bone agent in young male rats and osteopenic ovariectomized rats[J].Bone,2008,42(6):1164-1174.
Role of p38MAPK in signal transduction of low density ESW and low dose interm ittent rhPTH1-34′saction on bone form ation of cultured rat osteoblasts
WANG Li1,LIU Chang-jian2,LUO Zong-jian3
(1.DepartmentofMedical Radiology,the Friendship Hospitalof Dalian,Dalian 116001China;2.Orthopedic department,the First Affiliated Hospital of Dalian Medical University,Dalian 116011 China;3.Orthopedic department,Affiliated Hospital of Changchun Chinese Medicine University,Changchun 130021 China)
[Objective]To investigate the role of p38MAPK in the signal path way of low density ESW and low dose intermittent rhPTH 1-34 stimu lation′s action on rat osteoblasts.[Methods]After stimulations of 0.18 mJ/mm2ESW and 10-11mol/L intermittent rhPTH 1-34,the specific inhibitor of p38MAPK was added for finding the roleof p 38MAPK in the intracellular signal path way.The rat osteoblasts were collected,and cu ltured was detected,p roliferation of these cells was observed by MTT and bone formation bymeasuring ALP activity.The exp ression of p-p38MAPK was detected by Western blot.[Results]Enhaning effect on bone formation by ESW can be significantly inhibited by SB203580,a inhibitor of p38MAPK(P<0.05).But the enhancement of ROBs'bone formation by intermittent rhPTH 1-34 can not be inhibited by SB203580.Suitable ESW stimulation can improve the expression ofp38MAPK,but intermittent rhPTH 1-34 stimulation can not.[Conclusions]Suitable ESW stimulation can enhance bone formation of ROB by activation of p 38MAPK.The enhancement of ROBs'bone formation by intermittent rhPTH 1-34 stimulation dosen't depend on activation of p38MAPK.
osteoblast;extracorporeal shock wave(ESW);rhPTH 1-34;p38MAPK
R 336
A
1671-7295(2011)01-0031-05
2010-11-25;
2010-12-08
王 李(1975-),女,辽宁大连人,主治医师,硕士。 E-mail:childliu@sohu.com
刘长剑,主治医师,博士。E-mail:child.liu@yahoo.com.cn
