以豆渣为基料灵芝菌丝体液体发酵饮料的研制
2011-03-31李彦宇
冮 洁,李彦宇,江 森
(大连民族学院生命科学学院,辽宁 大连 116600)
以豆渣为基料灵芝菌丝体液体发酵饮料的研制
冮 洁,李彦宇,江 森
(大连民族学院生命科学学院,辽宁 大连 116600)
研究以豆渣为基料灵芝菌丝体液态培养及酒精发酵的条件,并将其应用在果汁复合饮料的研究中,以生产新型功能性保健发酵饮料。通过对PDA液态培养基和豆渣液态培养基的对比试验,确定出豆渣培养基更适合灵芝菌丝体的生长,优化的培养基配方为豆渣90g/L、葡萄糖20g/L、MgSO4 1.5g/L、KH2PO4 1.0g/L。在灵芝菌丝体酒精发酵试验中,通过正交试验确定最佳酒精发酵条件:酵母接种量0.2%、发酵温度30℃、发酵时间5d。在灵芝发酵饮料的调配试验中,通过正交试验确定饮料的配方,通过感官评定得到色泽、风味和组织形态最佳的产品。
灵芝;豆渣;液体培养;酒精发酵;发酵饮料
灵芝(Ganoderma lucidum)是一种珍贵的药用真菌,在我国有着悠久的药用历史[1]。灵芝属担子菌亚门(Basidiomycotina)、非褶菌目(Aphyllophorales)、多孔菌科(Polyporaceae)、灵芝属(Ganoderma)。灵芝含有灵芝多糖和灵芝三萜等生物活性物质,具有广泛的药理与保健作用[2-5]。灵芝主要应用在医药行业中,而且主要利用的是其子实体和孢子。目前,将其作为功能食品的研究逐渐增加[6-7]。利用液体深层发酵技术培养食用菌菌丝体,具有培养周期短、能大规模生产、易于标准化等特点[8]。很多研究者对灵芝菌丝体液体发酵技术进行了研究[9-12]。食用菌在深层发酵培养的菌丝体与子实体在化学组成、生理功能上均很相似[13]。特别是将豆渣等农副产品下脚料应用在食用菌培养中,不仅有利于食用菌的生长,而且也使豆渣得到充分的利用。豆渣富含膳食纤维及钙、磷、铁、维生素等营养成分[14]。本实验以豆渣为基料进行灵芝菌丝体液体培养及酒精发酵,并将其进行调配,研制灵芝新型功能性保健发酵饮料。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 菌种
灵芝(Ganodema lucidum) 朝阳市食用菌研究所;酿酒酵母(Saccharomyces cerevisiae) 安琪酵母股份有限公司。
1.1.2 培养基
斜面培养基(PDA培养基):马铃薯200g、葡萄糖20g、琼脂粉20g、水1000mL,pH自然。
豆渣培养基:豆渣90g、葡萄糖20g、MgSO41.0g、KH2PO41.5g、水1000mL,pH自然。
1.1.3 材料与试剂
豆渣:大连民族学院食堂提供,含水量为82.15%;
蔗糖:食品级;葡萄糖、琼脂粉、K H2P O4、MgSO4。以上试剂均为分析纯或化学纯。
1.1.4 仪器与设备
电子精密天平(PL203) 梅特勒-托利多仪器(上海)有限公司;电热恒温培养箱(DNP-9082) 上海精宏实验设备有限公司;无菌操作台 苏州净化设备有限公司;恒低温气浴摇床(THZ-C-1) 上海丰盟科技材料有限公司;高压灭菌锅(MLS-3750) 日本三洋公司;手持糖度计(LB32T) 广州市铭睿电子科技有限公司。
1.2 方法
1.2.1 菌种活化
灵芝活化:将保存的灵芝菌菌种用接种针接入斜面培养基上,于28℃恒温培养7d。
酵母活化:10%的酿酒活性干酵母加到灭菌的5%蔗糖溶液中,混合均匀,首先在38~40℃中活化15~20min,然后在28~34℃活化1~2h即可使用。
1.2.2 灵芝菌液态培养
将活化的灵芝菌用接种针从斜面接入豆渣液体培养基中,于2 8℃进行摇床培养,制备液体种子。
1.2.3 液体培养基对照试验
以PDA培养基为对照,再以豆渣为基料配制培养基,将培养好的灵芝菌丝体液体种子摇匀,分别接种到上述培养基中,接种量为10%,于28℃恒温摇床培养5d,测定菌丝干质量,确定适合灵芝生长的培养基类型。
1.2.4 菌丝体干质量的测定
用移液管吸取10mL菌液,经4000r/min离心15min去除上清液,菌丝体用去离子水洗涤3次后离心10min,置于60℃烘箱内烘干24h。
1.2.5 酒精度的测定
采用蒸馏测定法[15]。
1.2.6 灵芝豆渣培养基配方的优化试验
在250mL三角瓶中装液量为100mL,接入10%灵芝菌丝体种子液,于28℃恒温摇床培养5d后测定菌丝干质量。因素水平设计如表1所示。
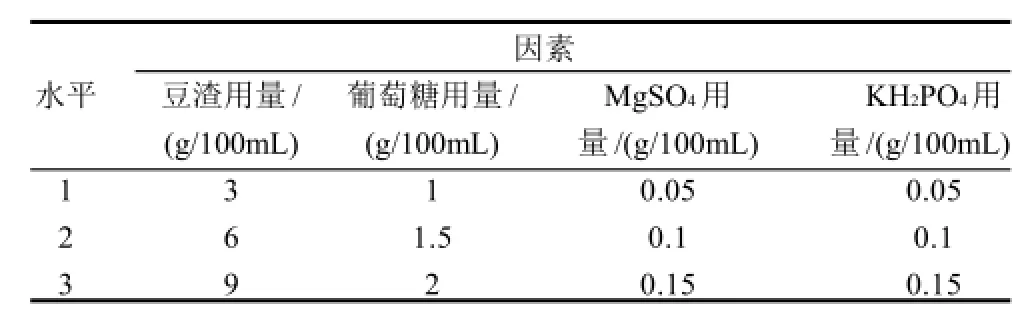
表1 培养基配方优化正交试验因素水平表Table1 Factors and levels in orthogonal array design for optimizing soybean residue medium for Gamoderma lucidum
1.2.7 酒精发酵条件优化试验
对以豆渣为基料灵芝液体培养的培养液进行过滤,除去菌丝体,向滤液中加入白砂糖,加入量用手持糖度计测定,使可溶性固形物含量达到12%,然后接入酵母进行酒精发酵,通过正交试验确定灵芝菌丝体培养液酒精发酵的适宜条件,试验因素水平如表2所示。
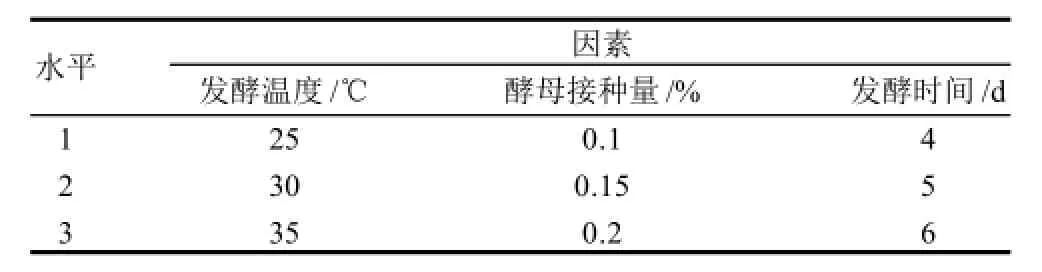
表2 酒精发酵条件正交试验因素水平表Table2 Factors and levels in orthogonal array design for optimizing alcoholic fermentation conditions of Gamoderma lucidum
1.2.8 灵芝发酵饮料感官评定方法
评定标准见表3。

表3 灵芝发酵饮料感官评定标准Table3 Sensory evaluation criteria for Gamoderma lucidum fermented beverage
2 结果与分析
2.1 以豆渣为基料的灵芝液体培养基的优化
2.1.1 PDA液体培养基与豆渣液体培养基的对比实验
对PDA液体培养基和豆渣液体培养基中灵芝菌丝体的生长情况以及对配制饮料的适宜性进行对比试验。结果如表4所示。
由表4可知,PDA培养基和豆渣培养基均能较好地促进灵芝菌丝体的生长。采用豆渣培养基时,灵芝菌丝体生长更为浓稠一些;通过感官评定,采用PDA培养基得到的培养液带有土豆的腥味,而豆渣培养基得到的培养液除了具有灵芝的风味外,还具有豆渣的清香味。所以,以豆渣为基料的培养基更适合灵芝的液态培养和用于饮料的配制。

表4 不同培养基灵芝菌丝体生长情况Table4 Growth status of Gamoderma lucidum mycelium in different media
2.1.2 灵芝豆渣培养基配方的优化
对豆渣培养基的配方通过正交试验优化,结果如表5所示。
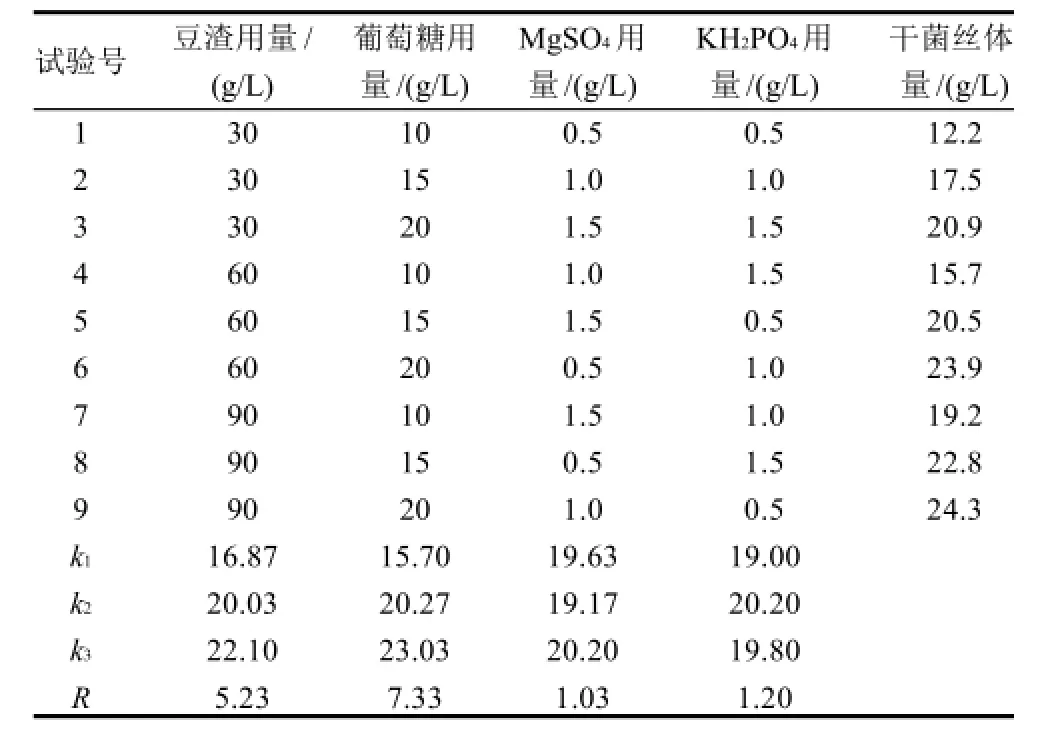
表5 灵芝豆渣培养基正交试验结果Table5 Results of orthogonal array design for optimizing soybean residue medium for Gamoderma lucidum
通过对表5的结果进行分析,可知豆渣90g/L、葡萄糖20g/L、MgSO41.5g/L、KH2PO41.0g/L的配方组合为最优培养基配方。各因素对结果影响大小顺序为葡萄糖>豆渣>KH2PO4>MgSO4。按优化的培养基配方进行验证实验,获得的干菌丝体量为24.8g/L。
2.2 灵芝液酒精发酵条件优化试验
采用正交试验优化灵芝液酒精发酵条件,结果如表6所示。
通过对表6中的结果进行分析,可知最优灵芝酒精发酵条件为发酵温度30℃、酵母接种量0.2%、发酵时间5d。各因素对结果影响大小顺序为酵母接种量>发酵时间>发酵温度。按优化的发酵条件进行验证实验,获得酒精体积分数为8.6%。
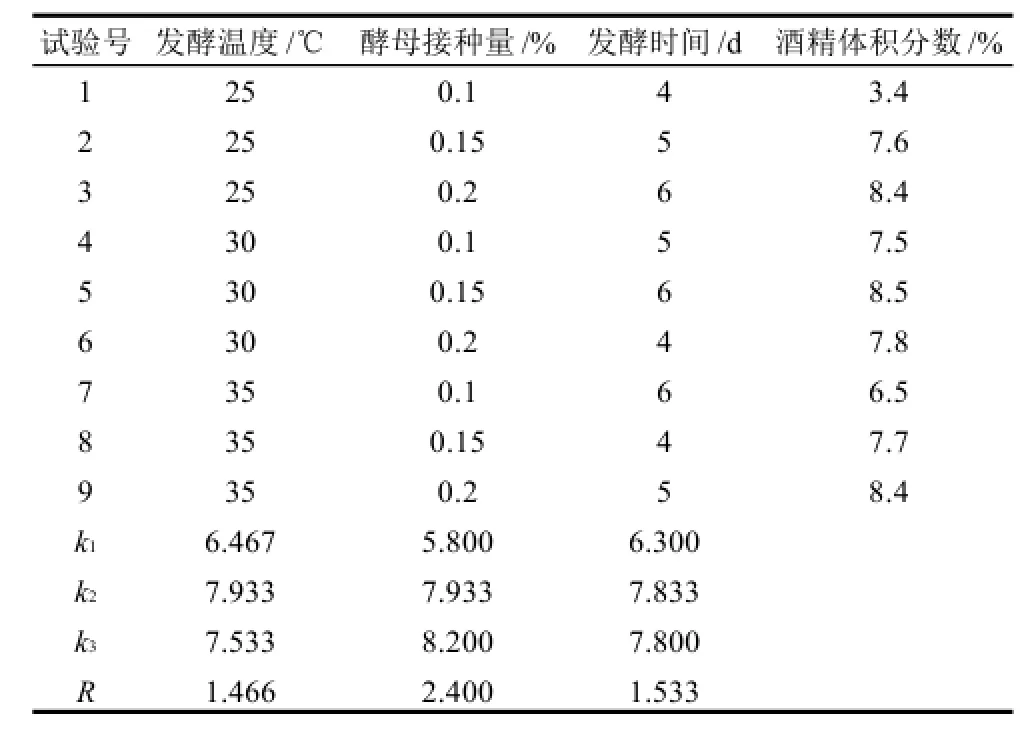
表6 灵芝酒精发酵条件正交试验结果Table6 Results of orthogonal array design for optimizing alcoholic fermentation conditions of Gamoderma lucidum
2.3 灵芝发酵饮料调配实验
将灵芝酒精发酵液进行离心,除去酵母菌等残渣得到灵芝酒精发酵原液。将灵芝酒精发酵原液稀释10倍,该稀释液酒精含量为0.86%。为使灵芝发酵饮料的口感适宜,向上述稀释液中加入柠檬酸和白砂糖调节酸度和甜度。经过感官评定,适宜的柠檬酸加量0.3%、白砂糖加量10%、稳定剂CMC-黄原胶(1:1)质量分数0.2%。调配获得的灵芝发酵饮料酸甜适中,具有酵母发酵的醇香味,回味时还有灵芝的淡淡苦味。该饮料营养丰富,风味独特。
3 讨 论
以豆渣为基料通过液体深层发酵的方法培养灵芝菌,通过培养基的优化和培养条件的控制,能使灵芝菌菌丝体呈蔓延性生长,形成黏稠的发酵液,而不是形成菌丝球。培养过程中发现,加入的豆渣颗粒逐渐变小,可能是灵芝菌分泌的分解木质素和纤维素等酶作用的结果,有关该酶学方面的研究将在下一步试验中进行。目前,虽然对灵芝饮料已有一些研究,但饮料苦味重、口感差,不适合作为产品直接饮用。本实验以豆渣为基料培养灵芝菌后,对灵芝培养液又通过接种酵母菌进行乙醇发酵,获得具有醇香味的灵芝发酵饮料,此方面的研究未见文献报道。通过液体发酵获得的灵芝原液还可以和果汁如猕猴桃汁和橙汁等进行调配,增加了饮料的适口性和营养性,从而获得新型功能性保健发酵饮料。
[1]张汇, 鄢嫣, 聂少平, 等. 黑灵芝不同部位多糖成分分析及抗氧化活性[J]. 食品科学, 2011, 32(1): 56-61.
[2]顾颖娟, 张磊, 刘亚伟, 等. 灵芝米糠发酵液制作保健饮料的工艺研究[J]. 食品科学, 2009, 30(4): 295-298.
[3]YANG H L, WU T X, ZHANG K C. Enhancement of mycelial growth and polysaccharide production in Ganoderma lucidum (the Chinese medicinalfungus, Lingzhi) by the addition of ethanal[J]. Biotechnology Leeters, 2004, 26(10): 841-844.
[4]XU Junwei, ZHAO Wei, ZHONG Jianjiang. Biotechnological production and application of ganoderic acids[J]. Appl Microbiol Biotechnol, 2010, 87(2): 457-466.
[5]BOH B, BEROVIC M, ZHANG J, et al. Ganoderma lucidum and its pharmaceutically active compounds[J]. Biotechnol Annu Rev, 2007(13): 265-301.
[6]陈志杰, 杨振东, 顾振新. 灵芝发芽糙米果液的工艺研究[J]. 食品科学, 2010, 31(6): 114-117.
[7]王谦, 卢婕, 杨丽. 发酵型灵芝醋饮料的工艺研究[J]. 食品科学, 2007, 28(5): 379-381.
[8]李云, 曾东方. 食用菌液体深层发酵的研究热点[J]. 食品工业科技, 2006, 27(7): 198-201.
[9]WAGNER R, MITCHELL D A, SASSAKI G L, et al. Current techniques for the cultivation of Ganoderma lucidum for the production of biomass, ganoderic acid and polysaccharides[J]. Food Technol Biotechnol, 2003, 41(4): 371-382.
[10]XU Peng, DING Zhongyang, QIAN Zhu, et al. Improved production of mycelial biomass and ganoderic acid by submerged culture of Ganoderma lucidum SB97 using complex media[J]. Enzyme Microb Technol, 2008, 42(4): 325-331.
[11]XU Junwei, XU Yining, ZHONG Jianjiang. Production of individual ganoderic acids and expression of biosynthetic genes in liquid static and shaking cultures of Ganoderma lucidum[J]. Appl Microbiol Biotechnol, 2010, 85(4): 941-948.
[12]王慧杰, 李宇伟, 连瑞丽, 等. 灵芝多糖液体发酵条件优化[J]. 食用菌学报, 2007, 14(1): 37-42.
[13]朱道红, 李春, 杨劲伟. 食用菌深层发酵工艺研究及功能性食品开发[J]. 生物技术, 2002, 12(6): 40-41.
[14]薛振环, 邓泽元, 范亚苇. Neurospora Crassa发酵对豆渣中膳食纤维的影响研究[J]. 食品工业科技, 2009, 30(3): 156-158.
[15]吴国峰, 李国全, 马永强, 等. 工业发酵分析[M]. 北京: 化学工业出版社, 2006: 56-57.
Preparation of Ganoderma lucidum Fermented Liquid Beverage Using Soybean Residue as Culture Medium
GANG Jie,LI Yan-yu,JIANG Sen
(College of Life Sciences, Dalian Nationalities University, Dalian 116600, China)
The liquid cultivation conditions of Ganoderma lucidum mycelium and alcoholic fermentation using soybean residue as the culture medium were studied in this paper and a kind of new functional and healthcare beverage was developed. The culture medium based on soybean residue was better than PDA liquid culture medium. The optimal culture medium formula was composed of 90 g/L soybean residue, 20 g/L glucose, 1.5 g/L MgSO4and 1.0 g/L KH2PO4. The optimal conditions for alcoholic fermentation were explored by orthogonal array design to be yeast inoculum concentration of 0.2%, fermentation temperature of 30 ℃, and fermentation time of 5 d. During the preparation of Gamoderma lucidum fermented beverage, the optimal formula was explored by orthogonal array design for the best comprehensive evaluation of color, flavor and taste.
Ganoderma lucidum;soybean residue;liquid cultivation;alcoholic fermentation;fermented beverage
TS275.4
B
1002-6630(2011)10-0308-04
2010-08-19
财政专项-中央高校基本科研业务费资助项目(DC10020106);大连民族学院太阳鸟项目(20090309)
冮洁(1965—),女,教授,博士,研究方向为食品生物技术。E-mail:gangjie@dlnu.edu.cn
