从萌发的油菜种子中制备脂肪酶
2011-03-30谭小力魏明玉袁伟伟
谭小力, 魏明玉, 袁伟伟
从萌发的油菜种子中制备脂肪酶
谭小力, 魏明玉, 袁伟伟
(江苏大学生命科学研究院,江苏 镇江 212013)
测定不同萌发期油菜幼苗的脂肪酶活性,采用“盐析→超滤→M-Bondapak-C18柱层析”的工艺路线,建立一种简单且高效的油菜脂肪酶纯化方法。结果表明:通过测定不同培养时间的油菜幼苗的脂肪酶比活力,发现培养6d的油菜幼苗脂肪酶比活力最高,此时期的油菜幼苗适合作为脂肪酶提取的材料;对脂肪酶比活力为1.89U/mg的油菜蛋白粗提物采用盐析法沉淀脂肪酶时,得到脂肪酶的比活力为2.07U/mg,回收率为82.47%;采用截留分子质量为10000D的超滤膜对脂肪酶盐析物进行脱盐和除去小分子杂蛋白处理,得到的脂肪酶的比活力为2.46U/mg,回收率为75.84%;进一步采用M-Bondapak-C18柱层析纯化超滤液,脂肪酶最高比活力为9.14U/mg,回收率为34.13%。所得到的脂肪酶的活性达到了商品化脂肪酶的水平。
油菜籽种子;脂肪酶;纯化;盐析;超滤;柱层析
脂肪酶(triacylglycerol acylhydrolase,EC 3.1.1.3,甘油三酰酯水解酶)是分解三脂酰甘油的水解酶类,在油水界面上,脂肪酶催化三酰基甘油的酯键水解,释放含有更少酯键的甘油酯或甘油及脂肪酸[1]。脂肪酶在生物柴油的制备[2]、油脂水解和精炼[3]、食品风味和香味的改进[4]、医药[5]、皮革绢纺脱脂[6]、洗涤剂[7]和化妆品[8]等行业中都具有广泛的用途。
脂肪酶广泛存在于动植物和微生物中[9-10]。早在1834年就有了对兔胰脂肪酶活性的报道,到20世纪初国外研究人员首次发现了微生物脂肪酶。微生物脂肪酶资源丰富,作用pH值及温度范围广,在研究应用方面进展很快[9]。早在1967年,中国科学院微生物研究所筛选到一株解枝假丝酵母(Candida lipolytica)AS2.1203,并于1969年制成酶制剂投放市场[11]。动植物体内虽存在脂肪酶,但是由于原材料生长周期长、提取也较困难等因素,所以发展比微生物脂肪酶慢的多[9]。植物中含脂肪酶较多的是油料作物的种子,如油菜籽[12]。当油菜种子萌发时,脂肪酶能与其他的酶协同发挥作用催化分解种子中的油脂,生成糖类以提供种子生根发芽所必需的物质和能量[13]。
近十多年来,由于化石能源的储量越来越少,同时产生大量的二氧化碳,生物能源作为可持续发展的再生能源受到日益重视,油脂由于单位分子所存储的能量多,是生物能源的很好的形式,一般直接酯化,生成生物柴油[14]。目前大量采用的是化学法生产生物柴油,但化学法生产过程需高温高压,生产过程耗费大量能源,同时产生废酸废碱,污染环境,由于生产生物柴油用的是脂肪酶催化法,生产条件温和,生产过程没有污染,被认为是最有前途的方法[15],但由于脂肪酶生产成本高、催化效率低等问题,制约着脂肪酶催化法应用于生物柴油的生产[16]。目前生产生物柴油所用的原料大部分来自植物油,因此,从油料作物油菜中分离到的脂肪酶制备生物柴油应具有专一性强、催化效率高的特点。
迄今为止,国内还未见对油菜脂肪酶提取纯化的方法。参考从微生物中提取纯化脂肪酶的方法[17-18],本实验首先测定不同培养时间的油菜幼苗中脂肪酶的比活力,然后从比活力最高时期的油菜幼苗中提取脂肪酶,采用盐析→超滤→M-Bondapak-C18柱层析的方法,得到纯度较高的脂肪酶。通过本实验所制备的脂肪酶,研究来源于油料作物种子萌发期的脂肪酶催化生成生物柴油的专一性和高效性,为下一步在油菜种子萌发期克隆脂肪酶基因,然后转化到工程菌中,大规模生产油菜脂肪酶打下基础。
1 材料与方法
1.1 材料与试剂
宁油12号油菜种子由江苏省农业科学院提供。在培养箱里培养宁油12号油菜种子,种子吸涨完全时第一次取样,以后每隔1d取一次样,共10次,样品保存于-70℃冰箱。
曲拉通X-100 美国Amresco公司;对硝基苯基月桂酸酯 美国Sigma-Aldrich公司;牛血清蛋白(BSA) 北京拜尔迪公司;异丙醇、磷酸氢二钠、磷酸二氢钠为分析纯;氨水为化学纯。
1.2 仪器与设备
冷冻离心机 日本Hitachi公司;6305 型紫外-可见光分光光度计 英国Jenway公司;601 型超级恒温水浴锅、HJ-3 控温磁力搅拌机、XH-C 漩涡混合器 江苏省金坛市医疗仪器厂;层析柱(2.0cm×50cm) 、BT-100E恒流泵、HD-21-88 紫外检测仪 上海琪特分析仪器有限公司;超滤管 美国Millipore公司;DBS-100 电脑自动部分收集器 上海沪西分析仪器厂;N2000 双通道色谱工作站 浙江大学智达信息工程有限公司。
1.3 方法
1.3.1 粗酶液的制备
取-70℃冰箱保存的样品,在液氮中充分研磨至面粉状,得到的粉末以3:10(m/V)的比例与蛋白提取液(0.025mol/L,pH7.0的Tris-磷酸钠缓冲液)混合,每毫升混合液中加入0.2mol/L二硫苏糖醇(DTT)10μL,0.2mol/L EDTA 2μL,1mmol/L蛋白酶抑制剂苯甲基磺酰氟(PMSF) 1μL,振荡均匀后于4℃、12000r/min离心20min,上清液即为粗酶液。
1.3.2 脂肪酶比活力的测定
反应体系中含有50mmol/L的Tris-磷酸钠缓冲液,100μmol/L的对硝基苯酚月桂酸酯底物溶液和酶溶液(0~2.5mg/mL)。底物溶于10mL异丙醇中,缓缓加入100mL 50mmol/L,pH7.0的曲拉通 X-100磷酸钠缓冲液配成反应液。每900μL反应液加入100μL粗酶液,37℃保温15min后,于4℃、12000r/min离心30s终止反应。在实验条件下,每分钟生成1μmoL对硝基苯酚为一个酶活力单位,对硝基苯酚浓度的测定采用分光光度法[19]。酶比活力用1mg蛋白质中脂肪酶的活力单位数表示。将脂肪酶的纯化倍数定义为处理液中脂肪酶的比活力与粗提液中脂肪酶的比活力的比值。
1.3.3 总蛋白质含量的测定
采用考马斯亮蓝比色法进行测定,以BSA为标准蛋白[20]。
1.3.4 脂肪酶回收率的测定
将脂肪酶的回收率定义为处理液中脂肪酶的酶活力与粗提液中脂肪酶的酶活力的比值。脂肪酶的回收率按下式计算。
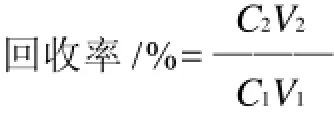
式中:C1为粗提液中脂肪酶的酶活力/(U/mL);V1为粗提液的总体积/mL;C2为脂肪酶纯化得到的处理液中脂肪酶的酶活力/(U/mL);V2为脂肪酶纯化得到的处理液的总体积/mL。
1.3.5 脂肪酶的纯化
1.3.5.1 盐析
将提取的粗酶液边搅拌边向其中加入固体硫酸铵,使其中的硫酸铵质量浓度分别达到100、200、300、400、500、600、700、800g/L,摇匀后静置30min,然后于4℃、4000r/min离心10min,弃去上清液,将蛋白质沉淀用蒸馏水溶解得到盐析液。
1.3.5.2 超滤
用超滤的方法对脂肪酶盐析物进一步进行脱盐、除杂蛋白和浓缩处理,采用截留分子质量为10000D的超滤管。取上一步得到的盐析液放入超滤管中,于4℃、4000r/min离心8min,离心后在超滤管内补满蒸馏水再离心,重复3次。用BaCl2溶液检测透过液中无白色沉淀时即为超滤终点。然后把超滤管倒置在离心机中,于4℃、4000r/min离心20min,再向管中加1mL的蒸馏水振荡溶解超滤产物。
1.3.5.3 M-Bondapak-C18离子交换层析
M-Bondapak-C18按产品说明书要求进行处理。装柱(2.0cm×50cm柱)后,用蒸馏水平衡。将上一步得到的超滤液用蒸馏水稀释3倍后于12000r/min离心10min上柱,先后用氨水和含lmol/L NaCl的0.05mol/L磷酸钠缓冲液洗脱(缓冲液pH8),流速为5mL/min,洗脱液体积为400mL;收集活性峰,透析,冷冻干燥备用。
2 结果与分析
2.1 油菜种子萌发期脂肪酶比活力的变化
为了确定萌发期提取脂肪酶的最佳时间,本实验研究了油菜脂肪酶在萌发期的动态变化。如图1 所示,宁油12号油菜种子萌发的前3d,脂肪酶比活力很小,随着油菜芽的不断生长,其脂肪酶比活力不断增大;当萌发6d时,脂肪酶比活力达到最高;萌发6d后,脂肪酶比活力不断降低。由此可见,油菜萌发后脂肪酶比活力最高的时期是培养6d的油菜苗。此时期的油菜苗可用来作为脂肪酶提取纯化的材料。
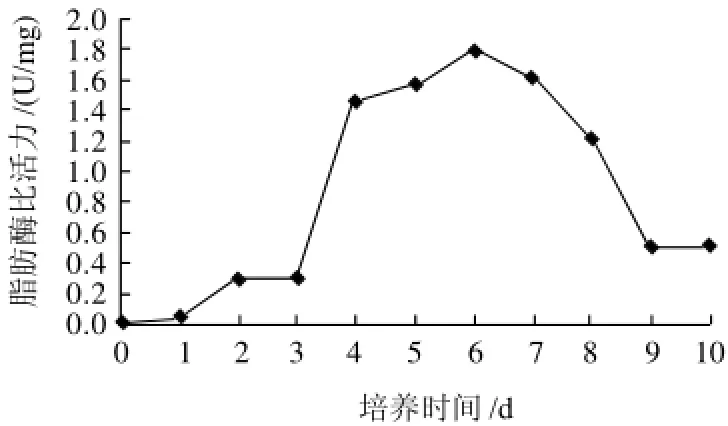
图1 油菜种子萌发期脂肪酶比活力的变化Fig.1 Dynamic change of lipase activity in rapeseed during germination
2.2 盐析过程中硫酸铵质量浓度对脂肪酶回收率和纯化倍数的影响

图2 硫酸铵质量浓度对脂肪酶回收率的影响Fig.2 Effect of concentration of ammonium sulphate on the recovery rate of lipases

图3 硫酸铵质量浓度对脂肪酶纯化倍数的影响Fig.3 Effect of concentration of ammonium sulphate on the purity of lipases
如图2、3 所示,硫酸铵质量浓度为400g/L时,脂肪酶的回收率达到了很高。当硫酸铵质量浓度超过600g/L时,由于溶液密度较大,脂肪酶沉淀物悬浮于上清液的表面,不容易被分离。当硫酸铵质量浓度为100g/L时,只出现少量的蛋白沉淀。当硫酸铵质量浓度为200g/L时,有比较明显的蛋白质沉淀,此时脂肪酶的纯化倍数最大。当硫酸铵质量浓度继续增加,纯化倍数降低很多。综合考虑,先用质量浓度为100g/L的硫酸铵盐析,除去杂蛋白,然后采用质量浓度为400g/L的硫酸铵进行盐析。采用这种方法对脂肪酶进行初步纯化,脂肪酶的比活力为2.07U/mg,回收率为82.47%,纯化倍数达到1.12倍。
2.3 超滤对脂肪酶回收率和纯化倍数的影响
超滤能除去脂肪酶提取液中的一些杂蛋白,提高脂肪酶溶液的纯度。采用截留分子质量为10000D的超滤膜纯化脂肪酶,实验结果显示,脂肪酶的比活力为2.46U/mg,回收率为75.84%,纯化倍数为1.19倍。
2.4 M-Bondapak-C18离子交换层析不同洗脱液对脂肪酶回收率和纯化倍数的影响

图4 M-Bondapak-C18离子交换层析洗脱曲线Fig.4 Elution curve of M-Bondapak-C18ion exchange chromatography
为了进一步纯化所提取的脂肪酶,利用离子交换层析法进行分离纯化。由图4可见,分离得到2个活性峰,分别为氨水和含lmo/L NaCl的0.05mol/L磷酸钠缓冲液(pH8)洗脱得到的洗脱峰。最后得到的脂肪酶分离纯化的结果如表1所示。发现层析峰2的纯化效果远远高于层析峰1。层析峰2的脂肪酶最后回收率达到了34.13%,纯化倍数约为5倍。

表1 M-Bondapak-C18离子交换层析对回收率和纯化倍数的影响Table 1 Effect of M-Bondapak-C18ion exchange chromatography on the recovery rate and purity of lipases
3 结 论
油菜籽萌发后第6天是脂肪酶活性最高的时期,此时的油菜芽是脂肪酶提取并分离纯化的最佳时期。通过盐析法沉淀、超滤膜浓缩、离子交换柱层析等手段对油菜芽中的脂肪酶纯化,最终得到的脂肪酶比活力为9.14U/mg,总回收率为43.94%。
[1]REIS P, HOLMBERG K, WATZKE H, et al. Lipases at interfaces: a review[J]. Advances in Colloid and Interface Science, 2009, 147/148: 237-250.
[2]MEHER L C, SAGAR D V, NAIK S N. Technical aspects of biodiesel production by transesterification: a review[J]. Renewable and Sustainable Energy Reviews, 2006, 10(3): 248-268.
[3]吴秋明, 叶兴乾, 吴丹, 等. 脂肪酶在食品工业中的应用[J]. 粮油加工与食品机械, 2004(11): 72-73.
[4]纵伟, 董海丽. 脂肪酶及其在食品工业中的应用[J]. 安徽农学通报, 2007, 13(15): 14-15.
[5]AL-BAHRANI A Z, AMMORI B J. Clinical laboratory assessment of acute pancreatitis[J]. Clinica Chimica Acta, 2005, 362(1/2): 26-48.
[6]陈雄金. 脂肪酶的研究及其应用[J]. 科技信息, 2008(19): 58; 34.
[7]郑毅, 吴松刚, 施巧琴. 洗涤剂用酶: 碱性脂肪酶的研究概述[J]. 日用化学工业, 2001, 31(1): 35-38.
[8]SARNEY D B, FREGAPANE G, VULFSON E N. Lipase-catalyzed synthesis of lysophospholipids in a continuous bioreactor[J]. Journal of the American Oil Chemistociety, 2007, 71(1): 93-96.
[9]高贵, 韩四平, 王智, 等. 国内脂肪酶研究状况分析[J]. 生物技术通讯, 2003, 14(6): 543-545.
[10]SHARMA R, CHISTI Y, BANERJEE U C. Production, purification, characterization and applications of lipases[J]. Biotechnology Advances, 2001, 19(8): 627-662.
[11]孙宏丹, 孟秀香, 贾莉, 等. 微生物脂肪酶及其相关研究进展[J]. 大连医科大学学报, 2001, 23(4): 292-295.
[12]谷利伟, 赵金兰. 酶技术在油脂工业中的应用[J]. 中国油脂, 1998, 23(5): 43-45.
[13]EASTMOND P J. SUGAR-DEPENDENT1 encodes a patatin domain triacylglycerol lipase that initiates storage oil breakdown in germinating Arabidopsis seeds[J]. The Plant Cell, 2006, 18: 665-675.
[14]DEMIRBAS A. Progress and recent trends in biofuels[J]. Progress in Energy and Combustion Science, 2007, 33(1): 1-18.
[15]RANGANATHAN S V, NARASIMHAN S L, MUTHUKUMAR K. An overview of enzymatic production of biodiesel[J]. Bioresource Technology, 2008, 99(10): 3975-3981.
[16]GUPTA R, GUPTA N, RATHI P. Bacterial lipases: an overview of production, purification and biochemical properties[J]. Applied Microbiology and Biotechnology, 2004, 64(6): 763-781.
[17]舒正玉, 杨江科, 闫云君. 黑曲霉F044 脂肪酶的分离纯化及酶学性质研究[J]. 生物工程学报, 2007, 23(1): 96-100.
[18]胡泊, 吴胜, 杨柳, 等. 嗜冷枯草芽孢杆菌低温脂肪酶纯化与酶学性质研究[J]. 微生物通报, 2007, 34(3): 524-527.
[19]RUIZ C, FALCOCCHIO S, XOXI E, et al. Activation and inhibition of Candida rugosa and Bacillus-related lipases by saturated fatty acids, evaluated by a new colorimetric microassay[J]. Biochimica et Biophysica Acta, 2004, 1672(3,11): 184-191.
[20]许淑芳, 朱江, 刘邻渭, 等. 考马斯亮兰G-250法测定苹果浓缩汁生产中的蛋白含量[J]. 饮料工业, 2005, 8(1): 45-48.
Preparation of Lipase from Germinated Rapeseed
TAN Xiao-li,WEI Ming-yu,YUAN Wei-wei
(Institute of Life Sciences, Jiangsu University, Zhenjiang 212013, China)
The lipases in the germinating seeds of oil crop have high specificity and efficiency to the substrate plant oil, the main sources in biodiesel production. The lipase activity during the different stages of rapeseed germination was determined, and accordingly, lipase was purified by salting out, ultrafiltration, and M-Bondapak-C18column chromatography sequentially. The results showed that: 1) During the different stages of germinating seeds, the lipase activity in 6-day-old seedling was at the peak. Therefore, 6-day-old seedlings were chosen as the material for lipase extraction; 2) After salting-out, the specific activity of lipase was improved from 1.89 U/mg to 2.07 U/mg, with a recovery rate of 82.47%; 3) After ultra filtration with 10000 D membrane, the specific activity of lipase was improved to 2.46 U/mg, and the recovery rate was 75.84%; 4) The specific activity of further purified lipase by C18column chromatography was improved to 9.14 U/mg, with the recovery rate being 34.13%. The activity of final lipase prepared reached the level of commercial lipase.
rapeseed;lipase;purification;salting out;ultrafiltration;column chromatography
Q814.1
A
1002-6630(2011)03-0148-04
2010-04-12
国家“973”计划项目(2006CB101600)
谭小力(1968—),男,副研究员,博士,研究方向为植物油脂代谢。E-mail:xltan@ujs.edu.cn
