马铃薯蛋白组分的分离提取和功能性质研究
2011-03-30崔竹梅黄海珊秦欢欢朴金苗
崔竹梅,黄海珊,秦欢欢,朴金苗,齐 斌
马铃薯蛋白组分的分离提取和功能性质研究
崔竹梅,黄海珊,秦欢欢,朴金苗,齐 斌*
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
采用透析与等电点沉淀相结合的工艺方法提取分离马铃薯块茎蛋白组分;并对其理化性质和功能性质进行检测。结果显示:此提取工艺流程合理易行,马铃薯块茎酸性蛋白组分和碱性蛋白组分的得率分别为0.535%、0.741%;纯度分别为92.5%、89.2%;酸性蛋白组分沉降系数5S,分子质量82kD;碱性性蛋白组分沉降系数8S,分子质量140kD。SDS-PAGE电泳图谱表明5S蛋白组分有1条亚基带;8S蛋白组分有4条亚基带。5S蛋白组分的表面疏水性、吸油能力、乳化性显著高于8S蛋白组分;而8S蛋白组分的总巯基含量以及起泡性高于5S蛋白组分。马铃薯蛋白组分可以作为功能食品的蛋白添加原料。
马铃薯蛋白;提取分离;功能性质
植物性蛋白对于人类营养具有重要意义。马铃薯资源丰富,我国年产量约6000万t,居世界前列,但加工量只占总产量的10%左右。目前对马铃薯的研究主要集中在糖蛋白patatin、蛋白酶抑制剂和低分子质量抗菌肽等的生理作用[1-4]。而马铃薯蛋白多被作为淀粉生产过程中的废料成分,食品利用较少。马铃薯贮藏蛋白主要分为酸性组分和碱性组分,前者主要成分为糖蛋白patatin,后者主要成分是20~24kD 蛋白酶抑制剂和多肽。
关于马铃薯浓缩蛋白和分离蛋白的制备[5-8]、纯化[9-11]及功能性质[12-13]研究较多,而对酸性蛋白组分和碱性蛋白组分的分离提取研究较少。Ralet等[14]采用离子交换层析法获得了酸性和碱性蛋白组分,并对它们的溶解性、热稳定性和乳化性等部分性质做了研究。此法制备的马铃薯蛋白组分的纯度较高,但成本高、得率低,不适用于规模生产。
马铃薯蛋白营养均衡,是极具潜力的食品蛋白来源。目前国内外未见马铃薯酸性蛋白组分和碱性蛋白组分同时分离提取的工艺流程以及沉降系数、表面疏水性等性质的研究报道。因此本实验对此进行研究,以期可提高马铃薯的产品附加值和综合利用率,解决马铃薯加工厂淀粉废液直接排放的污染问题,同时为马铃薯蛋白的深入研究及产品开发参考。
1 材料与方法
1.1 材料与试剂
新鲜马铃薯 市售。
三(羟甲基)氨基甲烷(T r i s)、十二烷基硫酸钠(SDS)、丙烯酰胺(Acr)、亚硫酸氢钠(SBS)、过硫酸氨(AP)、四甲基乙二氨(TEMED)、1-苯胺基-8-萘磺酸(ANS)、苯甲基磺酰氟(PMSF) 美国Sigma公司;其他所用试剂均为分析纯。
1.2 仪器与设备
Delta 320型精密pH计 瑞士Mettler Toledo公司;AOLPHA 1-2LD Plus型冷冻干燥机 德国Christ公司;电泳仪、MilliQ超纯水装置 美国Bio-Rad公司;Prote.o.meLab XL-Ⅰ分析型超速离心机 美国Beckman公司;AKTA primplus液相色谱系统液相系统 GEAmersham公司;RF - 5301PC荧光分光光度计 日本岛津公司。
1.3 方法
1.3.1 马铃薯块茎总蛋白的提取
总蛋白的提取参照文献[12]并做修改。
新鲜马铃薯切成片,加少量0.5g/100mL的Na2SO3溶液打成匀浆,滤去薯渣后6000r/min离心10min。调节上清液至pH4.0,离心取沉淀。将沉淀调节至pH7.0,冻干得粗蛋白粉。
1.3.2 马铃薯蛋白组分的分离工艺流程
将马铃薯粗蛋白粉用10g/100mL NaCl溶液溶解,8000r/min离心20min。取上清液透析36h,4 ℃、5000r/min离心20min,所得沉淀冻干得马铃薯碱性蛋白组分。再调节离心所得上清液至pH4.0,4℃、8000r/min离心20min,所得沉淀为马铃薯酸性蛋白,调节至pH7.0,冻干备用。具体操作流程见图1。
1.3.3 马铃薯蛋白组分理化性质
1.3.3.1 蛋白得率和纯度的测定
蛋白质浓度测定:采用Brandford法;总蛋白质含量:采用微量凯氏定氮法(N×6.25)。

微量凯氏定氮法测定总蛋白的纯度;SDS-PAGE电泳测定各蛋白组分的纯度,SDS-PAGE采用不连续垂直板状凝胶电泳,凝胶厚度1mm,浓缩胶5%,分离胶12%,凝胶分析用Bio-Rad公司的Quatity-One软件。
1.3.3.2 蛋..白纯化和沉降系数的测定
采用AKTA primplus液相色谱系统进行蛋白纯化(装seperdex75 10/300GL柱)。1mL样液上样,洗脱液的Tris-HCl(0.1mol/L,pH 7.5),洗脱流速0.8mL/min。测沉降系数的测定,参见Wolf法[15]。
1.3.4 马铃薯蛋白组分食品功能性质
1.3.4.1 表面疏水性的测定
表面疏水性测定,采用荧光探针ANS法[16],略有改动。用0.01mol/L pH 7.0缓冲液配制不同质量浓度的蛋白质溶液(0.1、0.2、0.3、0.4、0.5mg/mL)和8.0mmol/L的1-苯胺基-8-萘磺酸(ANS)溶液。检测前取20μL ANS溶液加到4mL蛋白质溶液中,混合均匀,迅速测定混合液的荧光强度。激发波长为390nm,发射波长为470nm。以蛋白质浓度为横坐标,荧光强度为纵坐标作图,曲线的斜率即为蛋白质分子的表面疏水性指数。
1.3.4.2 巯基含量测定
参照Kachanechaia等[17]的方法测定巯基含量。取蛋白样品60mg溶于10mL Tris-Gly缓冲液(含0.004mol/L EDTA、8mol/L尿素,pH8.0),10000r/min离心10min,取上清液测游离巯基(—SHF)和总巯基(—SHT)含量。
1.3.4.3 吸油性的测定
取0.5g蛋白样品于刻度10mL离心管中,加入5mL色拉油,混匀1min,在室温下静置30min,然后3000r/min离心30min,测量其上清液体积,用5mL减去上清液体积即为样品吸油量。
1.3.4.4 起泡性的测定
0.5 g样品溶解到100mL 蒸馏水中,调节至pH7.0,然后在10000r/min 的组织捣碎匀浆机中均质2min,记录均质停止时泡沫的体积。
1.3.4.5 乳化性的测定
用0.2mol/L磷酸缓冲液(pH 7.0)配制0.1g/100mL的蛋白液,取45mL蛋白液与15mL大豆油于高速组织捣碎机中均质(10000r/min)1min,制成白色乳状液。立即从乳液底部吸取0.5mL乳浊液,加25mL SDS(0.1g/100mL),充分混匀后在500nm波长处测其吸光度A500nm,即得:乳化活性(EAI)=A500nm×100。
2 结果与分析
2.1 马铃薯块茎蛋白的提取
经凯氏定氮分析,实验所用马铃薯块茎蛋白含量为1.97%(以鲜质量计)。采用Na2SO3水溶液浸提法的蛋白得率低于FeCl3沉淀法[7],但水提法简单无毒,适用于食品生产。
马铃薯蛋白酸性组分在pH4时溶解性较小,而碱性蛋白组分的在整个pH值范围内溶解度都较高,所以不能用碱溶酸沉法分离马铃薯酸性、碱性蛋白组分。但两者在盐溶液中的溶解性有所不同,碱性蛋白组分在纯水中的溶解性明显低于盐溶液,可通过稀释蛋白盐溶液或透析法使碱性蛋白组分析出。采用透析和等电点沉淀相结合的工艺流程制备马铃薯酸性和碱性蛋白组分,获得了较理想的得率,酸性蛋白为0.535%,碱性蛋白为0.741%(表1)。
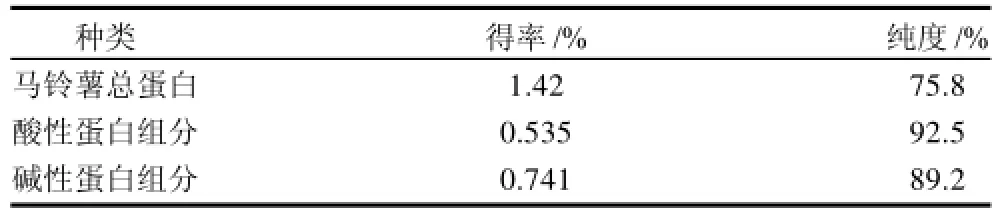
表1 马铃薯蛋白的得率和纯度Table 1 Yield and purity of potato tuber protein fractions
如用马铃薯粗蛋白粉为对照,则酸性蛋白的得率为37.7%,碱性蛋白为52.2%。酸性蛋白蛋白得率低,但纯度较高,达到92.5%;而碱性蛋白的纯度略低,为89.2%。同时本工艺流程简单可行,无外来污染物的引入,在工业生产中可以用超滤技术取代透析过程,提高生产效率。
2.2 马铃薯蛋白组分沉降系数的测定

图2 马铃薯酸性蛋白沉降系数Fig.2 Sedimentation coefficient of the acid protein fraction from potato tuber

图3 马铃薯碱性蛋白沉降系数Fig.3 Sedimentation coefficient of the alkaline protein fraction from potato tube
马铃薯块茎蛋白酸性组分和碱性组分的沉降系数和分子质量的研究未见报道。蛋白组分经脱盐纯化后进行超速离心,由图2可知,酸性蛋白组分的沉降系数为5S,碱性蛋白组分沉降系数为8S;它们的分子质量分别为82、140kD。
2.3 马铃薯蛋白组分的SDS-PAGE电泳图谱
SDS - PAGE已广泛应用于蛋白质分析测定,要获得较好的SDS - PAGE 电泳分辨率,电泳条带应分布在胶的中央,且条带分布清晰。预实验研究发现采用5%的浓缩胶,12%的分离胶浓度进行马铃薯蛋白SDSPAGE电泳效果最佳。
图4为马铃薯总蛋白的电泳图谱,从图谱上可以看出马铃薯蛋白条带分布均匀,出现13条分布清晰的亚基条带,比Partsia等[5]研究认为的5条亚基带要多。马铃薯块茎蛋白电泳图谱可分成两个集中区域,上方区域中有分子质量为60、41kD 的两条主带;下方区域中出现4个主带,分子质量分别为16、22、23、25kD。马铃薯酸性蛋白主要为41kD蛋白(图5),即糖蛋白patatin。patatin 为二聚体蛋白,其总分子质量约为82kD,与2.2节中超速离心分析所得结果一致。碱性蛋白组分主要是16~25kD 的蛋白酶抑制剂和多肽。

图4 马铃薯总蛋白的SDS-PAGE图谱Fig.4 SDS-PAGE patterns of potato total protein

图5 马铃薯酸性蛋白、碱性蛋白的SDS-PAGE图谱Fig.5 SDS-PAGE patterns of the acid and alkaline protein fraction of potato tuber
2.4 马铃薯块茎酸性蛋白和碱性蛋白理化性质研究
疏水相互作用对蛋白质的稳定性、构象和功能具有重要意义,是维持蛋白质三级结构最重要的作用力。荧光探针ANS法是一种经典的评价蛋白质表面疏水性的方法。蛋白质的疏水性,与其表观作用如表面张力、乳化性能等具有很好的相关性。二硫键是天然存在于蛋白质中唯一的侧链交联共价键,在单体蛋白质中,二硫键的形成是蛋白质折叠的结果,二硫键含量的多少会影响蛋白质的热稳定性和凝胶性。蛋白质表面疏水性以及游离巯基含量的变化,直接影响其溶解性、起泡性和乳化性等功能特性。

表2 5S和8S蛋白组分的表面疏水性和巯基含量Table 2 Surface hydrophobicity and sulfhydryl content of isolated 5S and 8S fractions of potato storage proteins
Ellman’s试剂检测3种蛋白质,由表2可知,8S蛋白中的巯基总含量和二硫键显著高于5S蛋白;同时8S组分的表面疏水性比5S 的要小得多,这可能与其含有更多的二硫键有关,二硫键使蛋白质肽链的空间结构更为紧密,把蛋白质的疏水端包裹在分子内部。其他导致8S 组分表面疏水性较小的原因将在后续实验中继续研究。
由表3可知,马铃薯蛋白具有良好的食品功能性质,与大豆分离蛋白相关指标[18]接近,比报道的甘薯蛋白的指标[19]略低。马铃薯5S组分具有良好的吸油能力、乳化性,可考虑应用于脂肪含量较高的食品如肉制品、乳制品等。马铃薯蛋白5S组分的起泡性却显著低于8S蛋白组分,8S 组分的起泡性达到了1.85mL/g。蛋白质的乳化性质与其表面疏水性存在弱的正相关[20],同时蛋白质的高溶解度也是良好的起泡能力的先决条件。

表3 5S和8S蛋白组分的功能性质Table 3 Functional characterizations of the isolated 5S and 8S fractions of potato proteins
3 结 论
马铃薯蛋白营养均衡,其贮藏蛋白组分可分成酸性蛋白组分和碱性蛋白组分,研究其蛋白提取工艺和功能性质有其实际意义。本实验得出以下结论:
通过透析和等电点沉淀法结合的工艺流程来分离提取马铃薯块茎酸性和碱性蛋白组分,得率达到了0.535%、0.741%,纯度达到了92.5%、89.2%。 可进一步优化工艺流程,提高各蛋白组分的得率。
马铃薯蛋白酸性和碱性组分的沉降系数分别为5S、8S,分子质量分别为82、140kD。SDS-PAGE 图谱显示5S蛋白组分有1条亚基带,分子质量41kD;8S蛋白组分有4条主带,分子质量16~25kD。
5S蛋白组分的表面疏水性、吸油性、乳化性高于8S蛋白;而8S 蛋白组分的性巯基含量、起泡性明显高于5S蛋白组分。可根据它们的功能特点,在食品中进行添加应用的研究。
[1]PARK Y, CHOI B H, KWAK J S, et al. Kunitz-Type Serine protease inhibitor from potato (Solanum tuberosum L. cv. Jopung) [J]. Journal of Agricultrual and Food Chemistry, 2005, 53(16): 6491-6496.
[2]LITTLE T J, HOROWITZ M, FEINLE-BISSET C. Role of cholecystokinin in appetite control and body weight regulation[J]. Obesity Reviews, 2005, 6(4): 297-306.
[3]DANA S, LEWIS B. Efficacy of SlendestaTMpotato protein Extract: USA, KHBB-017-047[P]. 2007-03 -05..
[4]KIM M H, PARK S C, KIM J Y, et al. Purification and characterization of a,,table serine,,ase inhibitor from the tubers of new potato variety Golden Valley [J]. Biochemical and Biophysical Research Communications, 2006, 346(3): 681-686.
[5]PARTSIA Z, KIOSSEOGLOU V. Foaming properties of potato proteins recovered by complexation with carboxymethylcellulose[J]. Colloids and Surfaces B: Biointerfaces, 2001, 21: 69-74.
[6]VIKELOUDA M, KIOSSEOGLOU V. The use of carboxymethylcellulose to recover potato proteins and control their functional properties[J]. Food Hydrocolloids, 2004, 18(1): 21-27.
[7]BARTOVA V, BARTA J. Chemical composition and nutritional value of protein concentrates isolated from potato (Solanum tuberosum L.) fruit juice by precipitation with ethanol or ferric chloride[J]. Journal of Agricultural and Food Chemistry, 2009, 57(19): 9028-9034.
[8]LOKRA S, HELLAND M H, CLAUSSEN I C, et al. Chemical characterization and functional properties of a potato protein concentrate prepared by large-scale expanded bed adsorption chromatography[J]. LWT-Food Science and Technology, 2008, 41 (6): 1089-1099.
[9]RALET M C, GUEGUEN J. Fractionation of potato proteins: solubility, thermal coagulation and emulsifying properties[J]. LWT-Food Science and Technology, 2000, 33(5): 380-387.
[10]SUH S G, PETERSON J E, STIEKEMA W J, et al. Purification and characterization of the 22-kilodalton potato tuber proteins[J]. Plant Physiol, 1990, 94(1): 40-45.
[11]RACUSEN D, FOOTE M. A major soluble glycoprotein of potato tubers[J]. Journal of Food Biochemistry, 1980, 4(1): 43-52.
[12]朴金苗, 都凤华, 齐斌. 马铃薯分离蛋白凝胶的制备及其性质研究[J]. 食品科学, 2009, 30(22): 108-111.
[13]朴金苗, 都凤华, 齐斌. 马铃薯分离蛋白的溶解性和乳化性研究[J].食品科学, 2009, 30(17): 91-94.
[14]RALET M C, GUEGUEN J. Fractionation of potato proteins: solubility, thermal coagulation and emulsifying properties[J]. LWT-Food Science and Technology, 2000, 33(5): 380-387.
[15]WOLF W J, BRIGGS D R. Ultracentrifugal investigation of the effect of neutral salts on the extraction of soybean proteins[J]. Archives of Biochemistry and Biophysics, 1956, 63(1): 40-49.
[16]URUAKPA F O, ARNTFIELD S D. Surface hydrophobicity of commercial canola proteins mixed with κ-carrageenan or guar gum[J]. Food Chemistry, 2006, 95(2): 255-263.
[17]KACHANECHAIA T, JANTAWATA P, PICHYANGKURAB R, et al. The influence of chitosan on physico-chemical properties of chicken saltsoluble protein gel[J]. Food Hydrocolloids, 2008, 22(1): 74-83.
[18]张根生, 岳晓霞, 李继光, 等. 大豆分离蛋白乳化性影响因素的研究[J]. 食品科学, 2006, 27(7): 48-51.
[19]MU Taihua, TAN Szesze, XUE Youlin. The amino acid composition, solubility and emulsifying properties of sweet potato protein[J]. Food Chemistry, 2009, 112(4): 1002-1005.
[20]王璋, 许时婴, 汤坚, 等. 食品化学[M]. 中国轻工业出版社, 2009: 162.
Isolation and Characterization of Potato Protein Fractions
CUI Zhu-mei,HUANG Hai-shan,QIN Huan-huan,PIAO Jin-miao,QI Bin*
( College of Biology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China)
Potato protein fractions was isolated by combing dialysis and isoelectric precipitation, and their partial physicochemical and functional properties were determined. The results showed that the isolation procedure was feasible, with the acid and alkaline protein fraction of potato tuber accounting for 0.535% and 0.741%, respectively, and their purity were 92.5% and 89.2%, respectively. The acid protein fraction , s sedimentation coefficient was 5S, consisting principally of one subunit band with apparent MW41 kD. The alkline protein fraction ,s sedimentation coefficient was 8S, with 4 subunit bands detected in the SDSPAGE pattern, and apparent MW 25, 23, 22 kD and 16 kD, respectively. The 5S fraction showed greater surface hydrophobicity, fat absorption, and emulsifying capacity, while lower sulfhydryl content, foaming capacity. The 8S fraction showed greater sulfhydryl content and foaming capacity than 5S fraction. The protein fractions of potato were the best choice for functional foods.
potato protein;isolation;functional properties
TS201.21
A
1002-6630(2011)03-0076-05
2010-05-24
崔竹梅(1977-),女,博士研究生,研究方向为粮食油脂与植物蛋白工程。E-mail:zhumeicui0623@yahoo.cn
*通信作者:齐斌(1965-),男,教授,博士,研究方向为粮食油脂与植物蛋白工程。 E-mail:qibin65@126.com
