玉米皮多糖的组成及结构
2011-03-30张艳荣刘相阳王大为
张艳荣,刘相阳,于 君,王大为
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
玉米皮多糖的组成及结构
张艳荣,刘相阳,于 君,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
采用紫外光谱、纸层析及比色等分析方法对分离纯化制得的玉米皮多糖A-1(CSPA-1)、A-2(CSPA-2)、B(CSPB)的总糖含量、单糖组成及基本结构进行初步研究。结果表明:CSPA-1、CSPA-2和CSPB皆为白色粉末,其中CSPB微溶于水,其他易溶于水,不溶于高浓度的有机溶剂,不含蛋白质和淀粉,均含有糖醛酸。CSPA-1总糖含量为99.3%,糖醛酸含量为16.6%,糖基组成为葡萄糖、木糖及阿拉伯糖,可能还含有微量鼠李糖;CSPA-2总糖含量为93.4%,糖醛酸含量为21.7%,糖基组成为葡萄糖、木糖、阿拉伯糖及鼠李糖;CSPB总糖含量为83.3%,糖醛酸含量为6.82%,糖基组成为葡萄糖、木糖及阿拉伯糖。高碘酸氧化分析表明:CSPA-1中1→2糖苷键或1→4糖苷键残基比例为25%,1→6糖苷键残基比例为3%;CSPA-2中1→2糖苷键或1→4糖苷键残基比例为25.7%,1→6糖苷键残基比例为3%;CSPB中1→2糖苷键或1→4糖苷键残基比例为34.1%,1→6糖苷键残基比例为1%。
玉米皮;多糖;单糖;结构
玉米是世界主要的粮油、化工原料之一,也是我国的主要农作物之一。目前玉米精深加工主要是玉米淀粉的生产及其利用,而占玉米籽粒的15%左右的玉米皮,主要成分为半纤维素、纤维素及木质素,是生产食用或药用植物活性多糖的良好原料,但由于缺乏相关基础理论研究,目前未得到充分利用,绝大多数用于饲料的生产或废弃,造成食物资源的浪费。玉米皮多糖是玉米皮纤维的进一步加工产物,其水溶性及加工性能优于玉米皮纤维[1]。多糖的单糖组成及结构与其功效具有明显的相关性[2-4],本研究对提取、分离及纯化后的玉米皮多糖(corn spermoderm polysaccharide,CSP)进行总糖含量、单糖组成及结构特点等进行研究[5],为进一步研究其在保健食品开发中应用,玉米皮膳食纤维及玉米皮多糖的质量评价提供参考。
1 材料与方法
1.1 材料与试剂
玉米皮 长春大成新资源集团有限公司提供。玉米皮多糖玉米皮多糖A-1(CSPA-1)、A-2(CSPA-2)、B(CSPB)均由吉林农业大学粮油植物蛋白工程实验室自制,其中CSPA-1的相对分子质量为186170,CSPA-2的相对分子质量为103885,CSPB的相对分子质量为146887[5]。
十六烷基三甲基溴化铵、硼酸、乙二醇 北京化工厂;氯化钡 北京东方德教育科技有限公司;高碘酸钠 北京(中西泰安)技术服务有限公司;无水乙醇、可溶性淀粉 天津市北方天医化学试剂厂;碘化钾 天津市光复精细化工研究所;无水乙二胺 天津市北晨方正试剂厂;葡萄糖醛酸、硼酸钠 上海沪峰生物科技有限公司;硼氢化钠 上海艾锐化工有限公司;考马斯亮蓝G-250 中国惠市生化试剂有限公司;苯胺、二苯胺 辽宁鑫宇化工商贸公司;硅胶G 青岛海洋化工有限公司; Dextran T10、T40、T70、T500 美国Sigma公司;Sephadex G-75葡聚糖凝胶、Sephadex G-100葡聚糖凝胶、蓝色葡聚糖 瑞典Pharmacia公司。
1.2 仪器与设备
GB1302电子精密天平 梅特勒-托利多仪器有限公司;CT15RT高速冷冻离心机 上海天美生化仪器设备工程有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;HA121-50-02型超临界萃取装置 江苏南通华安超临界萃取有限公司;NN-J993型微波炉 日本松下电器产业株式会社;层析柱 上海精密科学仪器有限公司;BSZ-160F型自动收集器 上海精科实业有限公司;UV2300紫外-可见光分光光度计、CT15RT高速冷冻离心机 上海天美生化仪器设备工程有限公司;85-2型恒温磁力搅拌器 上海南汇电讯器材厂;101-2E电热鼓风干燥器 上海实验仪器有限公司;透析袋(分子截留量10000) 美国Sigma公司;SHB-B95A型循环水式多用真空泵 郑州长城科贸有限公司。
1.3 方法
1.3.1 多糖含量测定[6-7]
采用苯酚-硫酸法测定玉米皮多糖A-1(CSPA-1)、A-2(CSPA-2)、B(CSPB)的总糖含量。分别吸取0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8mL质量浓度为0.04mg/mL的标准葡萄糖溶液于试管中,各加入蒸馏水补至2.0mL,加入6%苯酚溶液1mL及浓硫酸5mL,振荡摇匀,室温静置30min后于490nm波长处测定光密度,以2.0mL蒸馏水作为空白。
样品测定:以葡萄糖含量(μg/mL)为横坐标,光密度值为纵坐标作标准曲线。取4mg/mL粗多糖溶液1.0mL于试管中,按上述步骤操作,测定光密度,以标准曲线计算多糖含量。苯酚-硫酸法葡萄糖标准曲线回归方程为y=0.0074x+0.0036(R2=0.9993)。
1.3.2 多糖中糖醛酸含量的测定[2]
精确称取葡萄糖醛酸100mg,置于100mL容量瓶中,加入饱和硼酸钠溶液定容,摇匀后精确量取2.5mL,置于50mL容量瓶中,加入饱和硼酸钠溶液稀释至刻度,摇匀。此时每1mL溶液含葡萄糖醛酸50μg。分别量取葡萄糖醛酸溶液0、0.2、0.4、0.6、0.8、1.0mL,分别置于试管中,依次加入饱和硼酸钠溶液至1.0mL,摇匀,置冰水浴中冷却,然后缓缓滴加0.025mol/L硼酸钠-硫酸溶液5.0mL,置沸水浴加热20min(中间振摇一次),迅速冷却,加0.2%咔唑-无水乙醇溶液0.2mL,摇匀,置沸水浴中20min(中间振摇一次),冷却至室温。于530nm波长处测光密度,以0管为空白,横坐标为葡萄糖醛酸微克数,纵坐标为光密度值,计算回归方程得y=0.0103x-0.0105(R2=0.9974)。
样品测定:吸取用饱和硼酸钠配制的多糖样品液1.0mL(50μg/mL),按上述步骤操作,测光密度,根据标准曲线计算葡萄糖醛酸的含量。
1.3.3 紫外光谱分析[8]
将柱层析后多糖样品少许溶解在少量的蒸馏水中,配成0.5mg/mL的多糖溶液,在波长200~500nm处扫描,检测其在260nm及280nm波长处有无蛋白及核酸吸收峰。
1.3.4 纸层析[9-11]
中速滤纸(3.5cm×30cm),点样量为0.5mg/mL多糖溶液20μL,展开剂为正丙醇:浓氨水:水,其体积比60:45:5,饱和2h,室温展开6h,用苯胺-邻苯二甲酸显色剂染色,吹干后105℃烘烤10min至斑点出现。
1.3.5 比旋光度的测定[8]
将样品溶于重蒸水,用100mm试管,20℃条件下钠光测定其旋光度。按公式(1)计算出比旋度[α]:

式中: 为测得的旋光度(°);ρ为溶液的质量浓度(g/mL);L为试管的长度(dm)。
将多糖样品配制成近似半饱和溶液,置于电磁搅拌器上,在搅拌下滴加乙醇,使乙醇体积分数为30%,离心得到沉淀。上清液中继续滴加乙醇,使溶液中乙醇体积分数达60%,再经离心得沉淀,最后上清液中加入乙醇使体积分数为80%,离心得沉淀。前后3次沉淀,分别经干燥后在相同条件下测定其水溶液的比旋光度。
1.3.6 单糖组成分析[2,10-11]
准确称取0.2g多糖样品于具塞试管中,加入0.2mol/L硫酸溶液10mL,110℃水解8h。冷却后加入碳酸钡中和至中性,离心过滤除去硫酸钡沉淀,得多糖水解物。用毛细管将多糖样品水解物及单糖标准品(10mg/mL)在硅胶板上点样,点样直径为2mm,点间距离1.5mm,点样后自然晾干。展开剂为氯仿-甲醇(体积比为60:40),上行法展开至距板顶端1cm处取出,前沿用铅笔做一记号,在60℃烘箱中烘干。将显色剂苯胺-二苯胺-磷酸溶液均匀地喷洒在薄板上,置于85℃烘箱中烘烤30min后即可显色。
1.3.7 相邻单糖基连接方式分析[2,8,10-11]
分别取CSPA-1、CSPA-2和CSPB各25mg,用少量蒸馏水溶解,加入浓度为30mmol/L的高碘酸钠定容至25mL容量瓶中,置于4℃冰箱中进行反应,间或振摇,于0、4、28、52、76、100h…间隔时间取样,每次0.1mL,蒸馏水稀释250倍后,使用紫外分光光度计在223nm波长处测定吸光度,直至吸光度基本稳定。由此吸光度根据标准曲线计算高碘酸的消耗量。同时加入乙二醇消耗过量的高碘酸以终止反应,放置20min,取2mL反应液,以酚酞为指示剂,用浓度为0.01mol/L的NaOH溶液滴定检测甲酸的生成量。
高碘酸钠消耗量标准曲线的绘制:配制30mmol/L的高碘酸钠溶液100mL,分别吸取1、0.5、1.0、1.5、2.0、4.0mL的高碘酸钠溶液于试管中,各加入蒸馏水补至4.0mL,取混合液0.5mL置于100mL容量瓶中用蒸馏水稀释至刻度,在223nm波长处测吸光度,以混合后溶液中的高碘酸钠的浓度(mmol/L)为横坐标,以吸光度为纵坐标,得高碘酸钠消耗量标准曲线。
2 结果与分析
2.1 多糖含量及糖醛酸含量测定结果
玉米皮多糖含量及糖醛酸含量,结果见表1。

表1 玉米皮多糖总糖含量分析Table 1 Total sugar content of CSP
2.2 比旋光度测定结果
表2 不同体积分数乙醇沉淀玉米皮多糖的比旋光度Table 2 Specific rotatory power of CSP precipitated with different concentrations of ethanol
采用比旋光度法测定玉米皮多糖3个组分的比旋光度,结果如表2所示。不同分子质量多糖具有不同的比旋度,同时在不同体积分数的乙醇中具有不同溶解度,分子质量大的多糖较分子质量小的多糖溶解度小。某一特定体积分数的乙醇往往只析出一定范围分子质量的均一多糖。已知比旋度作为均一分子质量多糖的特征指数,其值也是唯一的(即均一多糖对应唯一的比旋度)。所以,如果不同体积分数的乙醇中沉淀出的多糖,若比旋度相同,则证明它们是相同的均一组分。由旋光测定可知CSPA-1、CSPA-2及CSPB都是均一的多糖组分,其比旋光度分别为+53.2、+102.8及+61.0。
2.3 多糖纯度鉴定
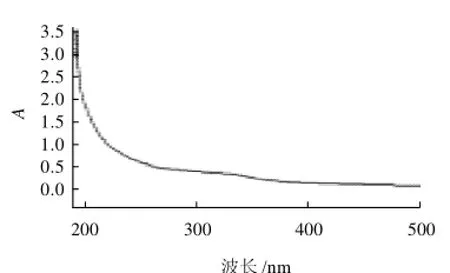
图1 CSPA-1的紫外-可见光谱扫描Fig.1 Ultraviolet-visible spectrogram of CSPA-1

图2 CSPA-2的紫外-可见光谱扫描Fig.2 Ultraviolet-visible spectra of CSPA-2
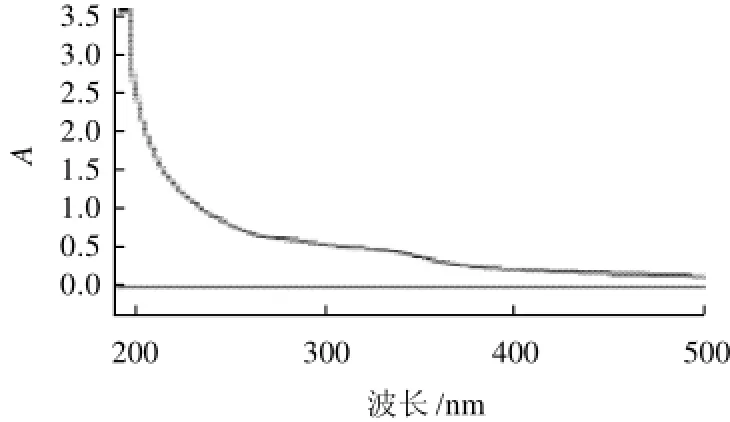
图3 CSPB的紫外-可见光谱扫描Fig.3 Ultraviolet-visible spectra of CSPB
由图1~3可知,3个多糖组分在260nm及280nm波长处均无核酸和蛋白质的特征吸收峰,表明多糖组分中蛋白质脱除效果较好,已得到纯化的多糖组分;CSPA-1、CSPA-2及CSPB纸层析结果均呈现单一斑点,其Rf值分别为0.87、0.64及0.78。通过紫外光谱、纸层析和旋光度测定证明CSPA-1、CSPA-2及CSPB均为均一性多糖。
CSPA-1、CSPA-2和CSPB均为白色粉末,其中CSPB微溶于冷水,易溶于热水,其他都易溶于水;不溶于高浓度的有机溶剂如丙酮、乙醚、乙醇和甲醇等;与考马斯亮蓝反应为阴性,说明其不含有蛋白质;与苯酚-硫酸反应为阳性,说明玉米皮多糖具有糖的通性。与碘-碘化钾呈阴性反应,表明其不含淀粉;与三氯化铁呈阴性反应,表明不含多酚类物质;与硫酸咔唑反应呈阳性,表明其含有糖醛酸。
2.4 单糖组成分析结果
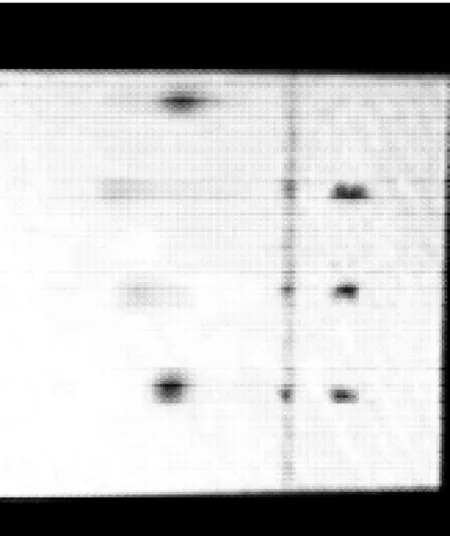
图4 CSPA-1层析图Fig.4 Chromatographic profile of CSPA-1
图4 CSPA-1水解产物的薄层层析结果表明:CSPA-1由葡萄糖(灰绿色)、木糖(亮蓝色)及阿拉伯糖(亮蓝色)组成,可能还含有微量鼠李糖(黄棕色)。如果以葡萄糖的Rf值为1,则它们的相对Rf值之比为1:1.48:1.10。CSPA-2水解产物的薄层层析结果表明 ,CSPA-2由葡萄糖(灰绿色)、木糖(亮蓝色)、阿拉伯糖(亮蓝色)及鼠李糖(黄棕色)组成。如果以葡萄糖的Rf值为1,则它们的相对Rf值之比为1:1.89:1.23:0.69。CSPB水解产物的薄层层析结果表明,CSPB由葡萄糖(灰绿色)、木糖(亮蓝色)及阿拉伯糖(亮蓝色)组成。如果以葡萄糖的Rf值为1,则它们的相对Rf值之比为1:1.78:1.56。
2.5 相邻单糖基连接方式分析结果
2.5.1 CSPA-1的高碘酸氧化结果
25mg CSPA-1经高碘酸氧化172h后,在223nm波长处检测溶液吸光度达到稳定,吸光度由1.167下降到0.628,代入高碘酸钠浓度回归方程y = 10.732x-0.0177 (R2= 0.999),可计算得每摩尔己糖消耗0.31mol高碘酸,同时生成0.03mol的甲酸,表明其中1→6糖苷键连接残基占3%,尚有可被高碘酸氧化但不产生甲酸的1→2糖苷键或者1→4糖苷键残基占25%,可氧化残基占28%,不可氧化残基占72%。
2.5.2 CSPA-2的高碘酸氧化结果
25mg CSPA-2经高碘酸氧化172h后,在223nm波长处检测溶液吸光度达到稳定,吸光度由1.161下降到0.708,代入高碘酸钠浓度回归方程y = 10.732x-0.0177 (R2= 0.999),可计算得每摩尔己糖消耗0.263mol高碘酸,同时生成0.03mol的甲酸,表明其中1→6糖苷键连接残基占3%,尚有可被高碘酸氧化但不产生甲酸的1→2糖苷键或者1→4糖苷键残基占25.7%,可氧化残基占28.7%,不可氧化残基占71.3%。
2.5.3 CSPB的高碘酸氧化结果
25mgCSPB经高碘酸氧化196h后,在223nm波长处检测溶液吸光度达到稳定,吸光度由1.226下降到0.606,代入高碘酸钠浓度回归方程y = 10.732x-0.0177(R2= 0.999),可计算得每摩尔己糖消耗0.361mol高碘酸,同时生成0.01mol的甲酸,表明其中1→6糖苷键连接残基占1%,尚有可被高碘酸氧化但不产生甲酸的1→2糖苷键或者1→4糖苷键残基占34.1%,可氧化残基占35.1%,不可氧化残基占64.9%。
3 讨 论
一种多糖只能由一种或几种单糖聚合而成,糖基化的方式及糖苷键连接方式不同,多糖结构的多样性导致多糖的性质的多样性[12]。玉米皮多糖具有复杂的组成(CSPA-1、CSPA-2及CSPB)预示其具有复杂的构效关系。目前对香菇多糖、银耳多糖等食用菌多糖及大豆皮膳食纤维的单糖组成及糖苷键连接方式研究较多[12-14],而对玉米皮多糖单糖组成及糖苷键连接方式的研究未见报道。玉米皮多糖CSPA-1、CSPA-2具有1→4糖苷键连接阿拉伯糖及鼠李糖,易溶于水,不溶于高浓度的有机溶剂,不含淀粉,使其呈现出类似果胶样胶黏特性,预示其具有较大的吸水及持水特性,可用于面包面团改良剂的生产原料[15]。玉米皮多糖单糖组成及结构的多样性为其在功能食品或保健食品的应用提供了基本保证[3,16]。
[1]张艳荣, 王大为, 祝威. 高品质玉米膳食纤维生产工艺的研究[J]. 食品科学, 2004, 25(9): 213-217.
[2]肖朱洋. 多糖的结构分析与构效关系[J]. 海峡药学, 2007, 19(3): 98-100.
[3]诸葛健, 赵振锋, 方慧英. 功能性多糖的构效关系[J]. 无锡轻工大学学报, 2002, 21(2): 208-210.
[4]李凤玲, 何金环. 植物多糖的结构与分离纯化技术研究进展[J]. 植物生理科学, 2008, 24(10): 276-279.
[5]张艳荣, 于君, 刘相阳, 等. 玉米皮多糖提取、分离纯化及相对分子量的测定[J]. 食品科学, 2010, 31(10):16-19.
[6]李建武, 萧能, 余瑞元, 等. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1994: 168-l70.
[7]郭振楚. 糖类化学[M]. 北京: 化学工业出版社, 2005: 59-88.
[8]陈晓青, 蒋新宇, 刘佳佳. 中草药成分分离分析技术与方法[M]. 北京: 化学工业出版社, 2006: 206-227.
[9]赵亚华, 高向阳. 生物化学试验技术教程[M]. 广州: 华南理工大学出版社, 2000: 23-25.
[10]陈来同. 生化工艺学[M]. 北京: 科学出版社, 2004: 58-70; 381-387.
[11]盛龙生, 何丽一 , 徐连连, 等. 药物分析[M]. 北京: 化学工业出版社, 2003: 81-204.
[12]毛跟年, 许牡丹. 功能食品生理特性与检测技术[M]. 北京: 化学工业出版社, 2005: 33-58: 103-124.
[13]石雪萍. 植物多糖研究进展[J]. 粮食与油脂, 2005(8): 8-10.
[14]金征宇, 顾正彪. 碳水化合物化学: 原理与应用[M]. 北京: 化学工业出社, 2008: 229-252.
[15]郑建仙. 低能量食品[M]. 北京: 中国轻工业出版社, 2001: 11-31.
[16]董群, 方积年. 多糖在医药领域中的应用[J]. 中国药学杂志, 2001, 36(10): 649-651.
Monosaccharide Component and Structure of Polysaccharides from Corn Spermoderm
ZHANG Yan-rong,LIU Xiang-yang,YU Jun,WANG Da-wei*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
The total polysaccharide content, monosaccharide component and structure of three factions of polysaccharides from corn spermoderm, CSPA-1, CSPA-2 and CSPB, were measured through the ultraviolet-visible spectrogram, paper chromatography and polarimetric analysis testing in this preliminary study. CSPA-1, CSPA-2 and CSPB all were white powder, and CSPB was only slightly soluble in water, while CSPA-1and CSPA-2 completely soluble. They all were insoluble in high concentrations of organic solvent and did not contain any protein or starch but glucuronic acid. Total polysaccharide content of CSPA-1 was 99.3%, and glucuronic acid content 16.6%. The monosaccharide unit of CSPA-1 was identified as glucose, xylose and arabinose, and possibly rhamnos. Total polysaccharide content of CSPA-2 was 93.4%, and glucuronic acid was 21.7%. The monosaccharide unit of CSPA-2 was identified as glucose, xylose, arabinose and rhamnose. Total polysaccharide content of CSPB was 83.3%, with glucuronic acid being 6.82%. The monosaccharide unit of CSPB was identified as glucose, xylose, and arabinose. Periodate oxidation analysis showed that CSPA-1 had 1→2 linked or 1→4 linked (25%) and 1→6 linked (3%); CSPA-2 was 1→2 linked or 1→4 linked (25.7%) and 1→6 linked (3%); CSPB was 1→2 linked or 1→4 linked (34.1%) and 1→6 linked (1%).
corn spermoderm;polysaccharide;monosaccharide;structure
S513
A
1002-6630(2011)03-0064-04
2010-08-02
国家“863”计划项目(2007AA10Z336)
张艳荣(1965—),女,教授,博士,研究方向为粮食、油脂与植物蛋白工程。E-mail:xcpyfzx@163.com
*通信作者:王大为(1960—),男,教授,博士,研究方向为粮食、油脂与植物蛋白工程及功能食品。E-mail:xcpyfzx@163.com
