陕北野生枸杞多糖的体外抗氧化活性
2011-03-30马虎飞王思敏杨章民
马虎飞,王思敏,杨章民
陕北野生枸杞多糖的体外抗氧化活性
马虎飞,王思敏,杨章民*
(陕西师范大学生命科学学院,陕西 西安 710062)
目的:测定陕北野生枸杞中总糖含量、糖醛酸含量以及体外抗氧化活性。方法:采用苯酚-硫酸法,测定枸杞提取物的总糖含量;用硫酸-咔唑法,测定枸杞多糖的糖醛酸含量;通过红外光谱技术初步分析枸杞多糖基团的构成;并以VC为对照,比较枸杞多糖对二苯代苦味酰基(DPPH)自由基、超氧阴离子自由基、羟自由基的体外抗氧化活性及还原力。结果:陕北枸杞提取物中的总糖含量为58.31%,糖醛酸含量为32.17%。 当枸杞多糖的质量浓度为1mg/mL时,对DPPH自由基、超氧阴离子自由基、羟自由基清除率分别为81.30%、50.33%和60.57%,还原能力比VC稍低。结论:陕北野生枸杞多糖有很强的抗氧化活性。
陕北;枸杞;多糖;自由基;体外抗氧化活性
枸杞(Lycium chinense Miller)为茄科枸杞属(Lycium Linn.)植物,其果实是一种“药食同源”的功能保健性食品,也是一味常用的补肝益肾中药,其色鲜红,味酸甜。现代医学研究证实其含有多糖、亚油酸、粗蛋白、维生素(VA、VC、VB1、VB2)、甜菜碱、矿物质(钙、磷、铁、锌、锰)等营养成分,枸杞多糖(Lycium barbarum polysaccharides,LBPs)为枸杞中的主要活性成分之一[1]。药理研究表明,枸杞多糖具有抗肿瘤、抗衰老、抗疲劳、降血脂、降血糖、调节免疫等多种保健功能[2]。LBPs是枸杞的主要功效成分,具有良好的抗氧化活性[3]。国内外类似的研究也发现,合理摄入天然抗氧化剂可预防和延缓癌症、动脉粥样硬化、痴呆和衰老等退行性疾病的发生与发展[4-6]。
枸杞属几乎在我国各省均有野生分布或栽培,共有7个种3个变种,其中最负盛名的当属宁夏枸杞。陕北枸杞因能适应各种恶劣的生态环境(耐旱、耐寒、耐沙尘、抗辐射),生长于贫瘠的沟梁土壤,加之当地群众对其药用价值不甚了解及毁灭性利用,致使陕北野生枸杞的存在与分布量逐年降低,致使该野生资源处于越来越稀少的状态,对其利用及保护迫在眉睫,也是保护陕北脆弱的生态环境所需,然而目前关于陕北野生枸杞多糖有何利用价值报道较少。本研究拟在体外对其提取物中多糖的抗氧化活性和还原能力进行测定,以期为其开发利用、资源保护提供依据。
1 材料与方法
1.1 材料与试剂
实验所用枸杞采集自陕北榆林地区横山县。
1,1-二苯基-2-苦基肼(1,1-dipheny1-2-picrylhydrazyl,DPPH)、考马斯亮蓝G-250、铁氰化钾[K3Fe (CN)6]、三氯乙酸(TCA)、抗坏血酸 美国Sigma公司;二丁基羟基甲苯(BHT)、氮蓝四唑(NBT)、吩嗪硫酸甲脂(PMS)、还原型辅酶(NADH)、2-脱氧-D-核糖(DR) 德国Applichem公司;溴化甲(KBr)、甲醇、三氯化铁(FeCl3)、双氧水以及无水乙醇等均为国产分析纯。
1.2 仪器与设备
TU1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;旋转蒸发仪 上海亚荣生化仪器公司;冷冻干燥机 北京博医康实验仪器有限公司;Spectrum GX型红外光谱仪 美国Perkin-Elmer公司。
1.3 方法
1.3.1 枸杞多糖的分离纯化
称取100g陕北野生枸杞,粉碎后脱脂,将粉末置于圆底烧瓶中加入95%乙醇,搅拌、80℃水浴,冷凝回流4 h,倒出乙醇,自然干燥。除去脂肪后,加入蒸馏水,于80℃水浴4h,重复2次,离心取上清液,将上清液收集到旋转蒸发器,抽真空浓缩,浓缩液加无水乙醇沉淀过夜,重复3次。用反复冻融除蛋白10次以上,随后将滤液装入透析袋内透析2d,最后在冷冻干燥机上冷冻干燥,得枸杞多糖提取物(LBP)。
1.3.2 总糖、糖醛酸及蛋白质含量的测定
总糖含量测定采用苯酚-硫酸法[7],糖醛酸分析含量采用硫酸-咔唑法[8],蛋白含量检测采用考马斯亮蓝G-250染色法[9]。
1.3.3 野生枸杞多糖的红外光谱分析
称取5mg的LBP,与750mg KBr充分混匀,压片,红外光谱仪于4000~650cm-1波数范围内扫描。
1.3.4 DPPH自由基清除率的测定
参照Kumaran等[10]报道的方法进行:吸取不同质量浓度样品1mL于试管中,然后依次加入3mL 0.004% DPPH甲醇溶液,充分混匀,避光静置20min后,以甲醇作空白对照,517nm波长测吸光度,以蒸馏水代替样品液作阴性对照,VC作阳性对照。
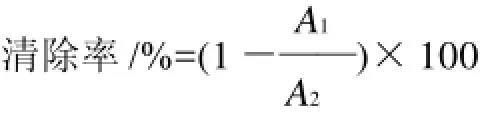
式中:A1为样品吸光度;A2为蒸馏水吸光度。
1.3.5 对超氧阴离子自由基清除率的测定
参照张改平等[11]报道的方法进行:吸取不同质量浓度样品液1mL于试管中,依次加入1mL 0.078mol/L NBT,1mL 0.468mol/L NADH,最后加入0.4mL的0.06mol/L PMS溶液,室温摇匀,后静置5min,于560nm波长处测定吸光度,调零组用不同质量浓度样品液1mL,0.4mL蒸馏水代替PMS溶液调零,用蒸馏水作阴性对照,VC作阳性对照,清除率计算如上所述。
1.3.6 对羟自由基清除作用的测定
参照Siddhuraju等[12]报道的方法进行:取不同质量浓度的样品液1mL,先后加入1.5mL反应液[含0.1mmol/L EDTA、0.1mmol/L FeCl3和2.8mmol/L DR的磷酸盐缓冲液(pH7.4)],0.35mL H2O2(20mmol/L),37℃恒温水浴作用40min后,终止反应,于532nm波长处测定吸光度,蒸馏水为阴性对照,VC为阳性对照,抑制率计算同上所述。
1.3.7 还原力的测定
参照Kumaran等[13]报道的方法进行:将 1mL不同质量浓度的样品液分别与2.5mL磷酸盐缓冲液(pH6.6)及2.5mL铁氰化钾(1%)混合,混合物在50℃水浴中孵育20min,然后加入2.5mL的TCA(10%)终止反应,离心10min,取上清液2.5mL,依次加入2.5mL无水乙醇和0.5mL FeCl3(0.1%),混匀后于700nm波长处测定吸光度,蒸馏水作空白对照,VC作阳性对照。
2 结果与分析
2.1 陕北野生枸杞中总糖的含量
所得结果做回归方程为:y =7.712x+0.006R2(R2= 0.994,y为吸光度,x为质量浓度),计算出提取物中的总糖含量为58.3%。
2.2 糖醛酸和残留蛋白含量
所得结果做回归方程为:y=0.0061x-0.052(R2= 0.9865,y为吸光度,x为质量浓度),计算出样品提取物中糖醛酸的含量为32.17%;回归方程式y=0.0027x-0.035(R2=0.9925,y为吸光度,x为质量浓度),除蛋白后样品中的蛋白残留为0.4%。
2.3 LBP的红外光谱分析
图1可以看出,3440cm-1处出现一宽的吸收峰,反映了O-H和N-H分别伸缩振动引起,为多糖间形成的分子间氢键;2925cm-1附近的尖峰,由-CH2-基团的C-H伸缩振动引起的;1645cm-1处的吸收峰为酰胺羰基特征吸收峰,由-COOH或-CO-基团的C=O非对称伸缩振动引起的;1150cm-1附近的吸收峰,为含有环C-O-C键的吡喃糖特征吸收峰。红外光谱的检测结果表明陕北野生枸杞是一种酸性糖,此结果与硫酸-咔唑法分析的结果一致。

图1 陕北野生枸杞多糖的红外光谱Fig.1 IR spectra of polysaccharide of wild Lycium barbarum from north Shaanxi province
2.4 LBP对DPPH自由基的清除率
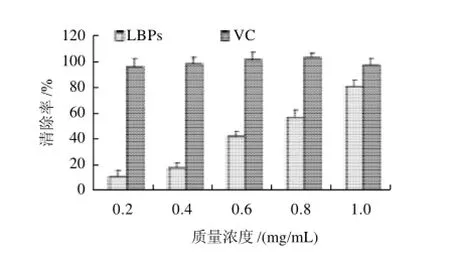
图2 野生枸杞多糖对DPPH自由基清除率Fig.2 Scavenging activities of polysaccharides from wild Lycium barbarum on DPPH radicals
通过测定清除DPPH自由基的方法测定枸杞多糖清除自由基的活性,与VC进行比较。DPPH自由基通常被用来作为底物,因DPPH自由基是一种很稳定的以氮为中心的自由基,其孤对电子在517nm波长附近有强吸收;当有自由基清除剂存在时,孤对电子被配对,吸收消失或减弱。因此通过测定吸收减弱的程度,来评价抗氧化剂的抗氧化活性[12]。如图2所示,陕北野生枸杞多糖有显著的清除DPPH自由基的能力,且表现出良好的剂量依赖关系。在质量浓度为0.2mg/mL时,枸杞多糖对DPPH自由基的清除能力虽然低于VC,但随着质量浓度的升高其清除能力增强,尤其是当质量浓度达到1mg/mL时,枸杞多糖的清除率达到81.30%,接近于VC。枸杞多糖对DPPH自由基有清除能力可能是由于多糖中的羟基具有供氢质体能力的结果。可见陕北野生枸杞多糖具有明显清除DPPH自由基的能力。
2.5 LBP对超氧阴离子自由基的清除率
超氧阴离子自由基作为多种活性氧的前体,能对生物体产生损伤。已知超氧阴离子自由基可在体内产生,它的氧化性较弱,但它会分解成氧化性很强的单线态氧自由基或羟自由基,而单线态氧和羟自由基能使DNA的单股链断裂[14]。由图3可知,陕北野生枸杞多糖能有效地清除超氧阴离子自由基,清除能力随着质量浓度增大而增强。在0.2~1mg/mL剂量浓度范围内,清除超氧阴离子自由基能力弱于VC,但随着质量浓度增加,在0.6mg/mL和0.8mg/mL,其清除能力几乎与VC相当,甚至超越VC;当质量浓度为1mg/mL,清除率是50.33%,这种结果表明在清除超氧阴离子自由基时陕北枸杞多糖具有显著的效果。

图3 野生枸杞多糖对超氧阴离子自由基清除率Fig.3 Scavenging activities of the polysaccharides from wild Lycium barbarum on superoxide anion
2.6 LBP对羟自由基的清除率

图4 野生枸杞多糖对羟自由基清除率Fig.4 Scavenging activities of the polysaccharides from wild Lycium barbarum on hydroxyl radicals
羟自由基和其他自由基相比,是最活跃的体内活性氧,是在生命活动的氧化代谢过程中产生的,可导致大量的疾病发生。对羟自由基清除率的检测也是抗氧化剂抗氧化活性的指标之一,而且对研究自由基的生物有着重要意义。由图4可知,陕北枸杞多糖清除羟自由基的能力在特定质量浓度梯度范围内强于VC,并且随着质量浓度增强,清除能力增强。在质量浓度为1mg/mL时,清除羟自由基的能力是60.57%,强于清除超氧阴离子的能力。
2.7 LBP还原力的测定
多种抗氧化活性的机制已经被阐明了,它们是还原力机制,链引发的抑制机制,过渡金属离子催化剂的折叠机制,过氧化物的分解和自由基清除机理[15]。一种化合物的还原能力可以作为潜在的抗氧化活性的一个重要指标。由表1可知,陕北野生枸杞多糖和VC在一定的质量浓度范围内都有显著的还原能力,并且随着质量浓度的增加而增加。陕北野生枸杞多糖的还原力明显地低于VC。总之在该实验所测定的质量浓度范围内,枸杞多糖的还原能力说明枸杞多糖能作为一种良好的电子供应者,也能终止自由基链的反应,具有一定的抗氧化能力。

表1 野生枸杞多糖还原力的测定结果Table 1 Reducing power of the polysaccharides from wild Lycium barbarum
3 结 论
对陕北野生枸杞中提取的粗多糖的研究表明,枸杞多糖有较好的清除DPPH自由基、超氧阴离子自由基及羟自由基的能力,并且同质量浓度样品液的部分指标与VC的自由基清除能力相当,说明它有良好的抗氧化活性,可以作为一种天然的抗氧化剂,值得开发和利用;由于陕北枸杞多糖特殊的生长环境,它的体内抗氧化活性和机制仍是今后研究的重点。
[1]钱彦丛, 宇文萍. 枸杞子的化学成分及药理研究新进展[J]. 中医药学报, 2000, 28(4):33-35.
[2]黄秋婷, 陈远峰. 枸杞多糖的研究及其进展[J]. 食品研究与开发, 2006, 27(1):172-174.
[3]KONG Q, LILLEHEI K O. Antioxidant inhibitors for cancer therapy[J]. Medical Hypotheses, 1998, 51(5):405-409.
[4]KALIORA A C, DEDOUSSIS G V Z, SCHMIDT H. Dietary antioxidants in preventing atherogenesis[J]. Atherosclerosis, 2006, 187(1):1-17.
[5]WILLIAM, PRYOR A. Vitamin E and heart disease basic science to clinical intervention trials[J]. Free Radical Biology and Medicine, 2000, 28(1):141-164.
[6]OSAWA T. Protective role of dietary polyphenols in oxidative stress[J]. Mechanisms of Ageing and Development, 1999, 111(2):133-139.
[7]黄建华, 范文秀. 白灵菇多糖的提取及含量的测定[J]. 光谱实验室, 2005, 22(5): 1014-1016.
[8]刘翠平, 董群, 方积年. 一种判定多糖中有无糖醛酸残基的简易新方法[J]. 中草药, 2001, 32(5):404-407.
[9]刘小华, 张美霞, 于春梅, 等. 考马斯亮蓝法测定壳聚糖中蛋白的含量[J]. 中国交通医学杂志, 2006, 20(2):159-160.
[10]KUMARAN A, KARUNAKARAN R J. Activity-guided isolation and identification of free radical-scavenging components from an aqueous extract of Coleus aromaticus[J]. Food Chemistry, 2007, 100(1):356-361.
[11]张改平, 杨建雄, 朱玉安. 紫草提取物的体外抗氧化活性研究[J].武汉植物学研究, 2007, 25(5):490-493.
[12]SIDDHURAJU P, BECKER K. The antioxidant and free radical scavenging activities of processed cowpea (Vigna unguiculata (L.) Walp) seed extracts[J]. Food Chemistry, 2007, 101(1):10-19.
[13]KUMARAN A, JOEL KARUNAKRAN R. Antioxidant and free radical scavenging activity of an aqueous extract of Coleus aromaticus[J]. Food Chemistry, 2006, 97(1):109-114.
[14]BAYDAR N G, OZKAN G, YASAR S. Evaluation of the antiradical and antioxidant potential of grape extracts[J]. Food Control, 2007, 18:1131-1136.
[15]PELLEGRINI N, PROTEGGENTE A, PANNALA A, et al. Antioxidant activity applying an improved ABTS+radical cation decolorisation assay[J]. Free Radical Bio Med, 1999, 26:1231-1237.
in vitro Antioxidant Activities of Polysaccharides from Wild Lycium barbarum in North Shaanxi
MA Hu-fei,WANG Si-min,YANG Zhang-min*
(College of Life Science, Shaanxi Normal University, Xi’an 710062, China)
Objective: To determine the content of total polysaccharides (LBP) and uronic acid from wild Lycium barbarum, as well as their in vitro antioxidant activities. Methods: phenol-sulfuric acid and sulfuric acid-carbazole method were used to evaluate the total contents of LBP and uronic acid, respectively. LBP structural composition was detected by IR spectra. DPPH, superoxide anion radicals, hydroxyl radical scavenging and reducing power of LBP were analyzed for antioxidant activity in vitro, with VC as control. Results: The polysaccharides and uronic acid content was 58.31% and 32.17%, respectively, in the extract of wild plants. At 1 mg/mL of polysaccharide, the DPPH, superoxide radical and hydroxyl radicals-scavenging activities was 81.30%, 50.33% and 60.57%, respectively, while the reducing power was slightly lower than that of VC. These results suggested that polysaccharides in extract from wild plants show potent antioxidant activities, which might provide a scientific basis for further exploitation and the significance of protecting Lycium barbarum in north Shaanxi province.
north Shaanxi province;Lycium barbarum;polysaccharide;free radical;antioxidant activity in vitro
O636.1
A
1002-6630(2011)03-0060-04
2010-04-27
国家自然科学基金项目(30870303);陕西省自然科学基金项目(SJ08C102)
马虎飞(1982—),男,硕士研究生,主要从事应用微生物学研究。E-mail:mhfwsm2006@163.com
*通信作者:杨章民(1966—),男,副教授,博士,主要从事分子生物学与应用微生物学研究。
E-mail:yzhangmin@snnu.edu.cn.
