尿素包合法纯化火棘籽油亚油酸与鲨烯工艺
2011-03-28梁先长李加兴田向荣胡平平黄寿恩
梁先长,李加兴,田向荣,胡平平,黄寿恩,黄 诚*
(1.林产化学加工工程湖南省重点实验室,湖南 吉首 416000;2.吉首大学生物资源与环境科学学院,湖南 吉首 416000;3.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;4.吉首大学化学化工学院,湖南 吉首 416000)
尿素包合法纯化火棘籽油亚油酸与鲨烯工艺
梁先长1,李加兴1,田向荣2,胡平平3,黄寿恩3,黄 诚4,*
(1.林产化学加工工程湖南省重点实验室,湖南 吉首 416000;2.吉首大学生物资源与环境科学学院,湖南 吉首 416000;3.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;4.吉首大学化学化工学院,湖南 吉首 416000)
以火棘籽油为原料,采用尿素包合法对其亚油酸进行纯化,并在此基础上通过柱层析分离出鲨烯。通过单因素试验、正交试验和气相色谱-质谱联用(gas chromatography-mass spectroscopy,GC-MS)分析方法,研究尿素包合过程中包合时间、包合温度及火棘籽油、尿素和乙醇之间的配比等因素对亚油酸纯度和回收率的影响。结果表明:火棘籽油在原料∶尿素∶乙醇=1∶2∶6(g/g/mL)、-5℃条件下包合12h,其亚油酸纯度从38.40%提高到68. 55%,回收率达72.23%;纯化后的火棘籽油再经柱层析分离得到鲨烯,纯度达98.16%。
火棘;尿素包合法;亚油酸;柱层析;鲨烯;气相色谱-质谱联用(GC-MS)
亚油酸是人体所需的必需脂肪酸,具有降低人体血清胆固醇含量、预防粥样动脉硬化、降血压作用,对机体代谢起着重要的调节作用[1-3]。而制备纯度较高的亚油酸,则是研究和开发共轭亚油酸的基础,共轭亚油酸是亚油酸的立体和位置异构体混合物的总称,是一种很强的抗癌物质,具有抗动脉粥样化形成、抗糖尿病、抗过敏、调节免疫、促进生长等生理功能[4-8]。鲨烯是一种重要的生物活性物质,具有抗疲劳、抗心血管疾病、抗感染,以及一定的抗癌、防癌及保湿养颜的作用,因此广泛应用于食品、医药和化妆品等众多行业[2,9-13]。
尿素包合法是分离纯化饱和脂肪酸、单不饱和脂肪酸以及多不饱和脂肪酸的有效方法,目前已实现了商业化[14],应用于多种植物油中[15-18],但在火棘籽油中的应用国内未见报道。此法工艺简单,便于操作,溶剂可以回收利用,成本低,且纯化的多不饱和脂肪酸纯度较高,是分离纯化多不饱和脂肪酸的理想方法。
本实验对尿素包合法纯化火棘籽油中亚油酸及柱层析分离鲨烯的主要工艺条件进行系统的研究,将为亚油酸和鲨烯的进一步开发利用提供参考。
1 材料与方法
1.1 材料与试剂
原料为采用溶剂法提取的火棘籽油[19];硅胶H(粒度100~200目)、硅胶G254 青岛海洋化工集团;乙醚、石油醚、无水乙醇、氢氧化钾、氯化钠、无水硫酸钠、尿素等均为分析纯;正己烷、无水甲醇为色谱纯。
1.2 仪器与设备
RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;TMP-2型上皿式电子天平 湘仪天平仪器设备有限公司;DSY-2-4孔恒温水浴锅 北京国华医疗器械厂;MDF-192型冷冻机 日本三洋公司; DZF-6050型真空干燥箱 上海博讯事业有限公司医疗设备厂;SHZ-D(Ⅲ)循环水式真空泵 浙江黄岩求精真空泵厂;QP2010型气相色谱质谱联用仪 日本岛津公司。
1.3 方法
1.3.1 操作要点
将尿素与乙醇按一定比例混合,在70℃旋转回流至尿素全部溶解,加入一定量原料,于80℃回流30min,冷却到室温,控制包合温度反应一段时间后,对包合物减压抽滤,滤液在85℃旋转蒸发回收乙醇,依次用饱和氯化钠、1mol/L盐酸和蒸馏水洗涤,加入正己烷进行萃取分层,合并有机相,浓缩回收正己烷,干燥后即得到纯化后的亚油酸,计算亚油酸的回收率;将活化后的硅胶采用湿法装柱、湿法上样(样品为纯化后的脂肪酸),选择乙醚∶石油醚=1∶6(V/V)作为洗脱剂进行洗脱,保持洗脱速度为1滴/s,每隔3min收集一次,依次编号,将收集的产物甲酯化后采用GC-MS检测鲨烯。
1.3.2 单因素试验
1.3.2.1 包合时间对亚油酸纯化效果的影响
采用乙醇∶尿素4∶1(mL/g)、尿素∶原料4∶1(g/g)、包合温度5℃的条件,对火棘籽油分别处理4、6、8、10、12、14h,以亚油酸纯度和回收率为评价指标,探讨适宜的包合时间。
1.3.2.2 乙醇与尿素比对亚油酸纯化效果的影响
采用尿素∶原料4∶1(g/g)、包合温度5℃、乙醇∶尿素为1∶1、2∶1、3∶1、4∶1、5∶1、6∶1(mL/g)的条件,分别对火棘籽油包合12h,以亚油酸纯度和回收率为评价指标,探讨适宜的乙醇与尿素配比。
1.3.2.3 包合温度对亚油酸纯化效果的影响
采用乙醇与尿素比3∶1(mL/g)、尿素与原料比3∶1 (g/g),包合温度为-15、-10、-5、0、5、10℃的条件,分别对火棘籽油包合12h,以亚油酸纯度和回收率为评价指标,探讨适宜的包合温度。
1.3.2.4 尿素与原料比对亚油酸纯化效果的影响
采用乙醇∶尿素3∶1(mL/g)、包合温度-5℃,尿素∶原料为1∶1、2∶1、3∶1、4∶1、5∶1、6∶1(g/g)的条件,分别对火棘籽油包合12h,以亚油酸纯度和回收率为评价指标,探讨适宜的尿素用量。
1.3.3 尿素包合法纯化火棘籽油中亚油酸工艺优化
通过单因素试验结果,确定包合时间、乙醇∶尿素、包合温度和尿素∶原料4个因素是影响亚油酸纯化效果的主要因素,故以此4因素设计L9(34)正交试验,以亚油酸纯度和回收率为评价指标,优化提取工艺。试验设计的因素水平见表1。

表1 正交试验因素与水平Table 1 Factors and levels in orthogonal array design
1.4 分析评价方法
1.4.1 纯度分析
采用GC-MS法分析检测,面积归一法计算纯度。
1.4.1.1 原料甲酯化处理[20]
采用KOH-甲醇法。吸取0.5mL火棘籽油于25mL具塞试管中,加入3mL正己烷溶解,再加入2mL甲醇和2mL 1mol/L KOH-甲醇溶液,振荡,于60℃水浴30min,冷却,加入2mL饱和NaCl溶液,静置10min分层,取上清液进行GC-MS分析。
1.4.1.2 色谱条件
Rtx-5MS色谱柱(30m×0.32mm,0.25μm);载气:He(99.99%);进样量:0.5μL;进样方式:分流进样,分流比:20∶1;流速:1.0mL/min;进样温度:250℃;色谱-质谱接口温度:230℃;程序升温:100℃(保持2min),以4℃/min升温至250℃并保持2min。
1.4.1.3 质谱条件
离子源:EI离子源;电子能:70eV;接口温度:230℃;离子源温度:200℃;质量扫描范围:m/z29~450。
1.4.2 亚油酸回收率计算

2 结果与分析
2.1 包合时间对亚油酸纯化效果的影响
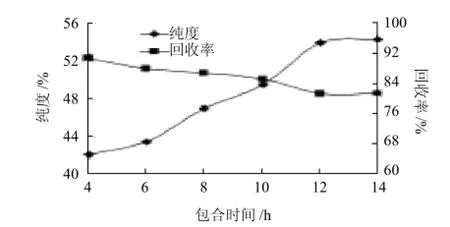
图1 包合时间对亚油酸纯化效果的影响Fig.1 Effect of adduction time on purity of linoleic acid
由图1可知,随着包合时间的延长,亚油酸纯度随之升高,回收率有所下降;当包合时间达到12h后,亚油酸纯度和回收率均趋于平缓。因此,包合时间选择12h左右较为适宜。
2.2 乙醇∶尿素对亚油酸纯化效果的影响

图2 乙醇:尿素对亚油酸纯化效果的影响Fig.2 Effect of ethanol-urea ratio on purity of linoleic acid
由图2可知,当乙醇∶尿素小于3∶1(mL/g)时,亚油酸的纯度随着乙醇∶尿素比例的增大而升高,当乙醇∶尿素大于3∶1(mL/g)时,亚油酸的纯度随着乙醇∶尿素比例的增大反而降低;当乙醇∶尿素小于3∶1(mL/g)时,亚油酸的回收率随着乙醇∶尿素比例的增大而增大,当乙醇∶尿素为4∶1(mL/g)时,亚油酸回收率增幅趋于平缓。尿素用量越多,所得产品纯度就越高,但产品的回收率越低[12]。综合考虑亚油酸的纯度和回收率,乙醇与尿素的比例选择3∶1(mL/g)左右较为适宜。
2.3 包合温度对亚油酸纯化效果的影响
由图3可知,随着包合温度的降低,亚油酸的纯度升高而回收率下降[8]。当包合温度在-15~-5℃时,亚油酸的纯度趋于平缓,但回收率趋于上升;当包合温度在-5~10℃时,亚油酸回收率上升,但其纯度下降。综合考虑亚油酸的纯度和回收率,包合温度选择-5℃比较合适。

图3 包合温度对亚油酸纯化效率的影响Fig.3 Effect of adduction temperature on purity of linoleic acid
2.4 尿素与原料比对亚油酸纯化效果的影响

图4 尿素:油脂对亚油酸纯化效率的影响Fig.4 Effect of urea-oil ratio on purity of linoleic acid
由图4可知,当尿素与原料的比例在2∶1~6∶1(g/g)之间时,亚油酸纯度和回收率变化均不大;继续增大原料用量到1∶1(g/g)时,会有少量原料未被尿素络合,使得亚油酸纯度较低,但回收率较高。综合考虑亚油酸的纯度、回收率以及成本因素,选取尿素与原料的比例为2∶1(g/g)较合适。
2.5 尿素包合法纯化火棘籽油中亚油酸提取工艺优化正交试验
由表2极差值R分析可知,影响亚油酸纯度的主要因素主次顺序为:D>C>B>A;影响亚油酸回收率的主要因素主次顺序为:D>A>B>C。从k值大小可知,影响亚油酸纯度最优化工艺组合条件为:包合时间12h、乙醇∶尿素3∶1(mL/g)、包合温度-10℃、尿素∶原料2∶1(g/g),在此条件下进行3次平行验证实验,亚油酸纯度为68.83%,回收率为63.42%;影响亚油酸回收率最优化工艺组合条件为:包合时间10h、乙醇∶尿素3∶1(mL/g)、包合温度-5℃、尿素∶原料1∶1(g/g),在此条件下进行3次平行验证实验,亚油酸纯度为58.76%,回收率为76.45%。综合考虑亚油酸纯度和回收率,得出尿素包合法纯化火棘籽油中亚油酸的最佳工艺条件为包合时间12h、乙醇∶尿素3∶1(mL/g)、包合温度-5℃和尿素∶原料2∶1(g/g)。
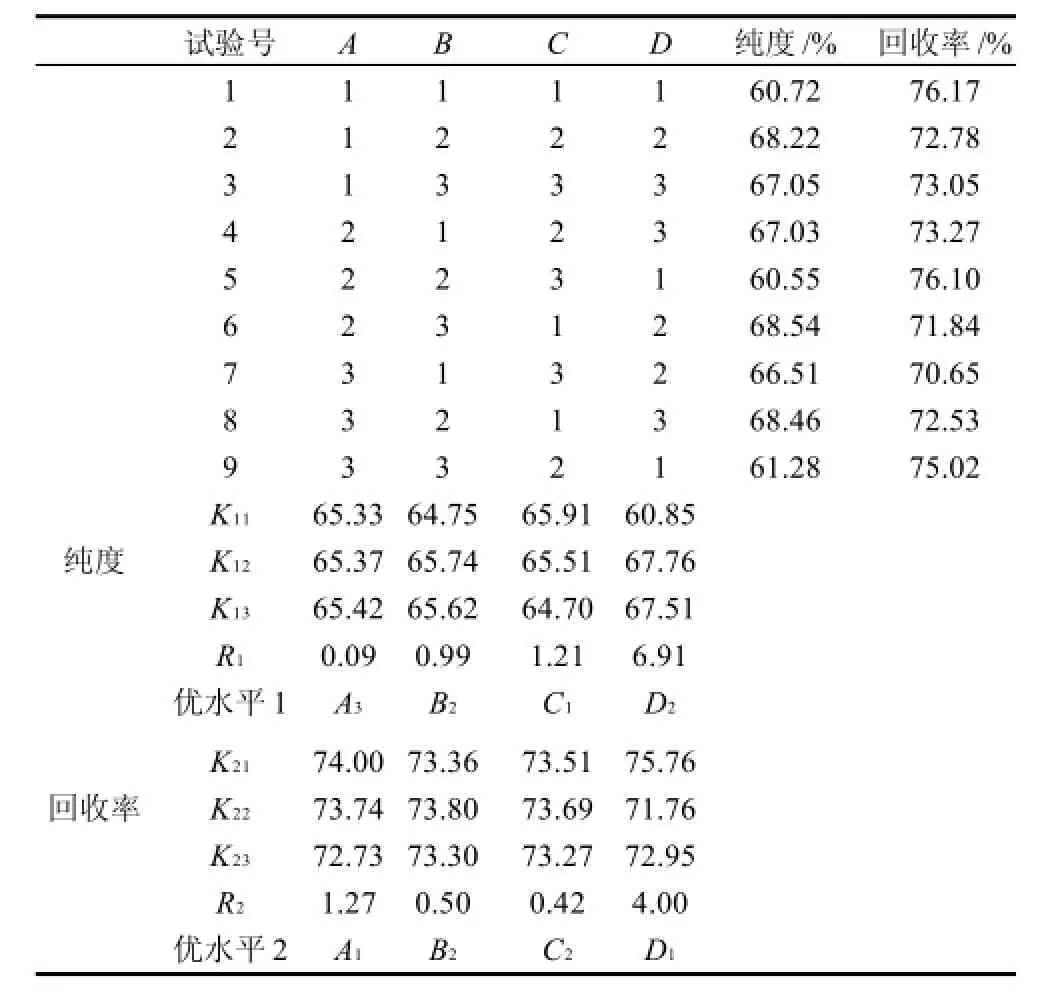
表2 尿素包合法纯化火棘籽油中亚油酸正交试验设计及结果Table 2 Orthogonal array design and corresponding experimental results
2.5 GC-MS分析结果
2.5.1 原料脂肪酸组成及相对含量
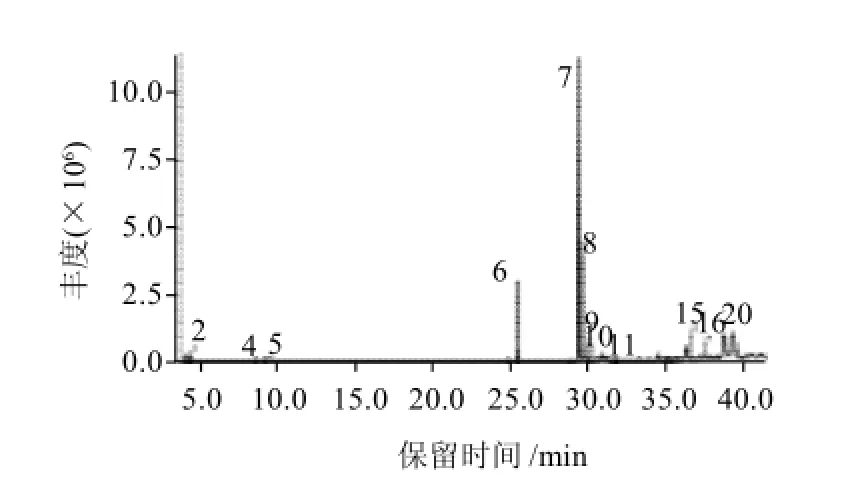
图5 火棘籽油GC-MS总离子流图Fig.5 GC-MS total ion current chromatogram of Pyracantha fortuneana seed oil

表3 火棘籽油脂肪酸组成及相对含量Table 3 Fatty acid composition of fatty acids in Pyracantha fortuneana seed oil
由图5和表3可知,火棘籽油的脂肪酸成分主要有:软脂酸(11.09%)、亚油酸(38.40%)、油酸(20.69%)、硬脂酸(2.73%)、鲨烯(0.46%),未检出亚麻酸。其中,亚油酸的含量最高。
2.5.2 原料纯化后的脂肪酸组成及相对含量

图6 纯化后的火棘籽油GC-MS总离子流图Fig.6 GC-MS total ion current chromatogram of purified Pyracantha fortuneana seed oil

表4 纯化后的火棘籽油脂肪酸组成及相对含量Table 4 Fatty acid composition of purified Pyracantha fortuneana seed oil
由图6和表4可知,纯化后的火棘籽油主要含有:软脂酸(6.63%)、亚油酸(68.55%)、油酸(14.43%)、硬脂酸(0.78%)、鲨烯(2.43%)。与国内同一类型研究比较[21-23],为首次从火棘籽油中检测到鲨烯。
2.5.3 鲨烯纯度分析

图7 纯化后的鲨烯GC-MS总离子流图Fig.7 GC-MS total ion current chromatogram of separated squalene
由图7可知,谱图中主出现一个主峰,经计算其谱图峰面积,得到此测定物的相对含量为98.16%,GCMS分析此物质为鲨烯,相似度为97%。
3 结 论
3.1 火棘籽油在原料∶尿素∶乙醇=1∶2∶6(g/g/mL)、-5℃条件下包合12h,亚油酸的纯度从38.40%提高到68.55%,回收率为72.23%。为了提高产品纯度,可采用多次尿素包合法。
3.2 从火棘籽油中分离得到鲨烯,采用柱层析纯化的鲨烯纯度达到98.16%。
3.3 在尿素包合法纯化亚油酸过程中,由于有相当一部分尿素溶于乙醇中,使得包合的饱和脂肪酸和单不饱和脂肪酸存在于液相中,使用石油醚、正己烷等溶剂萃取时形成一个均一体系,给分离纯化多不饱和脂肪酸带来极大的困难。因此,解决这一难点是尿素包合法分离纯化得到高纯度多不饱和脂肪酸的关键。
[1]孔保华. 降血压、血脂功能性食品[M]. 北京∶ 化学工业出版社, 2005∶87-90.
[2]吴谋成. 功能食品研究与应用[M]. 北京∶ 化学工业出版社, 2004∶ 109-110; 121-122.
[3]陈仁惇. 营养保健食品[M]. 北京∶ 轻工业出版社, 2001∶ 169-171.
[4]吴冀华, 裘爱泳. 共轭亚油酸的生理功能∶Ⅰ[J]. 中国油脂, 2001, 26 (5)∶ 49-51.
[5]吴冀华, 裘爱泳. 共轭亚油酸的生理功能∶ Ⅱ[J]. 中国油脂, 2001, 26 (6)∶ 45-47.
[6]BRIJWANI K, VADLANI P V. Lipase-mediated hydrolysis of corn DDGS oil∶ Kinetics of linoleic acid production[J]. Biochemical Engineering Journal, 2010, 52(2/3)∶ 289-295.
[7]EGASHIRA Y, NAKAZAWA A, OHTA T, et al. Effect of dietary linoleic acid on the tryptophanniacin metabolism in streptozotocin diabetic rats [J]. Comparative Biochemistry and Physiology Part A∶ Physiology, 1995, 111(4)∶ 539-545.
[8]GOUPY P, VULCAIN E, CARIS-VEYRAT C, et al. Dietary antioxidants as inhibitors of the heme-induced peroxidation of linoleic acid∶Mechanism of action and synergism[J]. Free Radical Biology and Medicine, 2007, 43(6)∶ 933-946.
[9]吴时敏. 角鲨烯开发利用[J]. 粮食与油脂, 2001, 14(1)∶ 36.
[10]梁新华, 郑彩霞, 张风侠. 甘草中角鲨烯高效液相色谱法测定[J]. 时珍国医国药, 2010, 21(8)∶ 1856-1857.
[11]赵振东, 孙震. 生物活性物质角鲨烯的资源及其应用研究进展[J]. 林产化学与工业, 2004, 24(3)∶ 107-112.
[12]BAKES M J, NICHOLS P D. Lipid, fatty acid and squalene composition of liver oil from six species of deep-sea sharks collected in southern Australian waters[J]. Comparative Biochemistry and Physiology Part B∶ Biochemistry and Molecular Biology, 1995, 110(1)∶ 267-275.
[13]GUNAWAN S, KASIM N S, JU Y H. Separation and purification of squalene from soybean oil deodorizer distillate[J]. Separation and Purification Technology, 2008, 60(2)∶ 128-135.
[14]肖卫红, 高珏. 尿素包合法分离橡胶籽油中多价不饱和脂肪酸[J]. 精细化工, 2002, 19(1)∶ 12-14.
[15]李小陆, 李贵深, 许万生, 等. 尿素络合法分离棉子油中的亚油酸[J].河北农业大学学报, 1989, 12(1)∶ 127-134.
[16]肖卫红, 李长彪, 高珏, 等. 多价不饱和脂肪酸分离方法及在橡胶籽油中的应用[J]. 云南化工, 2000, 27(1)∶ 26-28.
[17]刘晓华, 曹郁生, 陈燕, 等. 尿素包合法纯化玉米油中亚油酸的研究[J]. 中国油脂, 2004, 29(2)∶ 40-42.
[18]曾哲灵, 徐春涛, 熊涛. 尿素包合法分离纯化葵花籽油中亚油酸[J].南昌大学学报∶ 理科版, 2007, 31(3)∶ 287-289.
[19]梁先长, 李加兴, 黄寿恩, 等. 火棘籽油提取工艺优化[J]. 食品与机械, 2009, 25(6)∶ 93-95.
[20]彭密军, 彭胜, 伍钢, 等. 杜仲籽油中α-亚麻酸的甲酯化方法优化[J]. 中国油脂, 2009, 34 (1)∶ 76-79.
[21]王倩, 李孟楼, 郭新荣. 火棘种子油理化指特性研究初报[J]. 陕西林业科技, 1997, 25(4)∶ 5-7.
[22]周先玉, 陈渭萍. 火棘果实中油、色素及果胶的联产工艺研究[J].食品科学, 2004, 25(2)∶ 211-213.
[23]唐克华, 寻勇. 火棘籽油超临界CO2提取及脂肪酸组分测定[J]. 食品科学, 2010, 31(24)∶ 115-119.
Purification of Linoleic Acid and Squalene from Pyracantha fortuneana Seed Oil by Urea Adduction Fractionation
LIANG Xian-chang1,LI Jia-xing1,TIAN Xiang-rong2,HU Ping-ping3,HUANG Shou-en3,HUANG Cheng4,*
(1. Key Laboratory of Hunan Forest Product and Chemical Industry Engineering, Zhangjiajie 427000, China;2. College of Biology and Environmental Sciences, Jishou University, Jishou 416000, China;3. College of Food Science and Engineering, Central South University of Forest and Technology, Changsha 410004, China;4. College of Chemistry and Chemical Engineering, Jishou University, Jishou 416000, China)
In this work, urea adduction fractionation was used to purify linoleic acid from Pyracantha fortuneana seed oil and the purified product was further separated by silica column chromatography to obtain squalene. The effects of adduction time, adduction temperature and oil-urea-ethanol ratio on the purity and recovery rate of linoleic acid were probed by one-factor-ata-time and orthogonal array design methods. The analysis of linoleic acid and squalene was performed by GC-MS. The results showed the optimal adduction parameters were adduction time of 12 h, adduction temperature of -5 ℃, and oil-urea-alcohol ratio of 1∶2∶6 (g/g/mL). Under the optimal adduction conditions, the purity of linoleic acid was increased from 38.40% to 68.55%, and the recovery rate of linoleic acid reached up to 72.23%. After separation by silica column chromatography, a squalene sample with 98.16% purity was obtained .
Pyracantha fortuneana;urea adduction fractionation;linoleic acid;column chromatography;squalene;gas chromatography-mass spectrometry (GC-MS)
TS225
A
1002-6630(2011)16-0127-05
2011-02-19
湖南省高校“林产资源化学与林化产品开发”科技创新团队支持计划项目(湘教通<2010>212号);吉首大学研究生科研创新项目 (JGY201015)
梁先长(1986—),男,硕士研究生,研究方向为林特产品的开发与产业化。E-mail:liangxianchang1@126.com
*通信作者:黄诚(1963—),男,教授,硕士,研究方向为食品化学与营养检测。E-mail:jidahuangcheng@163.com
