异丙酚对胚胎大鼠中脑神经细胞缺氧复氧损伤的影响
2011-03-28张立平
张立平
(溧水县人民医院检验科,江苏 南京 211200)
目前异丙酚的脑保护研究主要以神经元为对象,有关异丙酚对胚胎中脑神经细胞缺氧复氧损伤的影响报道较少。异丙酚是临床十分常用的麻醉镇静药[1,2],有研究显示异丙酚具有一定的脑保护作用[3]。本实验旨在进一步研究异丙酚干预胚胎中脑神经细胞后缺氧复氧损伤神经细胞形态、乳酸脱氢酶、脂质过氧化的影响,进一步说明异丙酚对脑缺血再灌注损伤有保护作用,为异丙酚在临床上的进一步应用提供理论依据。
1 材料与方法
1.1 实验动物 14d胚胎大鼠,体重为250~300g(江苏大学实验动物中心提供)。
1.2 主要试剂和仪器 小牛血清(杭州四季青生物公司);DMEM培养基为(美国Sigma公司);异丙酚由暨南大学生物工程研究所提供(纯度>95%);MTT(武汉博士德生物工程有限公司);乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)试剂盒(南京建成生物工程研究所);CO2培养箱为(Forma Scientific,USA);ELx800 酶标仪 (美国 BIO-TEK公司)。IX70-S8F/SIF-141倒置相差显微镜(Olympus公司,日本);GNL-B3氧量分析仪(上海昶艾电子科技有限公); 95%N2-5%CO2混合气平衡过的单向气流缺氧装置(苏州安创仪器有限公司)。
1.3 胚胎中脑神经细胞的制备 用脱颈椎法处死妊娠14 d孕鼠,在无菌条件下分离出胎鼠中脑,浸入37℃的胎牛血清。 Hanks平衡液(1:1v/v)5~10min,用Hanks液漂洗3次后,用0.25%胰蛋白酶消化10min,加入小牛血清终止消化后经200目钢丝网筛过滤,离心洗去胰蛋白酶。加入DMEM培养液(内含50U/ml的青霉素,50μg/ml的链霉素和15%小牛血清)制备细胞悬液,计数细胞存活率,采用台盼蓝计数活细胞。结果活细胞率为90%,再用含10%小牛血清的DMEM培养基将细胞密度调整至3×105个细胞/ml的细胞,将细胞悬液接种于培养板中,置37℃、5%CO2、95%空气饱和湿度培养箱中培养,细胞培养24h后进行后续试验。
1.4 胚胎中脑神经细胞缺氧损伤模型的建立 取培养24小时的神经细胞,用15%胎牛血清DMEM培养基连续培养,(预先充入95%N2-5%CO2混合气和30min),而后迅速将培养细胞移入同种95%N2-5%CO2混合气平衡过的单向气流缺氧装置,测氧仪监测排气口氧浓度(<1%),于37℃电热恒温培养箱中缺氧6h后进行MTT实验及生化指标的测定。
1.5 实验分组 将胚胎中脑神经细胞分组 正常对照组、缺氧损伤模型组、异丙酚干预组(浓度分别为10、25、50、100μmol/L)。 1.5MTT 法检测神经元细胞存活率 以4×105个细胞/ml的细胞接种于96孔培养板的神经细胞,缺氧损伤模型组及异丙酚干预组缺氧处理24h,正常对照组37℃、5%CO2培养箱同步孵育,每孔加入 MTT溶液(5mg/ml)20μl,37℃继续孵育4h,终止培养,小心吸弃孔内培养液,每孔加入150μl DMSO,振荡 10min,于酶标仪波长 490nm处测吸光度值。每实验组设6个复孔。
1.6 细胞外LDH活性的测定 接种于24孔板的神经元,缺氧损伤模型组及异丙酚干预组缺氧处理24h,正常对照组37℃、5%CO2培养箱同步孵育,取各组细胞培养上清液200μl,用比色法测定LDH的活力,具体检测过程及操作方法参见试剂盒说明书进行。
1.7 细胞内SOD活性、MDA和GSH含量测定 接种于24孔板的神经元,各实验组处理同上,0.25%胰酶消化,血清中止,离心1000r/min,10min,去上清后,每孔加入0.1mol/L TBA-0.05mmol/L EDTA(pH=8.0)1ml,再加入 50μl 1%Triton-X100,将培养板置于震荡器上震荡 1min使细胞溶解,加入100μl 25%HPO3以沉淀蛋白,10000r/min 4℃离心。用黄嘌呤氧化酶法测定SOD活性,用改良二硫双硝基苯甲酸定量法测定GSH活性,按硫代巴比妥酸(Thibabituric acid,TBA)比色法测定MDA含量。用黄嘌呤氧化酶法测定细胞内SOD活性;用硫代巴比妥酸比色法测定细胞内MDA含量,具体检测过程及操作方法参见试剂盒说明书。
1.8 统计学处理 实验结果经SPSS 16.0统计软件分析,对均值进行t检验。
2 结果
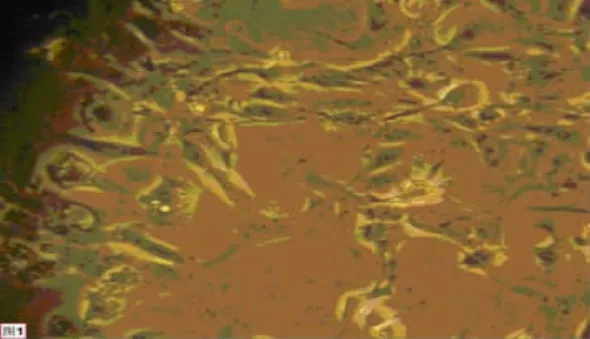
图1 正常对照组神经细胞形态(×200)

图2 缺氧组细胞形态(×200)

图3 异丙酚(40~80μg/L)和缺氧组神经细胞形态(×200)

图4 异丙酚(100μg/L)和缺氧组神经细胞形态(×200)
2.1 异丙酚对大鼠胚胎中脑神经细胞形态观察 由见图1~图4,用倒置显微镜下观察活细胞生长情况,对照组细胞形成团簇,突起增长,并借突起彼此连接形成网络,细胞呈梭形或椎形,核大而圆,有折光性,位于细胞中央,细胞界限清楚。缺氧24h的模型组可见各组神经细胞突起变少或消失,细胞团松散,表现为缺氧损伤状态。缺氧后加异丙酚组神经细胞形态基本正常,异丙酚对胚胎中脑神经细胞具有明显保护作用。缺氧24h后细胞集落及细胞数有明显下降,差异均有统计学意义(P<0.01),异丙酚(40、80、100μg/L)对缺氧胚胎中脑神经细胞逐渐增多,差异均有统计学意义(P<0.05)。
2.2 MTT检测神经元细胞存活率 由表1可见,MTT测定结果,缺氧模型组与正常对照组比较,OD值均有所下降,差异均有统计学意义(P<0.01);异丙酚剂量(20~100μg/L)干预缺氧24h后对神经细胞生存率OD值较模型组均有所增高,差异均有统计学意义 (P<0.05,P<0.01)。
表1 异丙酚对神经细胞培养生存率的影响s,n=5)

表1 异丙酚对神经细胞培养生存率的影响s,n=5)
注:与正常对照组相比(*P<0.05;**P<0.01);与缺氧模型组和异丙酚干预组相比,**P<0.01。
组别 剂量(μg/L) OD值(24h)正常对照组缺氧模型组异丙酚干预组--1 0 20 40 80 100 0.659±0.032 0.4280.053**0.460±0.032 0.491±0.045*0.562±0.024**0.684±0.052**0.596±0.064**
2.3 异丙酚对神经元细胞培养上清液中LDH活力的影响 由表2可见。神经元细胞经缺氧处理后,上清液中的LDH活力增高,与正常对照组相比,差异均有统计学意义 (P<0.01);异丙酚组可以显著降低细胞中LDH活力,差异均有统计学意义(P<0.05,P<0.01)。
表2 异丙酚对神经细胞培养上清液中LDH活力的影响(±s,n=5)

表2 异丙酚对神经细胞培养上清液中LDH活力的影响(±s,n=5)
注: 与正常对照组比较,**P<0.01; 与模型组比较,*P<0.05,**P<0.01。
组别 剂量(μg/L) LDH(U/L)正常对照组缺氧模型组异丙酚干预组--1 0 20 40 80 100 78.52±16.26 241.52±14.21**132.32±16.35 134.24±15.84*148.72±13.34**162.34±17.62**151.54±15.64**
2.4 异丙酚对缺氧损伤神经元细胞内SOD活性、MDA及GSH含量的影响
表3 异丙酚对缺氧损伤神经细胞内SOD活性、MDA和GSH 含量的影响±s,n=5)

表3 异丙酚对缺氧损伤神经细胞内SOD活性、MDA和GSH 含量的影响±s,n=5)
注: 与正常对照组比较,*P<0.05,**P<0.01; 与模型组比较,*P<0.05,**P<0.01; 与正常对照组比较,*P<0.05**P<0.01; 与模型组比较,*P<0.05**P<0.01。
组别 剂量(μg/L)SOD(U/mg prot)MDA(nmol/mg prot)GSH(mg/g ptor)正常对照组缺氧模型异丙酚干预组--1 0 20 40 80 100 87.36±18.35 30.69±11.32**62.54±9.47 60.42±7.42**50.72±5.62**48.35±6.34**42.36±4.33**7.592±0.54 10.52±1.36*4.36±1.25 6.624±1.82*5.941±0.76*6.375±0.92*6.824±0.84*72.72±9.72 92.65±10.53 71.38±9.72 69.37±8.74*52.32±7.54*49.52±6.33*42.64±6.47*
由表3可见。缺氧组与正常对照组比较,细胞内SOD活性显著下降,差异均有统计学意义 (P<0.01),MDA、GSH含量增加,差异均有统计学意义(P<0.05);而异丙酚 40~100μg/L 处理组,与缺氧模型组比较均可减少细胞内SOD活性,差异均有统计学意义(P<0.01),MDA和GSH含量的产生,差异均有统计学意义(P<0.05)。
3 讨论
氧化损伤是引起缺血再灌注损伤的重要机制之一,在大鼠心脏缺血再灌注过程中,异丙酚输注能减少MDA含量和提高SOD活性,并呈剂量依赖性,丙二醛(MDA)是氧化损伤过程中脂质过氧化的产物;超氧化物岐化酶(SOD)能清除氧自由基,其活性反映了机体抗氧化损伤的能力[4],与组织损伤的程度密切相关。异丙酚是一种抗炎剂通常用于全身麻醉、镇静在加护病房的病人[5]。临床上尚未见不良反应,但仍然存在一些不足之处。药物给药途径与剂型方面有待改进,使药物定位准确具有选择性的治疗作用,从而使受损部位能达到有效浓度,当神经细胞因缺血缺氧受到损伤时,线粒体功能异常,氧化呼吸链受损,电子传递阻断,ATP产生减少。琥珀酸脱氢酶是琥珀酸氧化呼吸链里重要的复合酶之一,所以,琥珀酸脱氢酶的活性,可以反映神经细胞缺氧损伤的程度。本实验表明,缺氧损伤模型组比正常对照组吸光度值显著性降低,结果表明细胞内琥珀酸脱氢酶的活性已经降低,细胞呼吸功能受损,说明缺氧24h可以损害神经细胞代谢能力。乳酸脱氢酶(LDH)的测定来评估和量化细胞死亡[6],与缺氧损伤模型组比较,异丙酚各剂量组可以显著提高细胞活性,说明异丙酚能对抗缺氧对神经细胞琥珀酸脱氢酶活性的损害,维持缺氧损伤细胞的呼吸功能。乳酸脱氢酶是参与细胞能量代谢的一个重要的酶。同时产生ATP。缺氧导致细胞急性损伤时,细胞膜完整性遭到破坏,胞通透性增加,LDH将从胞浆中释放出来,在离体神经细胞培养中可以引起细胞活力的下降,活细胞数目的减少,乳酸脱氢酶(LDH)的释放增加因此LDH是反映胞膜完整性的重要检测指标[7]。与缺氧损伤模型组比较,异丙酚各剂量组均可显著减少缺氧条件神经元细胞LDH的外漏量,一定程度上保持了神经元膜的完整性。在神经元缺血缺氧的同时,活性氧爆发性产生,而组织中清除氧自由基的SOD活性却降低了,导致氧自由基堆积,使膜脂质过氧化而致细胞损伤当体内有过量的氧自由基时,就会启动脂质过氧化,产生大量的脂质过氧化物,在导致内源性抗氧化系统的清除能力受损[8]。本实验结果显示,缺氧24h的模型组可见各组神经细胞形态,细胞集落及细胞数有明显下降,突起变少,表现为缺氧损伤状态。异丙酚可以增强了强抗氧化酶心肌细胞内SOD活性,减少脂质过氧化产物MDA的产生。且随异丙酚的剂量增高其抑制效应加强。缺氧后加异丙酚组神经细胞形态基本正常当异丙酚剂量在25、50、100μg/L范围内对缺氧神经细胞逐渐增多作用。说明异丙酚对胚胎中脑神经细胞具有明显保护作用。
综上所述,异丙酚可显著减少缺氧条件神经元LDH的外漏量,一定程度上保持了神经元膜的完整性。另也通过增强神经细胞清除自由基的能力,对抗缺氧导致的细胞膜氧化损伤,对缺氧损伤神经细胞具有明显的保护作用。并通过内在抗氧化机制恢复和增强了抗氧化酶活性,减轻脂质过氧化反应引起的细胞内损伤。
[1]徐康清,袁福利,陈 祯,等.丙泊酚复合氟比洛芬脂或氯诺昔康在无痛人流的应用[J].中山大学学报:医学科学版,2008,29(3s):81-82.
[2]曾维安,欧阳汉栋,李 强,等.术前口服倍他乐克对于麻醉诱导丙泊酚的用量和血流动力学的影响[J].中山大学学报:医学科学版,2007,28(4):458-461.
[3] Oztürk E, Demirbilek S, K oroglu A, et al. Propofol and erythropoietin antioxidant properties in rat brain injured tissue[J].Prog Neuropsychopharmacol Biol Psychiatry,2008,32(1):81-86.
[4]Erturk E,Cekic B,Geze S,et al.Comparison of the effect of propofol and N-acetyl cysteine in preventing ischaemia-reperfusion injury[J].Eur JAnaesthesiol,2009,26(4):279-284.
[5]Lee CJ,Subeq YM,Lee RP,et al.Low-dose propofol ameliorates haemorrhagic shock-induced organ damage in conscious rats[J].Clin Exp Pharmacol Physiol,2008,35(7):766-74.
[6]Lee JY,Shin JW,Lee EH,et al.Comparison of the effects of propofol and pentobarbital on hydrogen peroxide-stimulated hepatic SNU761 cells[J].Korean Anesthesiol,2010,58(3):277-282.
[7]Steen E,Terry BM,Rivera EJ,et al.Impaired insulin and insulinlike growth factor expression and signaling mechanisms in Alzheimer’s disease is this type 3 diabetes[J].Alzheimers Dis,2005,7(1):63-80.
[8]Farkas E,Luiten PG,Bari F.Permanent,bilateral common carotid artery occlusion in the rat: a model for chronic cerebral hypoperfusion-related neurodegenerative diseases[J].Brain Res Rev,2007,54(1):162-180.
