开食料玉米和全脂大豆的加工方式与犊牛瘤胃酶系发育关系的比较研究
2011-03-28张元庆孟庆翔任丽萍贺东昌杨效民
张元庆 孟庆翔 任丽萍 王 芳 贺东昌 杨效民
消化道容积和吸收能力的发育是影响犊牛的消化能力的重要因素,而在发育为真正反刍动物的过程中,需要有瘤胃中微生物区系的建立以及多种消化酶的分泌。犊牛的消化酶包含 2类:一类是犊牛自身的消化酶,分泌来源为唾液腺、真胃、胰腺和小肠等[1];另一类是瘤胃微生物分泌的酶。犊牛瘤胃不具有消化功能之前,对饲粮中的淀粉消化率很低[2-5]。随着犊牛瘤胃的发育以及瘤胃微生物区系的建立,犊牛瘤胃中的酶系也相应建立。瘤胃微生物分泌的酶通常包括纤维素酶、淀粉酶和蛋白酶。Britt等[6]研究证实,犊牛在适应底物过程中,特异性酶活性诱发性的增加了。高碳水化合物饲粮会诱导胰腺释放较多的胰淀粉酶,而高蛋白饲粮诱导释放的胰淀粉酶活性则较低[7]。犊牛对二糖的利用与犊牛肠道中碳水化合物酶活性密切相关[8],二糖酶活性随着犊牛周龄的增加而减低[2,9]。人类增加果糖摄入会增加肠道中的蔗糖酶和麦芽糖酶活性[10-12],鼠增加半乳糖摄入也会刺激其肠道中这种糖的代谢[13]。酶系瘤胃中的建立及其变化规律还未见报道,犊牛开食料消化影响酶活性的研究多集中在小肠和胰腺中,而对瘤胃微生物酶活性的影响也尚未见报道[14]。本文旨在比较研究犊牛周龄及不同处理的开食料玉米和全脂大豆与瘤胃酶系发育关系,为认识犊牛的消化生理以及犊牛对饲料的利用提供理论依据。
1 材料与方法
1.1 动物、畜舍和饲粮
从北京三元绿荷奶牛养殖中心购买 30头(7±3)日龄荷斯坦公犊牛,运送至北京华晨奶牛场进行试验。犊牛在垫有干沙子的犊牛圈(1.5 m×3.0 m)中单栏饲养。
预试期 2周,每天分 3次饲喂占初生重 10%的新鲜牛奶,并饲喂开食料,随开食料采食量的增加逐步减少喂奶量直至完全断奶。犊牛开食料和干草自由采食,自由饮水。
预试期结束后,选取 12头(21±3)日龄犊牛,随机分为 3组,挤压膨化组、蒸汽压片组及对照组(常规粉碎组),分别饲喂采用不同加工方式的玉米和大豆配制成的开食料,所用的玉米和全脂大豆均为同一批次。犊牛每天饲喂新鲜牛奶、干草和开食料。开食料组成及营养成分见表 1。正试期为 3~13周龄,共10周。
1.2 样本采集和测定
在犊牛 4、5、6、7、9、11和 13周龄晨饲前 ,通过瘤胃导管(长度 ×内径 =200 mm×12 mm)采集瘤胃液(约 100 mL),取胃导管中间部分胃液立即装入灭菌的 1.5 mL离心管中,迅速投入液氮罐中,随后转移到 -80℃超低温冰箱中保存,以备各种酶活性检测。
内切葡聚糖酶、β-葡萄糖苷酶、微晶纤维素酶、纤维素酶和木聚糖酶活性的测定参照王加启[15]的方法,酶活性定义为酶液中每微克蛋白质每分钟与底物作用生成的葡萄糖量[μmol/(min◦ μg prot)];淀粉酶活性测定参照Level[16]的方法;α-D-葡萄糖苷酶活性根据Pierre等[17]的方法测定,酶活性定义为酶液中每微克蛋白质每分钟与底物作用生成的对硝基苯酚 (p-NP)量 [μmol/(min◦ μg prot)];蛋白酶活性测定方法参照国标(SB/T 10311—1999)。
1.3 数据分析
数据测定采用完全随机化试验设计,并用SAS(1999)中的 MIXED重复模型进行分析。模型为:

式中:Yijk为应变量,μ为整体平均数,Ti为处理 i的影响,C(i)j表示处理 i中犊牛 j的影响,Pk表示时间 k的影响,(TP)ik表示时间与处理的互作项,e(ijk)表示残差。C(i)j项作为检验处理间差异的误差项,置信区间均为 95%。
2 结 果
2.1 3种开食料与犊牛瘤胃中纤维素酶活性随周龄变化的关系
由图 1和统计结果可知,饲喂 3种开食料的犊牛瘤胃中的内切葡聚糖酶活性均随犊牛周龄增长呈增加趋势,但开食料、犊牛周龄及二者互作对其无显著影响(P>0.05)。蒸汽压片组犊牛瘤胃中的内切葡聚糖酶随周龄基本呈线性增加;而挤压膨化组犊牛则呈现出前期增加较快但后期增加缓慢的趋势,且在犊牛 13周龄时蒸汽压片组犊牛瘤胃中的活性较高;对照组犊牛瘤胃中的内切葡聚糖酶活性则呈现不规则波动变化。

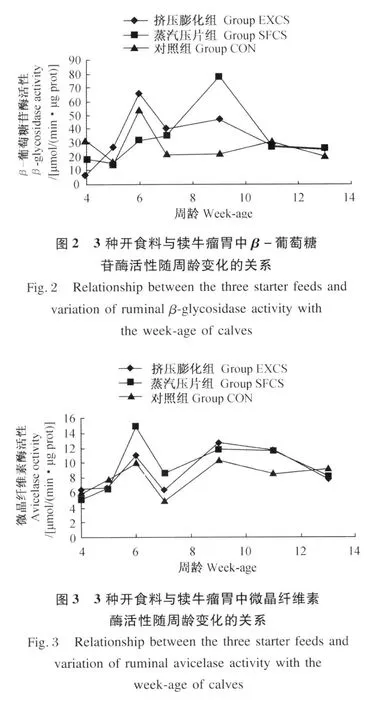
由图 2和统计结果可知,3组犊牛瘤胃中的β-葡萄糖苷酶随犊牛周龄的变化均没有规律,但开食料和犊牛周龄对其有显著影响(P<0.05)。挤压膨化组和对照组犊牛的 β-葡萄糖苷酶在 4~6周龄迅速升高,7周龄开始下降,7周龄以后为平台期。整个试验期蒸汽压片组的 β-葡萄糖苷酶活性普遍高于对照组。
从图 3中知,3种开食料饲喂的犊牛瘤胃中微晶纤维素酶活性的建立曲线趋势基本相同。统计结果显示,该酶活性受犊牛周龄影响显著(P<0.05),但受开食料及二者互作影响不显著(P>0.05)。然而,数值显示,在 6和 7周龄时,蒸汽压片组犊牛瘤胃中微晶纤维素酶活性相对较高(P>0.05);而对照组犊牛瘤胃中微晶纤维素酶活性在6~12周龄低于其他 2组(P>0.05)。

表1 开食料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the starter feeds(DM basis) %
由图 4可知,除对照组犊牛9周龄时出现较高活性外,3组犊牛瘤胃中纤维素酶活性的变化趋势均呈现先升高随后逐步降低并稳定的趋势,统计结果表明其受开食料、犊牛周龄以及二者互作影响显著(P<0.05)。
由图 5及统计结果可知,木聚糖酶的增长趋势与内切葡聚糖酶相似,受犊牛周龄影响显著(P<0.05),但受开食料以及二者互作的影响均不显著(P>0.05)。然而,与 β-葡萄糖苷酶和微晶纤维素酶活性变化相似,3组犊牛瘤胃中的木聚糖酶活性也出现了在 7周龄开始降低,随后上升的一个波动。在 4、5、6及 9周龄时,对照组犊牛瘤胃中的木聚糖酶活性相对较高,但在统计上与其他 2组无显著性差异(P>0.05)。蒸汽压片组犊牛瘤胃中的木聚糖酶活性在 11周龄呈现较高状态,并最终保持稳定。

2.2 3种开食料与犊牛瘤胃中淀粉酶活性随周龄变化的关系
由图 6可知,在犊牛4~7周龄,各组犊牛瘤胃中的淀粉酶活性均随犊牛周龄增长呈现线性增长,但是在 7周龄以及以后,除蒸汽压片组犊牛的淀粉酶活性继续上升外,其他 2组则出现了下降趋势;9周龄时蒸汽压片组犊牛瘤胃中的淀粉酶活性最高,之后呈现稳定状态;而挤压膨化组犊牛瘤胃中的淀粉酶则在 9周龄后快速上升,到 11周龄时达到最高,继而又下降。对照组在 9周龄后基本呈现稳定趋势。各组犊牛在 13周龄时瘤胃中的淀粉酶活性相同。统计结果显示,该酶活性受开食料、犊牛周龄以及二者互作的影响差异均不显著(P>0.05)。
由图 7可知,开食料对 α-D-葡萄糖苷酶在犊牛中的建立有一定影响。对照组犊牛瘤胃中的α-D-葡萄糖苷酶在试验初期(4周龄)就有较高的活性,而随着犊牛周龄的增长,其酶活性呈现缓慢下降,直到第 11周龄后呈现上升趋势,在 13周龄时达到与其他处理组相同的酶活性水平。而蒸汽压片处理组和挤压膨化组则从最初的较低水平随犊牛周龄的增长呈现持续增加趋势,而在断奶期间则出现平台(7和 9周龄)。统计结果显示,该酶活性受开食料处理、犊牛周龄以及二者互作的影响差异均不显著(P>0.05)。

2.3 3种开食料与犊牛瘤胃中蛋白酶活性随周龄变化的关系
由图 8和统计结果可知,开食料、犊牛周龄以及二者互作对瘤胃中蛋白酶活性有显著影响(P<0.05);挤压膨化组和蒸汽压片组开食料对犊牛瘤胃中蛋白酶活性的建立呈一致性影响,都呈现随犊牛周龄的增加逐步增加趋势,但是挤压膨化组犊牛在 11和 13周龄的蛋白酶活性明显高于其他2组;对照组犊牛其瘤胃中的蛋白酶活性在 4周龄显著高于其他 2组提高,而随犊牛周龄的增加,其酶活性先下降而后保持在一个相对稳定的水平,直到 11和 13周龄略有增加,最终与蒸汽压片组犊牛瘤胃中的蛋白酶呈现同一水平。

3 讨 论
3.1 3种开食料与犊牛瘤胃中纤维素酶活性随周龄变化的关系
瘤胃黏膜不能分泌任何酶,瘤胃中的酶是由微生物分泌的,因而瘤胃中的酶活性大小以及种类与微生物的数量和种类有关。因此,本试验中的酶活性在一定程度下反应了瘤胃中的微生物区系变化。
3组犊牛瘤胃中的内切葡聚糖酶活性均随犊牛周龄的增长呈增加趋势,而蒸汽压片组犊牛瘤胃中的内切葡聚糖酶活性随周龄增加趋势稳定性明显高于其他 2组。由于内切葡聚糖酶的活性能够反应瘤胃中微生物区系的建立情况,玉米和全脂大豆经蒸汽压片处理后配制成的开食料饲喂犊牛,其瘤胃中内切葡聚糖酶随周龄的稳定增加,在一定程度上反映出对犊牛瘤胃中的纤维素降解微生物的建立的促进作用。
3组犊牛瘤胃中的 β-葡萄糖苷酶随犊牛周龄的变化均没有规律。尽管对照组开食料的采食量在 3种处理间最高[18],但是酶活性结果中没有见到底物诱导的优势。这一结果与 Britt等[6]提出的犊牛对底物的适应会诱发特异性酶活性的增加这一观点不符。这可能是由于采用瘤胃导管方法采集瘤胃液造成的误差较大所致;另外,微生物分泌的酶种类繁多,且有胞内酶和胞外酶之分,而本试验中只对瘤胃液中的胞外酶进行了活性测定。蒸汽压片组犊牛瘤胃中的 β-葡萄糖苷酶在 4~7周龄呈现缓慢稳定增长,这可能与饲喂蒸汽压片组开食料的犊牛采食量相对较低有关。
3组犊牛瘤胃中的微晶纤维素酶活性与内切葡聚糖酶、β-葡萄糖苷酶结果相似,且在 7周龄开始均出现了降低趋势,可能由于 7周龄为犊牛逐步断奶的时期,断奶对犊牛产生的应激可能是导致出现这一波动的主要原因。另外,在纤维素的降解过程中,内切葡聚糖酶首先以随机方式内切纤维素聚合体并产生纤维糊精、纤维二糖及葡萄糖,而外切葡聚糖酶(微晶纤维素酶)则以催化短链的还原性末端纤维二糖残基而将其逐个切下,β-葡萄糖苷酶可水解纤维二糖、芳基 -葡萄糖苷酸而产生葡萄糖等。因此,这 3种酶在纤维降解过程中具有一定的关系,在酶活的建立过程中可能会有底物诱导的因素[6]。
3组犊牛瘤胃中纤维素酶活性的变化趋势基本呈现先升高随后逐步降低并呈现稳定,该现象说明,犊牛瘤胃中的微生物区系在前期逐渐建立的情况下会出现逐步增加趋势,而后随着犊牛日龄的增长,瘤胃中的微生物区系逐步呈现稳定。与 β-葡萄糖苷酶、微晶纤维素酶和纤维素酶相似,在 7周龄前以及 9周龄时,对照组犊牛瘤胃中的木聚糖酶活性相对较高,可能是由于对照组犊牛的开食料采食量较高,底物诱导作用相对较大。
3.2 3种开食料与犊牛瘤胃中淀粉酶活性随周龄变化的关系
犊牛瘤胃中的淀粉酶活性结果表明,开食料中原料的不同加工方式及犊牛周龄对瘤胃中淀粉酶活性的建立基本没有影响。开食料中玉米和全脂大豆的不同加工方式对 α-D-葡萄糖苷酶在犊牛中的建立影响不同,且 3种犊牛开食料的采食量以及开食料中淀粉在瘤胃中的消化率受加工方式影响,这一现象说明 α-D-葡萄糖苷酶活的建立过程中可能会有底物诱导的因素[6]。
3.3 3种开食料与犊牛瘤胃中蛋白酶随犊牛周龄增长的关系
与纤维素酶和淀粉酶活性结果一样,蛋白酶活性的变化结果受开食料处理和犊牛周龄变化以及二者的互作影响,且在最后都处于一个相对稳定的状态,可能与这些开食料处理和犊牛周龄对犊牛瘤胃中微生物区系的影响以及犊牛瘤胃微生物区系的逐步健全有关。
4 结 论
①犊牛瘤胃中的纤维素酶、淀粉酶和蛋白酶系均受犊牛周龄和犊牛开食料中玉米和全脂大豆加工方式的互作影响,变化规律各不一致。
②开食料中玉米和全脂大豆的蒸汽压片处理有助于犊牛瘤胃中内切葡聚糖酶的建立,有助于增加瘤胃中 β-葡萄糖苷酶活性。
[1] SISSONSJ W.Digestive enzymes of cattle[J].Journal of the Science of Food and Agriculture,1981,32:105-114.
[2] DOLLAR A M,PORTER J W G.Utilization of carbohydrate by the young calf[J].Nature,1957,179:1299.
[3] HUBER J T,JACOBSON N L,MCGILLIARD A D,et al.Utilization of carbohydrates introduced directly into the omaso-abomasal area of the stomach of cattle of various ages[J].Journal of Dairy Science,1961,44:321-330.
[4] HUBER JT,NATRAJAN S,POLAN C E.Adaptation to starch in steers fed by nipple pail[J].Journal of Dairy Science,1967,50:1161.
[5] HUBER JT,NATRAJAN S,POLAN C E.Varying levels of starch in calf milk replacers[J].Journal of Dairy Science,1968,51:1081.
[6] BRITT D G,HUBER J T.Effect of adding sugars to a carbohydrate-free diet on intestinal disaccharidas activities in the young calf[J].Journal of Dairy Science,1972,57(4):420-426.
[7] HUEROU-LURON I L,GUILLOTEAU P,WICKER-PLANQUART C,et al.Gastric and pancreatic enzyme activities and their relationship with some gut regulatory peptides during postnatal development and weaning in calves[J].The Journal of Nutrition,1992,122(7):1434-1445.
[8] DEREN J T,BROITMAN S A,ZAMCHECK N.Effect of diet upon intestinal disaccharidases and disaccharide absorption[J].The Journal of Clinical Investigation,1967,46:186.
[9] SIDDONS R C.Carbohydrase activities in the bovine digestive tract[J].Biochemical Journal,1968,108:839.
[10] ROSENSWEIG N S,HERMAN R H.The control of jejunal sucrase and maltase activity by dietary sucrose or fructose.A model for the study of enzyme regulation in man[J].Clinical Research,1967,15:419.
[11] ROSENSWEIG N S,HERMAN R H.Control of jejunal sucrase and maltase activity by dietary sucrose or fructose in man[J].The Journal of Clinical Investigation,1968a,47:2253.
[12] ROSENSWEIG N S,STIFEL F B,HERMAN R H,et al.The dietary regulation of the glycolytic enzymes.Ⅱ.Adaptive changes in human jejunum[J].Biochimica et Biophysica Acta,1968b,170:228.
[13] STIFEL F B,HERMAN R H,ROSENSWEIG N S.Dietary regulation of galactosemetabolizing enzymes:adaptive changes in jejunum[J].Science,1968,162:692.
[14] NATRAJAN S,POLAN C E,CHANDLER P T,et al.Ruminal and postruminal utilization of starch in the young bovine[J].Journal of Dairy Science,1971,55(2):238-244.
[15] 王加启.饲料分析与检测[M].北京:中国计量出版社,2004.
[16] LEVER M.Carbohydrate determination with 4-hydroxybenzoic acid hydrazide(PAHβAH):effect of bismuth on the reaction[J].Analytical Biochemistry,1977,81:21-27.
[17] PIERRE C,ROLAND R,TREMBLAY D.P-nitrophenol-α-glucopyramoside as substrate for measurement of maltase activity in human semen[J].Journal of Clinical Chemistry,1978,24(2):208-211.
[18] ZHANG Y Q,HE D CH,MENG Q X.Effect of a mixture of steam flaked corn and soybeans on calf health,growth and selected blood metabolism of Holstein calves[J].Journal of Dairy Science,2010,93:2271-2279.
