饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响
2011-03-28沈文英李卫芬陈南南周绪霞
沈文英 李卫芬 梁 权 邓 斌 陈南南 周绪霞
我国水产养殖的集约化发展导致水环境日益恶化,病害频繁发生,直接影响养殖动物的生长发育,甚至导致养殖动物的大量死亡。益生菌因其安全性好且具有促进动物生长和改善水质等功能而被广泛应用于水产养殖业中[1]。研究表明,益生菌的促生长机理主要与改善水体水质、调节肠道菌群平衡、提高机体免疫和抗氧化功能有关[2-5]。益生菌作为饲料添加剂可以促进鱼类免疫器官的成熟[6]、刺激呼吸爆发活性[7]、提高免疫和抗氧化能力[8-10],从而提高其抗病力和促进生长。研究表明,益生菌芽孢杆菌能提高鲫鱼[11]、南美白对虾[1-2,10]的消化酶活力和免疫能力。而有关枯草芽孢杆菌(Bacillus subtilis)对鱼类免疫和抗氧化功能的研究较少。因此,本试验拟在草鱼(Ctenopharyngodon idellus)饲料中添加枯草芽孢杆菌,探讨其对草鱼生长性能、免疫和抗氧化功能的影响,为枯草芽孢杆菌在草鱼养殖中的应用提供理论依据。
1 材料与方法
1.1 试验饲料
试验用枯草芽孢杆菌制剂由本实验室制备,枯草芽孢杆菌含量为 1×108CFU/g。根据草鱼配合饲料营养标准(SC/T 1024—1997)配制基础饲料,基础饲料组成及营养水平见表 1。根据预试验并结合参考文献[10],在基础饲料中添加 1‰枯草芽孢杆菌制剂,使得试验饲料中枯草芽孢杆菌含量达到 1×105CFU/g。
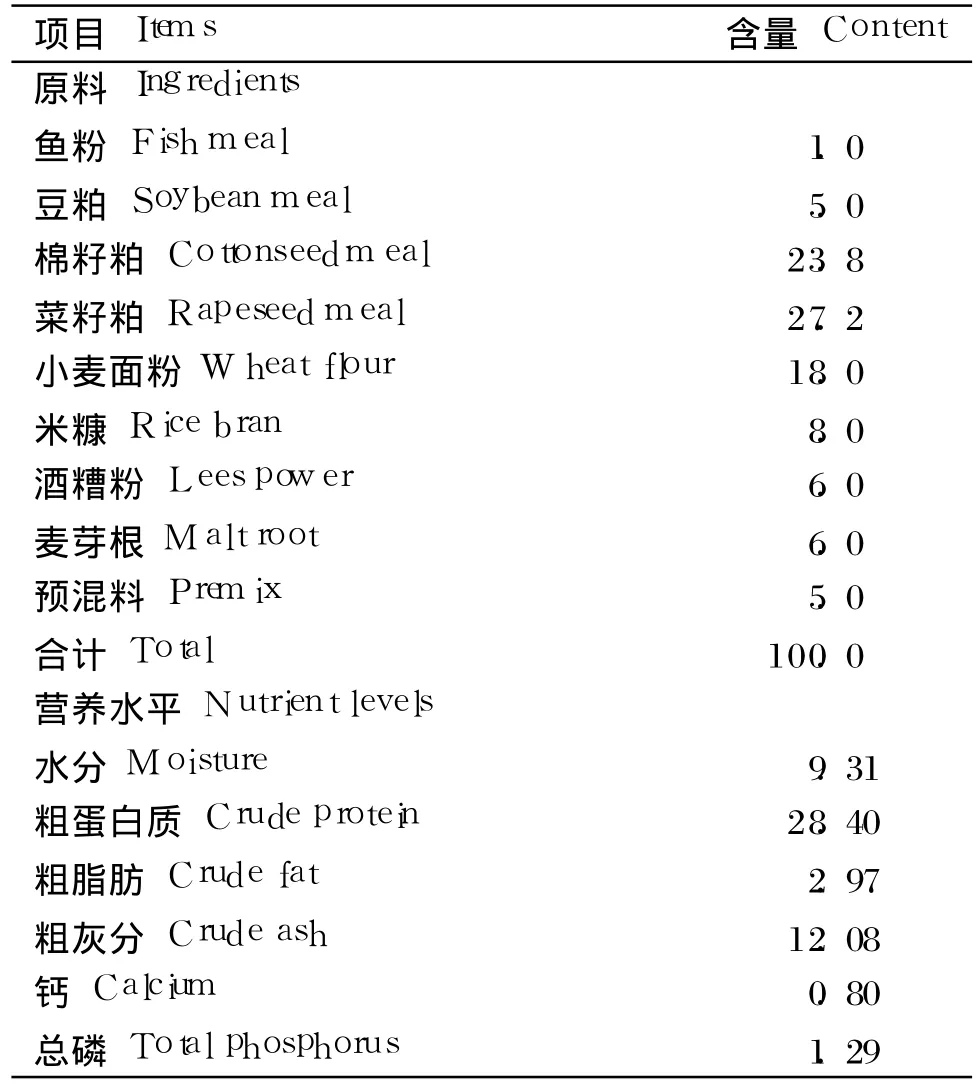
表1 基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.2 试验设计与饲养管理
试验用草鱼由浙江省绍兴市淡水养殖场提供,在试验前先驯养 1周,然后选取体重(51.0±2.3)g的健康无病草鱼 300尾,随机分成 2组(对照组和试验组),每组 3个重复,每个重复 50尾鱼。对照组饲喂基础饲料,试验组饲喂试验饲料(含枯草芽孢杆菌 1×105CFU/g)。按草鱼体重3%的日投饵量饲喂,每天分 3次(08:00、12:00和19:00)投饵,试验期为 45 d。试验在室内过滤式循环水系统中进行,试验鱼以重复为单位饲养于圆形水族箱(体积为 2.75 m3,实际水体积为1.33 m3)内,试验用水为充分曝气的水库水,每周换水 1/3。试验期间水温为 18~25℃,用ACO-318型空气压缩机 24 h增氧。
1.3 样品采集
饲养试验结束后,停饲 24 h,从每个重复随机抽取 10尾鱼,以 0.2 g/L的 3-氨基苯甲酸乙酯甲基磺酸盐麻醉后取样。
血清样品:通过尾椎静脉采血,将血样在 4℃冰箱中静置 24 h后,4℃4 000 r/min离心15 min,取上清液于 1.5 mL Eppendorf管中,立即保存于-80℃冰箱中备用。
肝胰脏样品:将每尾鱼的肝胰脏装于密封样品袋中,立即用液氮快速冷冻,然后转至 -80℃冰箱中保存。准确称取 0.5 g草鱼肝胰脏样品于灭菌的 10 mL离心管中,加 4.5 mL预冷灭菌的生理盐水,然后用自动匀浆器于冰上匀浆,得 10%组织匀浆液。将 10%组织匀浆液于 4℃ 4 000 r/min离心 20 min,取上清液于 1.5 mL Eppendorf管中,立即保存于 -80℃冰箱中备用。
1.4 指标测定与方法
1.4.1 生长性能
在养殖试验开始和结束时分别对草鱼进行称重,计算增重率(WGR)和特定生长率(SGR),公式如下:
WGR(%)=100×(终末体重 -初始体重)/初始体重;
SGR(%/d)=100×(ln终末体重 -ln初始体重)/试验天数。
1.4.2 血清免疫指标
血清总蛋白和白蛋白含量分别采用考马斯亮蓝 G-250染料法和溴甲酚绿法测定,球蛋白含量即为总蛋白含量减去白蛋白含量。血清溶菌酶(LZM)活性采用比浊法测定,髓过氧化物酶(MPO)活性采用比色法测定,碱性磷酸酶(AKP)活性采用磷酸苯二钠法测定,谷草转氨酶(GOT)和谷丙转氨酶(GPT)活性均采用赖氏法测定。血清补体 3(C3)和免疫球蛋白 M(IgM)含量分别采用速率散射浊度法和免疫透射比浊法测定。血清总蛋白、白蛋白含量以及 LZM、MPO、AKP、GOT和 GPT活性的测定所用试剂盒均购自南京建成生物工程研究所,而血清 C3和 IgM含量的测定所用试剂盒购自宁波慈城生化试剂厂。
1.4.3 血清和肝胰脏抗氧化指标
血清和肝胰脏中超氧化物歧化酶(SOD)活性采用邻苯三酚自氧化法测定,过氧化氢酶(CAT)活性采用紫外吸收法测定,谷胱甘肽过氧化物酶(GSH-Px)活性和还原型谷胱甘肽(GSH)含量均采用 5,5-二巯基双 -2-硝基苯甲酸(DTNB)法测定,抗超氧阴离子自由基(O-2◦)活性采用邻苯三酚自氧化法测定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定,总抗氧化能力(T-AOC)采用比色法测定。血清和肝胰脏中 SOD、CAT、GSH-Px、抗 O-2◦活性,GSH、MDA含量以及 TAOC的测定所用试剂盒均购自南京建成生物工程研究所。
1.5 数据统计与分析
利用 Excel对数据进行处理,数据均以平均值 ±标准差表示。采用 SPSS 16.0统计软件对数据进行配对 t检验分析,P<0.05表示存在显著差异。
2 结 果
2.1 饲料中添加芽孢杆菌对草鱼生长性能的影响
由表 2可见,与对照组相比,试验组草鱼的WGR提高了 21.78%,SGR提高了 16.67%,差异达到显著水平(P<0.05)。

表2 饲料中添加枯草芽孢杆菌对草鱼生长性能的影响Table 2 Effects of dietary Bacillus subtilis on growth performance of grass carp
2.2 饲料中添加枯草芽孢杆菌对草鱼免疫功能的影响
由表 3可知,与对照组相比,试验组草鱼血清中 IgM、C3含量和 AKP活性显著升高(P<0.05),而 MPO和 GPT活性则显著降低 (P<0.05)。饲料中添加枯草芽孢杆菌对草鱼血清中总蛋白、白蛋白、球蛋白含量,白球比以及 LZM和GOT活性无显著影响(P>0.05)。
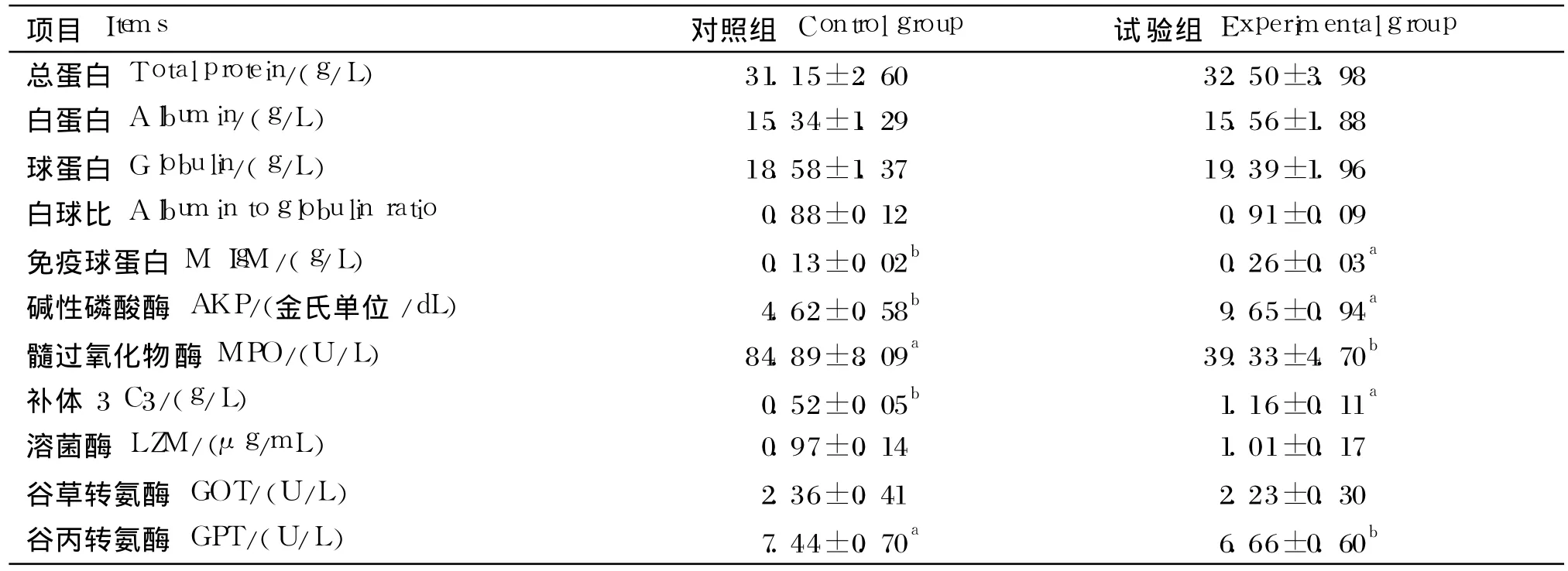
表3 饲料中添加枯草芽孢杆菌对草鱼血清免疫指标的影响Table 3 Effects of dietary Bacillus subtilis on serum immune indices of grass carp
2.3 饲料中添加枯草芽孢杆菌对草鱼抗氧化功能的影响
由表 4可知,与对照组相比,试验组草鱼血清和肝胰脏中 T-AOC以及 CAT、SOD活性和肝胰脏GSH含量显著升高(P<0.05),血清 T-AOC以及CAT、SOD活性分别提高了 18.31%、44.23%和11.01%,肝胰脏 T-AOC,CAT、SOD活性和 GSH含量分别提高了 37.60%、52.00%、39.05%和51.39%;血清和肝胰脏中抗 O-2◦活性和 MDA含量均显著降低(P<0.05),抗 O-2◦活性分别降低了 21.73%和 25.97%,MDA含量分别降低了48.62%和 12.62%。饲料中添加枯草芽孢杆菌对草鱼血清和肝胰脏中 GSH-Px活性以及血清中GSH含量无显著影响(P>0.05)。
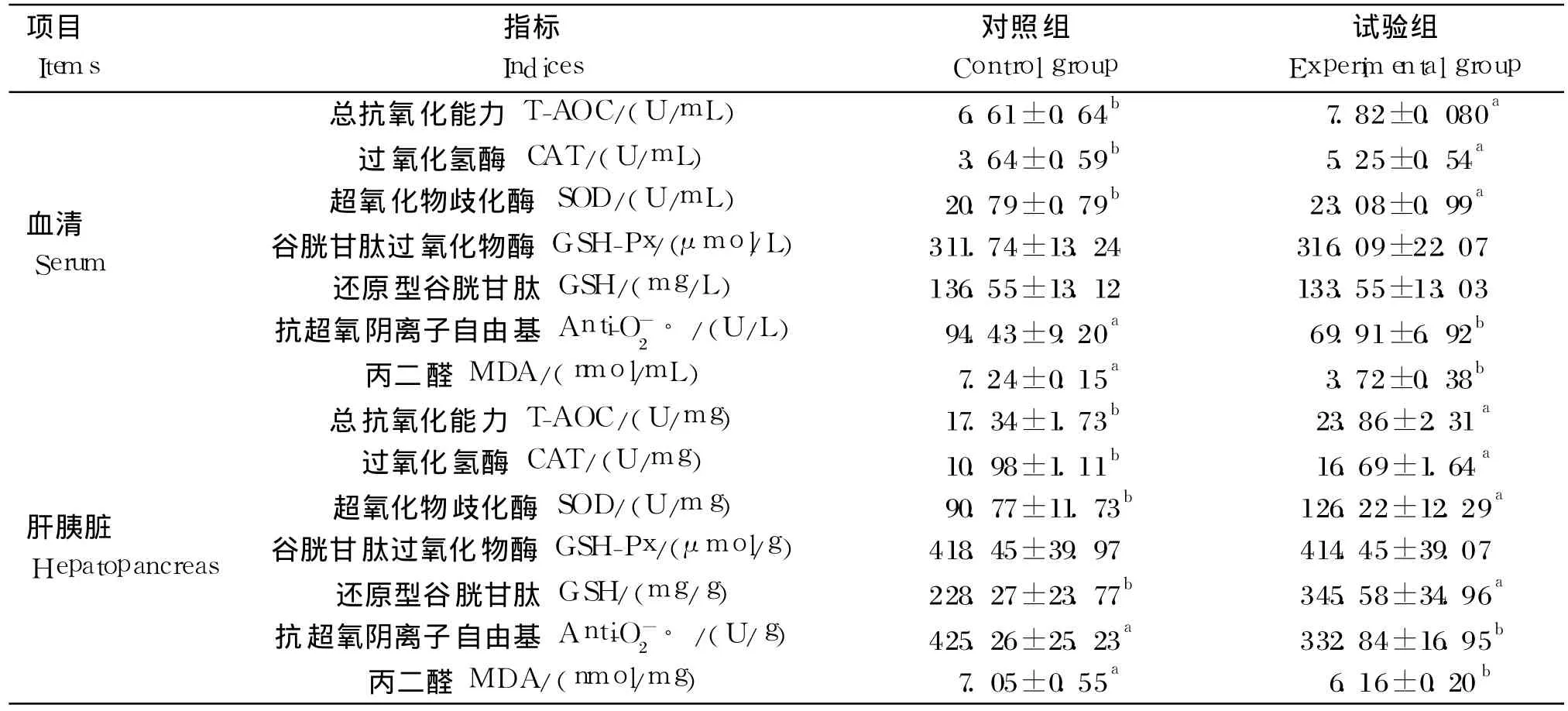
表4 饲料中添加枯草芽孢杆菌对草鱼血清和肝胰脏抗氧化指标的影响Table 4 Effects of dietary Bacillus subtilis on antioxidant indices in serum and hepatopancreas of grass carp
3 讨 论
益生菌在水产养殖中应用的研究主要集中于改善水质和促进水产动物生长方面[2-5],而对水产动物自身免疫和抗氧化功能影响的报道较少。研究表明,枯草芽孢杆菌投喂鲤鱼能显著提高鲤鱼的巨噬细胞呼吸爆发活力和抗嗜水气单胞菌的能力,促进鲤鱼免疫器官的成熟[6]。枯草芽孢杆菌和乳酸菌单独或复合投喂能提高金头海鲷(Sparus aurata)非特异性免疫力[8]。鼠李糖乳杆菌(Lactobacillus rhamnosus)可刺激虹鳟鱼(Oncorhynchus mykiss)巨噬细胞的呼吸爆发活力[7]。本试验结果显示,饲料中添加枯草芽孢杆菌能显著提高草鱼的 WGR和 SGR,提高草鱼血清中 IgM、C3含量和AKP活性。这说明饲料中添加枯草芽孢杆菌可以提高草鱼部分特异性和非特异免疫功能。饲料中添加芽孢杆菌等益生菌增强动物机体免疫功能的机理可能是通过改善水生动物肠道微生态环境和通过自身分泌免疫激活剂来实现的[12-15],芽孢杆菌通过口服作用于肠道集合淋巴结的抗原结合位点或通过调整动物的微生物群间接地发挥免疫赋活的作用,提高机体的局部或整体防御功能,进而起到防病、抗病的作用[16]。此外,本试验还检测了草鱼血清 GPT和 GOT活性,发现试验组草鱼血清GPT和 GOT活性均低于对照组,这与朱学芝等[17]在凡纳滨对虾上得到的结果一致,表明枯草芽孢杆菌对草鱼的肝胰脏功能无损伤。
本试验结果显示,饲料中添加枯草芽孢杆菌可通过提高血清和肝胰脏中的相关抗氧化物的活性或含量来增强草鱼血清和肝胰脏的抗氧化功能,具体表现为草鱼血清中 T-AOC,CAT、SOD活性和肝胰脏中 T-AOC,CAT、SOD活性和 GSH含量显著提高,血清和肝胰脏中抗 O-2◦活性和MDA含量显著降低。这与前人得出的地衣芽孢杆菌提高三角帆蚌[9]和枯草芽孢杆菌提高凡纳滨对虾[10]抗氧化功能的结果一致。研究表明,芽孢杆菌和乳酸菌均具有清除机体羟自由基、CAT以及抗脂质过氧化的能力[9-10,18]。大多数乳酸菌通过提高 SOD活性和 GSH含量来抵抗机体的氧化[19-20],而枯草芽孢杆菌随饲料进入鱼体后也可能通过自身分泌抗氧化酶或者作为激活剂促进机体抗氧化酶分泌,从而有效清除自由基,阻止脂质过氧化。因此在饲料中添加适量枯草芽孢杆菌可以提高草鱼的免疫和抗氧化功能,减轻自由基对机体的损伤,减少草鱼养殖过程中的病害发生。这也是枯草芽孢杆菌作为饲料添加剂促进草鱼生长的原因之一。
4 结 论
①饲料中添加枯草芽孢杆菌可促进草鱼的生长。
②饲料中添加枯草芽孢杆菌可提高草鱼的部分特异性和非特异免疫功能,且对其肝胰脏功能无不良影响。
③饲料中添加枯草芽孢杆菌可提高草鱼的抗氧化功能,进而减轻自由基对机体的损伤。
[1] GATESOUPE F J.The use of probiotics in aquaculture[J].Aquaculture,1999,180:147-165.
[2] THOMPSON F L,ABREU P C,CAVALLI R.The use of microorganisms as food source for Penaeus vannamei larvae[J].Aquaculture,1999,174:139-153.
[3] VERSCHUERE L,ROMBAUT G,SORGELOOS P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Mocrobiology and Molecular Biology Reviews,2000,64:655-671.
[4] 王梦亮.光合细菌对鲤鱼养殖水体生态系统的影响[J].水生生物学报,2001,25(1):98-101.
[5] 沈锦玉,尹文林,刘问,等.光合细菌 HZPSB对水产养殖水质的改良和对鱼类促生长作用[J].科技通报,2004,20(6):481-484.
[6] 刘克琳,何明清.益生菌对鲤鱼免疫功能影响的研究[J].饲料工业,2000,21(6):24-25.
[7] NIKOSKELAINEN S,OUWEHAN A,SALMINEN S,et al.Protection of rainbow trout(Oncorhynchus mykiss)from furunculosis by Lactobacillus rhamnosus[J].Aquaculture,2001,198:229-236.
[8] SALINAS I,CUESTA A,ESTEBAN M A,et al.Dietary administration of Lactobacillus delbrüeckii and Bacillus subtilis,singleor combined,on gilthead seabream cellular innate immune responses[J].Fish&Shellfish Immunology,2005,19(1):67-77.
[9] 沈文英,余东游,李卫芬,等.地衣芽孢杆菌对三角帆蚌消化酶活性、免疫指标和抗氧化指标的影响[J].动物营养学报,2009,21(1):95-100.
[10] SHEN W Y,FU L L,LI W F,et al.Effects of dietary supplementation with Bacillus subtilis on growth perfermance,immuneresponse and antioxidant activities of the shrimp(Litopenaeus vannamei)[J].Aquaculture Research,2010,41:1691-1698.
[11] 刘波,刘文斌,王恬.地衣芽孢杆菌对异育银鲫消化机能和生长的影响[J].南京农业大学学报,2005,28(4):80-84.
[12] 胡毅,谭北平,麦康森,等.饲料中益生茵对凡纳滨对虾生长、肠道茵群及部分免疫指标的影响[J].2008,15(2):244-251.
[13] 李长慧.光合细菌的营养价值及在养殖业中的应用[J].青海大学学报:自然科学版,2001,19(2):34-35.
[14] 邢芳芳,孔祥峰,印遇龙,等.微生态制剂对水产养殖动物的作用机理及科学应用[J].中国饲料添加剂,2007,9:38-42.
[15] 周利梅.微生态制剂在饲料中的应用[J].粮食与饲料工业,2000,11:29-31.
[16] 潘康成,杨汉博.饲用芽孢菌作用机理的研究进展[J].饲料工业,1997,18(9):32-34.
[17] 朱学芝,郑石轩,潘庆军,等.芽孢杆菌对凡纳滨对虾免疫和生化指标的影响[J].饲料研究,2007,4:56-59.
[18] ITO M,OHISHI K,YOSHIDA Y.Antioxidative effects of lactic acid bacteria on the colonic mucosa of iron-overloaded mice[J].Agriculture Food Chemistry,2003,51(15):4456-4460.
[19] 孟凡伦,马桂荣,孔健.益生素制剂在中国对虾养殖中的应用研究[J].山东大学学报:自然科学版,1998,33(1):101-105.
[20] AL-DOHAIL M A,HASHIM R,ALIYU-PAIKO M.Effects of the probiotic,Lactobacillus acidophilus,on the growth performance,haematology parameters and immunoglobulin concentration in African catfish(Clarias gariepinus,Burchell 1822)fingerling[J].Aquaculture Research,2009,40:1642-1652.
