不同防褐化措施对苏丹草愈伤诱导以及抗褐化的效果研究
2011-03-27吕宗友苏衍菁赵国琦邬彩霞
吕宗友,苏衍菁,赵国琦,邬彩霞
(扬州大学动物科学与技术学院,江苏 扬州225009)
苏丹草(Sorghum sudanense)为高粱属牧草,原产于非洲北部苏丹地区,主要以收获营养体为主[1]。苏丹草具有产量高、耐刈割、再生性能强、营养价值丰富、适口性好以及耐贫瘠、抗逆能力强、适应范围广等优点,在世界各地均有栽培,是中国南方主要栽培的牧草之一。但苏丹草易患病虫害,且消化率较低。通过转基因技术能够提高苏丹草的抗病性,也能改良苏丹草的品质,提高利用率,获得优质高产的苏丹草,缓解南方粗饲料短缺的现状,推动奶牛养殖业发展。
组织培养技术是转基因技术的基础,苏丹草和所有高粱属植物一样,在组织培养过程中易褐化,褐化产生的酚类物质影响愈伤的生长,严重时导致愈伤死亡。褐化包括酶促褐化和非酶促褐化,褐化主要是由酶引起的,过氧化物酶(POD)和多酚氧化酶(PPO)在褐化过程中起主要作用[2]。酶促褐化必须具有酶、底物和氧3个条件。褐化的发生是由于组织中多酚氧化酶被激活,酚类物质化合物被氧化形成褐色的醌类物质。引起褐化的酶的底物主要是酚类化合物。
在组织培养防止褐化的研究中,抗褐化剂主要有活性炭(active carbon,AC)、维生素C(VC)、硝酸银(Ag-NO3)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)及柠檬酸(citric acid)等。此外,培养基中糖浓度与次生代谢产物的分泌量有一定的关系[3]。目前,尚未有苏丹草愈伤褐化防止的研究报道。本试验拟探讨不同防褐化措施对苏丹草褐化的防止及对其愈伤诱导的影响,为开展苏丹草转基因研究提供依据。
1 材料与方法
1.1 材料
以从日本引进的苏丹草恢复系2098幼穗为外植体,该材料由南京农业科学院钟小仙老师惠赠。
1.2 方法
1.2.1 外植体的准备 采取大小均匀的苏丹草幼穗在4℃冷藏24 h,用含75%(v/v)酒精棉擦拭幼穗苞壳表面,在无菌的环境下小心剥离出幼穗,剪成3~4cm小段,先用75%的酒精表面灭菌30 s,再用0.1%(w/v)的升汞灭菌15 min,同时加入1~2滴的吐温(tween),最后用无菌水清洗4~5次[4-6]。
1.2.2 培养基的配制及外植体的接种 以MS培养基[7]为基本培养基,培养基的pH调至5.8,在121℃、104 kPa下灭菌25 min,后分装在培养皿中(直径:90mm;高:15mm)。激素添加量[8]分别为2,4-D 3.0 mg/L,激动素(kinetin,KT)0.1 mg/L。抗褐化剂活性炭、PVP、VC、柠檬酸、亚硫酸钠、硝酸银及不同浓度蔗糖的添加方式如表1。
将外植体接种在培养皿中,每个培养皿中6~9个,重复5次。暗培养箱中(25±2)℃培养,4周后计数。

表1 防褐化物质浓度Table 1 The browning agent concentration
1.3 统计分析

采用Excel 2003软件和SPSS 16.0方差分析过程(ANOVA)进行统计分析。
2 结果与分析
2.1 活性炭的作用效果
将幼穗接种在培养基上后,幼穗的绿色缓慢转变为黄色,大约17 d时,开始有愈伤长出。大部分愈伤在花序轴上长出,仅有少量在花序上长出。经过幼穗诱导得到的愈伤大都是致密、黄色的胚性愈伤。当培养基中活性炭的浓度为0.05 g/L时愈伤诱导率增加,但未达显著水平(P>0.05);当活性炭的浓度增加到0.15 g/L时,愈伤的诱导率显著增加(P<0.05);当活性炭的浓度超过0.15 g/L时,诱导率又有所下降(图1)。活性炭的浓度为0.27和0.15 g/L时,褐化率较小,但差异不显著(图2)。以上结果表明,活性炭的浓度为0.15 g/L时,愈伤诱导率最大,褐化率最低,是活性炭添加的最适浓度。

图1 不同活性炭浓度对诱导率的影响Fig.1 Effect of different AC concentration on callus induction

图2 不同活性炭浓度对褐化的影响Fig.2 Effect of different AC concentration on callus browning
2.2 VC对褐化的影响
当培养基中VC的添加量为0.05 g/L时,诱导率增加。随着VC浓度的增加,诱导率有增加的趋势。当添加量为0.35 g/L时,诱导率达到了最大。VC的添加量继续增加时,诱导率不再增加,有下降的趋势(图3)。当VC的添加量为0.35 g/L时,愈伤的褐化率最低,当VC的浓度继续增加时,愈伤褐化率并没有减少,反而增加(图4)。

图3 不同VC浓度对诱导率的影响Fig.3 Effect of different VCconcentration on callus induction
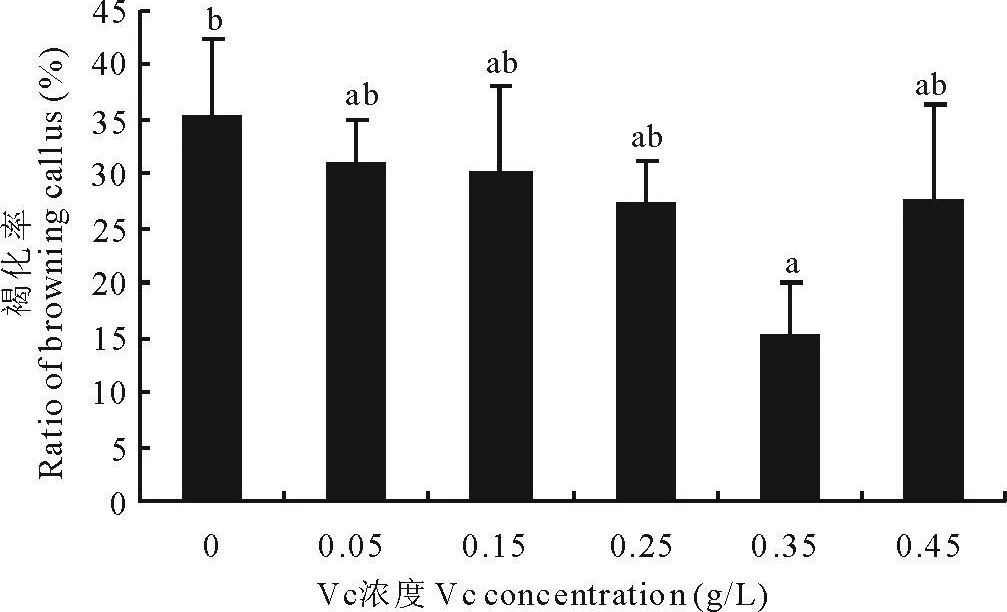
图4 不同 VC浓度对褐化的影响Fig.4 Effect of different VCconcentration on callus browning
2.3 PVP的作用效果
试验中随着PVP添加量的增加,愈伤率逐渐增加,当PVP添加到0.08 g/L时,愈伤率最大,PVP的添加量继续增加时,愈伤率减少(图5)。而当PVP的添加量为0.01 g/L时,褐化率有最大值,当添加量增加到0.16 g/L时褐化率最低(图6)。

图5 不同PVP浓度对诱导率的影响Fig.5 Effect of different PVP concentration on callus induction
2.4 硝酸银对褐化的影响
硝酸银在组织培养中运用很广泛,其中起主要作用的是Ag+。试验中Ag+的添加量为0.01 g/L,愈伤诱导率最大。当Ag+添加量大于0.01 g/L时,愈伤诱导率降低,当Ag+的添加量达到0.02 g/L时,严重制约愈伤的诱导(图7)。Ag+的添加量为0.01 g/L时,褐化率最低。当Ag+的添加量大于0.01 g/L时,褐化率升高(图8)。

图7 不同AgNO3浓度对诱导率的影响Fig.7 Effect of different AgNO3concentration on callus induction

图8 不同AgNO3浓度对褐化的影响Fig.8 Effect of different AgNO3concentration on callus browning
2.5 柠檬酸对褐化的影响
柠檬酸的添加量为0.5 g/L时,愈伤诱导率略低于对照组。柠檬酸添加量为1.0 g/L时,愈伤的诱导率增加,之后诱导率有降低的趋势,柠檬酸添加量增大到2.0 g/L时,愈伤率增加。柠檬酸添加量为5.0 g/L时,愈伤诱导率达到最大(图9)。柠檬酸的添加量为0.5 g/L时,褐化率最大,之后,随着柠檬酸的添加增加到1.0和1.5 g/L时,褐化率降低,但差异不显著(P>0.05)。柠檬酸添加量增加到2.0 g/L时,褐化率显著高于对照组(P<0.05)(图10)。

图9 不同柠檬酸浓度对诱导率的影响Fig.9 Effect of different citric acid concentration on callus induction

图10 不同柠檬酸浓度对褐化的影响Fig.10 Effect of different citric acid concentration on callus browning
2.6 蔗糖浓度对褐化的影响
不同的蔗糖浓度也能影响愈伤的诱导率和褐化率。蔗糖浓度为10~40 g/L时,随着蔗糖浓度的增加,愈伤褐化率增加(图11),而同样在蔗糖浓度为10~40 g/L时,愈伤率最大,当蔗糖浓度大于40 g/L时,愈伤率下降,褐化率增加。
3 讨论
3.1 活性炭对褐化的影响
Nguyen等[9]报道,在培养基中添加活性炭的量为1~5 g/L时,能够明显减少高粱幼胚产生的酚类物质。本试验表明,当活性炭的添加量为0.15和0.27 g/L时,能显著减轻褐化作用,在0.15 g/L时,苏丹草幼穗的组织产生愈伤诱导数最大。活性炭能提高诱导率可能是因为活性炭能释放吸收的生长调节剂(PGR)物质,促进愈伤的出愈。光照能分解生长激素类物质。而活性炭的添加也能为外植体提供暗环境,减少因光照而降解的激素类物质[10],保证了外植体所需的足够浓度的激素,提高了诱导率。

图11 不同蔗糖浓度对诱导率和褐化的影响Fig.11 Effect of different sucrose concentration on callus browning and induced
据报道,蔗糖经过高温灭菌后,部分降解产生了5-羟甲基糠醛(5-hydroxymethyl-2-furaldehyde),该类物质对愈伤组织的生长有抑制作用[11]。在培养基中添加活性炭,能吸附该物质,保持愈伤的正常生长。本试验中活性炭的添加量为0.05 g/L时,愈伤的诱导数增加不明显,可能是由于活性炭的添加量不足造成的,当活性炭的添加量达到0.15 g/L时,能吸附5-羟甲基糠醛等生长抑制物质,此时愈伤数最多。活性炭也能诱导胚性愈伤的形成[12]。本试验添加活性炭所得到的均为白色、致密的胚性愈伤。外植体接种在培养基中既能吸收 NO3-,又能吸收NH4+,正常情况下吸收NH4+的量大于NO3-,从而使pH降低[13]。如果在培养基中添加活性炭,活性炭能够使pH保持在5.5~6.0的正常水平,有利于愈伤的正常生长[14]。本试验的活性炭添加量为0.15 g/L时,有最大的诱导率,也可能与这有关。也有试验表明,活性炭的添加对褐化没有帮助[15],而本试验表明活性炭在一定程度上能抑制褐化,提高愈伤数。
3.2 VC对褐化的影响
VC作为褐化抑制剂在组织培养中使用频率很高,目前有2种处理方式:一是通过对外植体预处理[16](浸泡在VC溶液中一段时间);二是直接添加到培养基中[17]。其防止褐化的机理也有3点:一是VC能清除组织中产生的自由基,减少次生代谢产物酚类物质的积累;二是引起褐化的多酚氧化酶(PPO)是一种含铜的蛋白质,其活性依赖于铜的氧化还原作用。VC能将Cu2+还原成Cu+,抑制了该酶的活性,该种酶不耐热,在40~50℃时活性迅速下降,而在室温至40℃时则保持稳定的活性。
本试验将VC直接加在高温灭菌后的培养基中,也能明显降低褐化,当VC的添加量为0.35 g/L效果最好。也有报道认为,VC不但降低了酚类物质的含量,也延长了愈伤的存活时间[17]。但Linington[18]认为,在培养基中添加VC对防止褐化没有效果。这可能是由于将VC添加到培养基中经高温灭菌破坏了VC,使VC丧失了功能所致。VC也能消除有毒有害物质的积累,如GA3,各种生长激素等,提高愈伤的诱导率[19]。本试验添加VC也提高了诱导率,当VC的添加量为0.25 g/L时效果最好。
3.3 PVP对褐化的影响
PVP是一种水溶性物质,通过氢键与酚类物质结合,以此来减少酚类物质的毒害。Babbar和Gupta[20]认为花药的褐化是因为积累了大量的酚类物质,PVP能够吸收酚类物质,提高花药的诱导率。Ogita[21]的试验也表明,添加0.25 g/L PVP不但能防止褐化,而且也能提高外植体的诱导率。本试验中添加0.08 g/L PVP时有最大的诱导率,但此时的褐化数不是最少,当增大PVP的浓度到0.16 g/L时,褐化数最少。也有试验表明,PVP能够防止愈伤组织因产生的酚类物质导致的坏死而提高愈伤数[22],本试验中愈伤数增加来自两部分,一部分是增加了愈伤诱导数,二是减少了愈伤的死亡数。虽然PVP能防止褐化,但不能完全消除褐化[20],当PVP的添加量为0.16 g/L时,PVP能最大限度的防止褐化,同时,愈伤数降低。这可能是高浓度PVP既吸收了酚类物质,又吸收了各种生长调节剂(PGR),降低了其在培养基中的浓度,影响了愈伤的诱导。
3.4 硝酸银对褐化的影响
植物材料在密闭容器中或受伤后都会产生乙烯[23],乙烯大量积累会使愈伤褐化。硝酸银作为一种褐化抑制剂,其主要作用是抑制乙烯的产生。银离子通过竞争性结合位于细胞膜上的乙烯受体蛋白,阻止或降低乙烯的作用[24],从而防止褐化。乙烯的积累影响了愈伤的生长及植物形态的建成,乙烯也能促进或抑制愈伤的形成[25]。本试验中添加不同浓度的硝酸银都能降低褐化,在0.01 g/L时能将褐化愈伤数控制在最低水平,但并没有完全消除褐化。多数试验表明,添加乙烯抑制剂硝酸银均能促进细胞的生长[26]和诱导率[27]。本试验添加0.01 g/L的硝酸银有最多愈伤数,但随着硝酸银浓度的升高,愈伤数减少,这可能是高浓度的银离子对愈伤造成了伤害。
3.5 柠檬酸对褐化的影响
柠檬酸在组织培养中往往作为前处理剂处理外植体来防止褐化[28]。柠檬酸是一种酸性物质,当外植体浸泡在其中时,因其酸性作用降低了外植体本身的pH。多酚氧化酶在pH为6.5左右时活性最大,随着pH的降低,多酚氧化酶的活性也降低,柠檬酸通过提供酸性环境抑制多酚氧化酶的活性防止褐化[29]。这是因为pH在4.0以下时,PPO酶活性中心的Cu2+与周围的结合开始松弛,在有柠檬酸的条件下,Cu2+和柠檬酸生成了螯合物,除去了PPO酶中的Cu2+,使PPO酶变性失活,从而抑制褐化[30]。本试验用柠檬酸预处理外植体后,褐化不仅没有降低,反而更严重了,这可能是柠檬酸对外植体造成了损伤,此点需深入研究。
本试验中诱导率随着柠檬酸添加量的增加而增加,在1.0 g/L时,有较大诱导率,之后随着添加浓度的增加,诱导率降低;当柠檬酸的添加量增大到5.0 g/L时,诱导率达到最大,这可能与柠檬酸也能减少愈伤的坏死有关[31]。当柠檬酸的添加量达到一定值时,就会有负面的效果,这可能是高浓度柠檬酸会影响愈伤生长能量代谢过程中的电子转移[32]。本试验柠檬酸的添加量并没有达到最大量。
3.6 蔗糖浓度对褐化的影响
蔗糖在组织培养中作为主要碳源物质,在组织培养中作为细胞分裂与生长的能量来源。经高压灭菌后,部分降解为D-葡萄糖、D-果糖。蔗糖也是细胞渗透调节物质,对愈伤组织的诱导和褐变有制约作用。一般认为,影响外植体褐变的因素有外植体的基因型、培养基的成分和培养材料所处的培养环境等。适当增加蔗糖的浓度能增加各种酶的活性[33],从而促进次生代谢产物的合成。本试验随着蔗糖浓度的增加,酚类物质的合成增加,褐化的愈伤数增加。当蔗糖浓度的添加量从10 g/L增加到40 g/L时,愈伤褐化数增加不显著(P>0.05),当蔗糖浓度添加到50 g/L时,褐化愈伤数显著增加(P<0.05)。Park等[34]的研究也表明,当蔗糖浓度较低时,能促进愈伤组织的生长,高浓度的蔗糖能促进褐化。本试验中当蔗糖在较低浓度10~40 g/L时,愈伤数增加,蔗糖浓度大于40 g/L时,愈伤数降低,褐化数增加。
4 结论
不同的褐化防止手段对苏丹草愈伤的作用效果是不同的。当柠檬酸浓度为5 g/L时,愈伤的诱导数最大,诱导愈伤效果为:柠檬酸>活性炭>PVP>VC>蔗糖>硝酸银;在PVP浓度为0.16 g/L时,褐化的防止效果最好:PVP>硝酸银>VC>活性炭>蔗糖>柠檬酸。添加柠檬酸虽然能得到大量的愈伤,但得到的愈伤颗粒细小,水渍化严重,褐化数高,继代后大部分死亡,因此,柠檬酸不利于用作苏丹草的褐化抑制剂。经活性炭作用后得到的愈伤诱导数多,呈白色,质密,生长迅速,褐化愈伤少,均为胚性愈伤。在苏丹草幼穗诱导中,活性炭为最佳的褐化抑制剂,当活性炭的添加量为0.15 g/L时,能有效防止褐化,提高愈伤的诱导率。
[1]李文西,鲁剑巍,杨娟.苏丹草-黑麦草轮作制中施肥对饲草产量及养分吸收的影响[J].草业学报,2009,18(3):165-170.
[2]He Y,Guo X,Lu R,et al.Changes in morphology and biochemical indices in browning callus derived from Jatrophacurcas hypocotyls[J].Plant Cell,Tissue and Organ Culture,2009,98:11-17.
[3]Sung J H.Baicalin production in transformed hairy root clones of Scutellariabaicalensis[J].Biotechnology and Bioprocess Engineering,2006,11:105-109.
[4]徐春波,米福贵,王勇,等.影响冰草成熟胚组织培养再生体系频率的因素[J].草业学报,2009,18(1):81-85.
[5]王友生,王瑛,李阳春.三叶草愈伤组织诱导及分化的研究[J].草业学报,2009,18(2):212-215.
[6]李晶,孙吉雄,梁慧敏.日本矮生沿阶草愈伤组织的诱导及其分化[J].草业科学,2009,26(4):150-153.
[7]Murashige T,Skoog F.A revised medium for rapid growth and bioassay with tobacco tissue cultures[J].Physiologia Planta-rum,1962,15:473-497.
[8]钟小仙,佘建明,顾洪如,等.苏丹草幼穗离体培养植株的再生技术[J].江苏农业学报,2005,21(4):331-335.
[9]Nguyen T V,Thu T T,Claeys M,et al.Agrobacterium-mediated transformation of sorghum(Sorghum bicolor(L.)Moench)using an improved in vitro regeneration system[J].In Plant Cell Tiss Organ Culture,2007,91:155-164.
[10]Nwanko B A,Krikorian A D.Morphogenetic potential of embryo-and seedling-derived callus of Elaeis guineensis Jacq.var.pisifera Becc[J].Annals of Botany,1983,51:65-76.
[12]Thomas T D.The role of activated charcoal in plant tissue culture[J].In Biotechnology Advances,2008,26(6):628-631.
[13]Pinto G,Silva S,Park Y S,etal.Factors influencing somatic embryogenesis induction in Eucaly ptus globulus Labill.:basal medium and anti-browning agents[J].Plant Cell,Tissue and Organ Culture,2008,95:79-88.
[14]Eymar E,Alegre J,Toribio M,et al.Effect of activated charcoal and 6-benzyladenine on in vitro nitrogen uptake by Lagerstroemia indica[J].Plant Cell,Tissue and Organ Culture,2000,63:57-65.
[15]Wei X,Gou X,Yuan T,et al.A highly efficient in vitro plant regeneration system and Agrobacterium-mediated transformation in Plumbagozeylanica[J].Plant Cell Reporters,2006,25:513-521.
[16]Qu R,Chaudhury A.Improved young inflorescence culture and regeneration of`tifway'bermudagrass(Cynodon transvaalensis x c.dactylon)[J].In International Turfgrass Society Research Journal,2001,9:198-201.
[17]Jayabalan P B A N.In vitro mass propagation and diverse callus orientation on Sesamum indicum L.-an important oil plant[J].Journal of Agricultural Technology,2006,2:259-269.
[18]Linington I M.In vitro propagation of Dipterocarpus alatus and Dipterocarpus intricatus[J].Plant Cell,Tissue and Organ Culture,1991,27:81-88.
[19]Joy R W,Patel K R,Thorpe T A.Ascorbic acid enhancement of organogenesis in tobacco callus[J].Plant Cell,Tissue and Organ Culture,1988,13:219-228.
[20]Babbar S,Gupta S.Induction of androgenesis and callus formation in vitro cultured anthers of a myrtaceous fruit tree(Psidium guajava L.)[J].Journal of Plant Research,1986,99:75-83.
[21]Ogita S.Callus and cell suspension culture of bamboo plant[J].Phyllostachys nigra In Plant Biotechnology,2005,22:119-125.
[22]Brukhin V B,Moleva I R,Filonova L H,et al.Proliferative activity of callus cultures of Taxusbaccata L.in relation to anticancer diterpenoid taxol biosynthesis[J].Biotechnology Letters,1996,18:1309-1314.
[23]Vinod K,Giridhar P,Gokare A R.AgNO3-a potential regulator of ethylene activity and plant growth modulator[J].Electronic Journal of Biotechnology,2009,(12):1-15.
[24]Goh C J,Ng S K,Lakshmanan P,et al.The role of ethylene on direct shoot bud regeneration from mangosteen(Garcinia mangostana L.)leaves cultured in vitro[J].Plant Science,1997,124(2):193-202.
[25]Dimasi-Theriou K,Economou A S,Sfakiotakis E M.Promotion of petunia(Petunia hybrida L.)regeneration in vitro by ethylene[J].Plant Cell,Tissue and Organ Culture,1993,32:219-225.
[26]Niroula R K,Bimb H P.Effect of genotype and callus induction medium on green plant regeneration from anther of nepalese rice cultivars[J].Asian Journal of Plant Sciences,2009,8:368-374.
[27]Bohorova N E,Luna B,Brito R M,et al.Regeneration potential of tropical,sub tropical,mid altitude and highland maize inbreds[J].Maydica,1995,40:275-281.
[28]Dan Y.Biological functions of antioxidants in plant transformation[J].In Vitro Cellular&Developmental Biology-Plant,2008,44:149-161.
[29]Teixeria J B,Sondahl M R,Kirby E G.Somatic embryogenesis from immature inflorescences of oil palm[J].Plant Cell Reporters,1994,13:247-250.
[30]Victoria M M,Whitaker J R.The biochemistry and control of enzymatic browning[J].T rends in Food Science and Technology,1995,6(6):196-200.
[31]Krishna H,Sairam R K,Singh S K,et al.Mango explant browning:Effect of ontogenic age mycorrhization and pre-treatments[J].Scientia Horticulturae,2008,118(2):132-138.
[32]Anthony J M,Senaratna T,Dixon K W,et al.The role of antioxidants for initiation of somatic embryos with Conostephium pendulum(Ericaceae)[J].Plant Cell,Tissue and Organ Culture,2004,78:247-252.
[33]Roh K,Choi B.Sucrose regulates growth and activation of rubisco in tobacco leavesin vitro[J].Biotechnology and Bioprocess Engineering,2004,9:229-235.
[34]Park Y G,Kim S J,Kang Y M,et al.Production of ginkgolides and bilobalide from optimized the Ginkgobiloba cell culture[J].Biotechnology and Bioprocess Engineering,2004,9:41-46.
