大蒜SOD酶的分离纯化和肝素修饰
2011-03-26杨华周小苗方亚东郭纯龚银曹杏芝
杨华,周小苗,方亚东,郭纯,龚银,曹杏芝
(1.湖南农业大学,湖南 长沙 410128;2.湖南中医药大学药学院,湖南 长沙 410007)
SOD是广泛存在于生物体内的一种含金属酶,它催化超氧自由基O-2转变为H2O2和O2的歧化反应,在防御生物体免受超氧自由基损伤、抗氧化、抗辐射、抗肿瘤、及延缓机体衰老等方面都具有重要作用,近年来受到生化界及医药界的普遍关注[1-3]。但天然SOD稳定性差,SOD在体内半衰期为6~15 min,因此,限制了其在食品、保健品、药品等方面的应用[4]。本项研究从大蒜中提取SOD酶,以肝素为修饰剂,对大蒜SOD酶进行共价修饰,以期获得高稳定性的修饰SOD,为大蒜SOD的应用提供依据。
1 材料和方法
1.1 材料
大蒜(Allium sativum L.)球茎购自湖南农大农贸市场,25℃发芽2~5 d。
1.2 试验方法
1.2.1 大蒜SOD的提取将发芽大蒜用大量清水冲洗,再用蒸馏水洗净,滤纸吸干后称取约50 g加入pH值7.8、0.05 mol/L的磷酸缓冲液200 mL(内含0.001 mol/L的EDTA),用组织捣碎机匀浆,再用超声波破碎10 min,然后以4000 r/min离心20 min得上清液,测体积。上清液即为大蒜SOD的粗提取液[5-6]。
1.2.2 大蒜SOD活性的测定方法采用邻苯三酚自氧化法[7-8]。以每毫升反应液中每分钟抑制邻苯三酚自氧化速率达50%的酶量定义为一个酶活力单位(U)。
1.2.3 蛋白质含量的测定采用考马斯亮蓝法测定蛋白质含量。
1.2.4 选择加热温度实验试管中加入适量大蒜SOD粗提取液,分别在50、55、60、65、70、75、80℃水浴中加热20 min,然后4000 r/min离心20 min,上清液即为SOD粗纯化液。测定酶活和蛋白含量。
1.2.5 硫酸铵分级沉淀实验按照粗提液的体积查出0℃下达到一定饱和度所需硫酸铵的质量。将硫酸铵晶体研磨成白色粉末后,称取一定质量的硫酸铵粉末缓慢加入SOD粗提液中,使之达到40%的饱和度,再放置4℃冰箱1 h,然后8000 r/min冷冻离心20 min,除去沉淀杂蛋白,取上清液。在上清液中再加硫酸铵粉末使之达到80%饱和度,放置于4℃冰箱2 h,然后8000 r/min冷冻离心20 min,收集沉淀。用缓冲液A(10 mmol/L磷酸缓冲液,pH值7.8)溶解,然后在相同缓冲液中充分透析,离心去除不溶性沉淀。量透析液体积,测定酶活和蛋白含量。
1.2.6 微晶纤维素层析纯化SOD酶称取15~20 g微晶纤维素粉末,悬浮于200 mL含1%Tween 20的水溶液中,置于磁力搅拌器上搅拌1~2 h,静置片刻,弃去悬浮杂质,抽滤,用蒸馏水充分冲洗干净后悬浮于200 mL醋酸缓冲液(0.01 mol/L,pH值4.0),于4℃环境中装柱(2 cm×20 cm),以醋酸缓冲液彻底平衡柱子。将透析液上样于平衡好的微晶纤维素柱,继续用4倍柱体积的醋酸缓冲液洗脱柱子,然后分别用含0.1和0.2 mol/L NaC1的醋酸缓冲液阶段洗脱柱子,收集活性组分[9]。
1.2.7 肝素修饰大蒜SOD酶称取纯化的大蒜SOD溶于0.01 mol/L浓度的Tris缓冲液,加入一定比例的活化肝素,于4℃反应20 h,用甘氮酸终止反应,反应液浓缩后上纤维素层析柱,经洗脱收集具有SOD活力组分,即得修饰SOD酶。修饰的SOD酶以纤维素层析纯化的SOD酶为对照进行SDSPAGE检测和保持稳定性分析[10-13]。
2 结果及分析
2.1 加热温度对大蒜SOD酶学特性的影响
分别测定不同处理温度加热获得的纯化液中SOD酶的活力及蛋白质含量,计算SOD比活力,结果如图1。
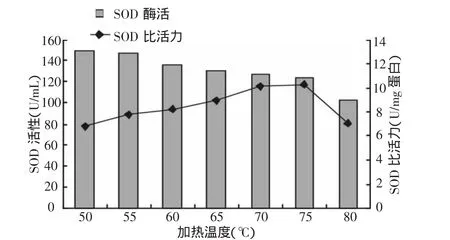
图1 温度和SOD酶活性及比活力的关系
从图1可以看出随着加热温度上升,大蒜SOD酶的活性会下降。而且温度达到80℃时,酶活力损失较多,超过30%。而随着温度上升,大蒜SOD酶的比活力会较快上升。但超过75℃时,酶的比活力反而会下降。其原因是SOD酶热稳定性较好,温度上升初期,其他的蛋白变性沉淀,SOD酶比活力表现为增加;而温度过高时,SOD酶的稳定性下降,损失了酶活力,比活力下降。在70~75℃间,酶的活力及比活力大致相当。从能量等方面考虑,建议热处理纯化SOD酶蛋白的温度采用70℃。
2.2 大蒜SOD酶的纤维素层析
经热处理和盐析的酶样品上纤维素层析柱进行梯度洗脱。梯度洗脱的起始缓冲液为0.1mol/L的NaCl醋酸缓冲液,终止缓冲液为0.2 mol/L的NaCl醋酸缓冲液。收集洗脱液,测定蛋白质含量及SOD酶活性(见图2)。检测发现,酶活力在峰Ⅰ和峰Ⅲ都有出现,而主要集中在峰Ⅲ。
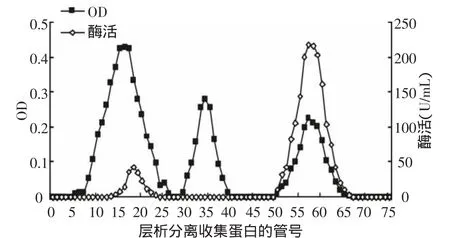
图2 纤维素层析SOD洗脱曲线
2.3 大蒜SOD酶分离纯化的结果
大蒜SOD酶提取液经70℃加热20 min,取上清液在4℃条件下先使硫酸铵的饱和度达到40%。除杂后调整硫酸铵饱和度达到80%,取沉淀透析,透析液经纤维素层析。分离纯化的效果见表1。
从表1可以看出,在纯化的过程中酶活力不断地被损失,而比活力不断增加。经过热变性、硫酸铵分级盐析和纤维素柱层析3步,酶的纯度增加了356.7倍。而纤维素柱层析的纯化效果更加显著。
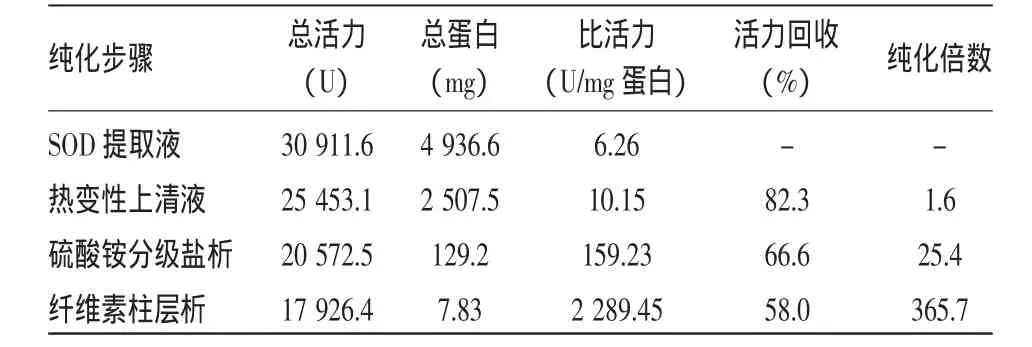
表1 大蒜SOD的分离纯化结果
2.4 大蒜SOD酶肝素修饰效果
对经过肝素修饰的大蒜SOD酶进行SDSPAGE检测,检测结果如图3。从图3可以看出,经纤维素层析的样品在电泳时只有一条明显的条带(图3-1),说明大蒜SOD原酶液经过热处理、盐析及层析等纯化步骤可以得到比较纯净的SOD酶样品。而在电泳时,经肝素修饰的SOD酶电泳迁移率小于SOD原酶。其主要原因在于肝素修饰是大分子结合修饰,肝素结合到SOD酶上,导致修饰的SOD酶分子量增大,电泳速度减慢。修饰的SOD酶经稳定性分析,结果表明修饰的SOD酶在溶液中保存一星期,其酶活性可保持85%以上;而未修饰的SOD原酶液酶活性低于30%。
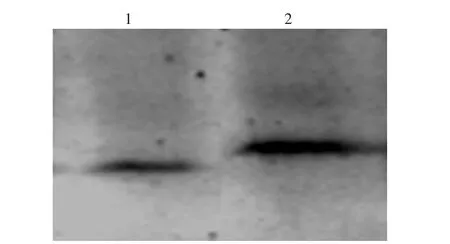
图3 SDS-PAGE分析肝素修饰的SOD酶
3 讨论
一般认为SOD酶稳定性不强,但SOD酶比较耐热。因此分离纯化时可以采用热变性的方式使其他不耐热的蛋白变性沉淀,达到除杂的目标。而盐析是酶分离纯化经常用到的技术,该技术能有效将目标蛋白和其他杂质分开,而且能有效浓缩酶液。层析分离具有设备简单、操作方便等特点,在实验室和工业化生产中均广泛应用。因此,选择这3种技术分离纯化大蒜SOD酶,试验结果表明这3种技术组合能有效分离纯化SOD酶。
微晶纤维素层析能有效纯化大蒜SOD酶,但由于微晶纤维素颗粒太小,在洗脱时洗脱液流速过慢,效率很低。如何提高洗脱速度是工业化生产时值得考虑的一个问题。另外应用微晶纤维素层析分离大蒜SOD酶时会出现两个酶活性峰,这可能是大蒜SOD酶存在同工酶的形式。
SOD是一种重要的氧自由基清除剂,但其半衰期比较短,从而限制了它在临床上的应用。对酶进行化学修饰是克服这一缺点的途径之一,国内外对此作了大量工作,并取得了一定效果。在众多大分子修饰剂中,PEG应用最为广泛。但考虑到肝素为动物体内水溶性酸性粘多糖,具有抗凝血、抗血栓及降血脂等活性,经肝素修饰的SOD酶可能既有清除氧自由基的活性又有抗凝血的活性,医药价值更大,因此选择了肝素作为大分子修饰剂。
[1]SeguíJ,Gironella M,Sans M,et al.Superoxide dismutase ameliorates TNBS-induced colitis by reducing oxidative stress,adhesion molecule expression,and leukocyte recruitment into the inflamed intestine.J.Leukoc.Biol..September 2004,76(3):537-544.
[2]Campana,F.Topical superoxide dismutase reduces post-irradiation breast cancer fibrosis.J.Cell.Mol.Med..2004,8(1):109-116.
[3]Vozenin-Brotons M C,Sivan V,Gault N,et al.Antifibrotic action of Cu/Zn SOD is mediated by TGF-beta1 repression and phenotypic reversion of myofibroblasts[J].Free Radic Biol Med.Elsevier.2001,30(1):30-42.
[4]郭勇.酶工程(第二版)[M].北京:科学出版社,2007.
[5]王雪峰,沈颂东,迮玉官,等.大蒜超氧化物歧化酶的分离纯化及其性质的研究[J].安徽农业科学,2001,29(3):408-409.
[6]孙永君.大蒜中SOD的提取研究[J].化学与生物工程学报,2005,(10):23-25.
[7]李永利,张焱.邻苯三酚自氧化法测定SOD活性[J].中国卫生检验杂志.2000,l0(6):673.
[8]万军,黄国钧,周霞.邻苯三酚自氧化法测定SOD活性中检测波长的优化[J].安徽农业科学,2010,(14):7315-7315,7381.
[9]杨学山,杨孝朴,杨志杰,等.离子交换层析法纯化羊血SOD及其稳定性研究[J].甘肃农业大学学报,2010,45(5):157-160.
[10]柳建平.皱皮木瓜超氧化物歧化酶分离纯化研究[J].安徽农业科学,2009,37(1):222-223.
[11]柳建平,罗安才.青梅果超氧化物歧化酶粗酶的提取及活性研究[J].安徽农业科学,2009,(19):9126-9127,9170.
[12]杨莉,杨萍,申虹,等.超氧化物歧化酶修饰前后的瑟定性比较[J].郑州工程学院学报,2003,24(1):68-70.
[13]刘向勇,张小华,单长民,等.超氧化物歧化酶在酿酒酵母碱胁迫抗性中的功能研究[J].安徽农业科学,2010,(26):14277-14278.
