增强型绿色荧光蛋白转染活细胞效率的研究
2011-03-25吕晓杰周广东马俐君曹谊林
吕晓杰 周广东 马俐君 刘 霞 曹谊林
增强型绿色荧光蛋白转染活细胞效率的研究
吕晓杰 周广东 马俐君 刘 霞 曹谊林
目的 研究影响增强型绿色荧光蛋白(EGFP)逆转录病毒表达系统转染活细胞效率的主要相关参数,建立一种稳定高效的活细胞EGFP标记技术。方法 培养、扩增携带EGFP逆转录病毒载体的包装细胞PG13,分别于12 h、24 h、36 h和48 h收集病毒液,转染骨髓基质细胞(BMSCs),通过流式细胞仪和荧光显微镜检测不同时间点病毒转染效率。选择转染率最高时间点的病毒液,连续转染BMSCs两次,小剂量嘌呤霉素筛选6 h,观察病毒转染率及细胞活力。再以上述方法转染脂肪基质细胞(ADSCs)和成纤维细胞(FBs),观察这种方法标记其他干细胞或成熟分化细胞的可行性。结果 根据流式细胞仪及荧光显微镜观察结果,24 h收集的病毒液转染BMSCs效率最高(64.56±2.53)%,36 h次之(56.98±3.22)%,12 h(47.39±1.82)%与48 h(37.84±1.77)%相对较低。连续转染两次并经短暂筛选后,BMSCs转染率可达80%以上,且细胞活力不受影响。采用相同方法转染脂肪基质细胞(ADSCs)和成纤维细胞(FBs),转染率均能达到80%,且细胞形态、增殖能力均未见明显改变。结论 本实验建立了一种稳定高效的活细胞EGFP转染技术,为研究组织工程种子细胞的体内、外转归及细胞间相互作用提供了稳定且直观的检测手段。
增强型绿色荧光蛋白 逆转录病毒 细胞标记 组织工程
细胞标记是研究组织工程种子细胞生物学行为必备的重要技术和工具,建立高效、稳定、直观、灵敏且检测方便的细胞标记技术,一直是组织工程种子细胞研究领域的重要课题。与其他细胞标记方法相比,以逆转录病毒为载体的增强型绿色荧光蛋白(EGFP)基因转染[1-2]因同时具有稳定(表达持久)、直观、灵敏且检测方便等诸多优点,一直是首选的细胞标记方法,特别是针对需要进行体内、外较长时期观察活细胞分布、转归及细胞间相互作用的研究,更是最佳的细胞示踪方法。但是,该方法转染效率相对较低,长期筛选会损失大量目的细胞,并加快细胞老化,明显影响细胞活力甚至改变细胞原有的生物学特性,严重限制了其应用范围。为解决上述问题,本实验通过对影响EGFP逆转录病毒表达系统转染效率主要相关参数进行系统研究、比较与分析,初步建立了一种稳定、高效的活细胞EGFP标记技术,为组织工程种子细胞的体内、外转归及细胞间相互作用研究提供稳定、直观的检测手段。
1 材料和方法
1.1 实验材料
1.1.1 实验试剂
携带EGFP逆转录病毒载体的包装细胞PG13(上海交通大学医学院附属仁济医院马俐君惠赠);鱼精蛋白、嘌呤霉素和Dispase(美国Sigma公司);Ⅰ型胶原酶(美国Worthington公司);DMEM培养基(美国Gibco公司);胎牛血清 (FBS)(美国Hyclone公司);实验动物为长枫杂交猪(上海川沙养殖场)。
1.1.2 实验仪器
主要实验仪器包括恒温摇床 (太仓华美生化仪器),倒置相差显微镜(日本Nikon公司),荧光显微镜(日本Olympus公司),流式细胞仪(美国Beckman Coulter公司)。
1.2 实验方法
1.2.1 EGFP逆转录病毒液的收集和制备
冻存的含EGFP逆转录病毒表达载体的包装细胞PG13快速置于37℃水浴复苏,1 500 r/min离心5 min,弃上清,细胞沉淀重悬于含10%胎牛血清的DMEM中,以0.5×104cells/cm2的密度接种于100 mm培养皿,细胞贴壁生长达80%以上融合时,改用含20%胎牛血清的DMEM以相同密度传代接种于20个培养皿(10 mL DMEM/皿),分别于12 h、24 h、36 h和48 h各收集5个培养皿的病毒上清,并加入鱼精蛋白5 μg/mL,混合液经0.45 μm无菌滤膜过滤收集于50 mL无菌离心管内,立即用于实验或置-80℃中备用。
1.2.2 骨髓基质细胞(BMSCs)的分离、培养与扩增
4~6周龄长枫杂交猪常规麻醉、消毒,无菌条件下抽取骨髓3~4 mL,置于肝素化无菌离心管中,加无血清DMEM 30 mL,充分混匀,2 000~3 000 r/min离心 10 min,轻轻吸除脂肪及大部分上清液,以含10%FBS的DMEM重悬下层细胞沉淀,细胞密度为6×105cells/cm2接种于100 mm培养皿内,37℃、5% CO2、100%饱和湿度条件下,培养5~6 d首次换液,3~4 d后细胞可达80%融合,按1×104cells/cm2密度传代于新的培养皿内,继续培养,传至第二代的细胞接种于20个100 mm培养皿内,达到对数生长期(约24 h)时,用于病毒转染及效率测定,另外同样方法培养5皿BMSCs作为未转染对照组。
1.2.3 BMSCs中EGFP基因转染及效率测定
将上述不同时间点(12 h、24 h、36 h和48 h)收集的PG13细胞上清病毒液各10 mL分别加入上述处于对数生长期的BMSCs中,每个时间点病毒液对应5皿BMSCs,转染12 h后,换成正常培养液继续培养24 h,于荧光显微镜下观察EGFP的表达。分别收集同期培养的未转染BMSCs及不同时间点病毒液转染的BMSCs,以磷酸盐缓冲液(PBS)清洗2次,流式细胞仪定量检测[3]各时间点收集的病毒液转染BMSCs的EGFP阳性表达率,比较不同时间点的病毒液转染效率,结果进行统计学分析。
1.2.4 BMSCs中EGFP基因转染效率进一步优化
收集转染率最高的时间点的PG13的病毒上清,分别转染5皿BMSCs。具体的优化方案为:连续转染BMSCs两次,即首次转染12 h后,换成正常培养液,6 h后再次加入病毒上清转染12 h,之后换成正常培养液培养,待细胞达到80%以上融合时,加入含嘌呤霉素3 μg/mL的DMEM培养液10 mL进行筛选,筛选6 h后,换成正常培养液继续培养,待再次达到80%融合时,荧光显微镜下观察EGFP的表达情况,流式细胞仪测定BMSCs的EGFP阳性表达率,与单次转染进行比较,结果进行统计学分析。
1.2.5 脂肪基质细胞(ADCs)培养及EGFP标记
取整形外科抽脂患者(年龄 25~45岁)脂肪抽吸液100 mL,等量PBS清洗3遍,0.075%Ⅰ型胶原酶37℃消化30 min,1 380 r/min离心10 min,弃上清,细胞沉淀重悬于含10%胎牛血清的DMEM中,吸取少量细胞悬液用4%乙酸等体积稀释,常规计数有核细胞数,100 mm培养皿每皿接种约1×106个细胞,置于37℃、5%CO2、100%饱和湿度的条件下培养24 h后,首次换液。细胞达80%融合后,胰酶消化,按1×104cells/cm2密度传代,传至第2代的细胞达到对数生长期(约24 h)时,按优化后的方法进行转染、筛选并测定转染阳性率。
1.2.6 皮肤成纤维细胞(FBs)培养及EGFP标记
取泌尿外科患儿(10岁以下)包皮1 cm×1 cm,置于无菌离心管中,PBS清洗 2次,0.6 U/mL的Dispase 4℃消化过夜,去除表皮,将真皮于无菌条件下充分剪碎,以0.15%胶原酶37℃消化4 h,无菌滤网过滤后,2 000~3 000 r/min离心10 min,弃上清,细胞沉淀重悬于含10%胎牛血清的DMEM中,按1×104cells/cm2密度接种于100 mm培养皿,37℃,5%CO2、100%饱和湿度下培养过夜,细胞达80%融合后,按0.5×104cells/cm2密度传代培养,传至第2代细胞达到对数生长期(约24 h)时,按优化后的方法进行转染、筛选并测定转染阳性率。
2 结果
2.1 PG13细胞的培养和扩增
包装细胞PG13呈短梭形或三角形,胞浆内充满粗大颗粒。在荧光显微镜蓝光激发下,PG13表达的EGFP能够产生明亮的绿光。分别于不同时间点观察PG13的生长状况及荧光强度变化,可见随着接种时间延长,PG13密度逐渐增加,约24 h达到对数增长期,48 h完全融合。同时,荧光强度也随时间延长而逐渐增加(图1)。
2.2 不同时间点病毒液转染BMSCs后EGFP表达的荧光观察
未转染的BMSCs呈梭形或扁平形。各时间点收集的病毒液转染BMSCs后,均出现EGFP阳性细胞,其中24 h和36 h的阳性细胞数明显多于48 h和12 h,说明24 h和36 h收集的病毒液转染效率较高,而48 h和12 h较低(图2)。
2.3 不同时间点病毒液转染BMSCs,EGFP表达的流式分析
流式细胞仪定量分析结果表明,24 h收集病毒液转染BMSCs后EGFP表达阳性率最高,为(64.56± 2.53)%;36 h组略低,为(56.98±3.22)%;12 h与48 h组相对较低,为别为(47.39±1.82)%和(37.84±1.77)%。结果表明,各组转染率之间存在显著差异(P<0.05)。转染阳性细胞与阴性细胞分别形成两个荧光,表达不同的群体(图3)。
2.4 BMSC中EGFP基因转染效率的优化
经两次转染和一次短暂筛选后,荧光观察EGFP阳性细胞比例较一次转染时明显增多,流式测定结果显示转染阳性率达(80.94±1.45)%。统计学分析表明,该优化方法的转染率比一次转染率显著增高(P<0.05),而且细胞活力及增殖状态与未转染细胞相比无显著差别。说明该方法在提高转染效率的同时,并不会明显影响细胞的正常生长代谢和生物学特性(图4)。
2.5 ADSCs和FBs的EGFP标记结果
按优化的转染方法,经过两次转染和一次短暂筛选后,ADSCs和FBs的EGFP阳性表达率与BMSCs结果相似,且细胞形态、增殖能力等均未受明显影响,说明该方法可以适用于其他干细胞或成熟分化细胞(图5)。
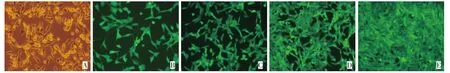
图1 EGFP逆转录病毒包装细胞PG13在不同时间点的生长状况(100×)Fig.1 Growth and morphology of PG13,the packing cell of EGFP retrovirus,at the different time(100×)
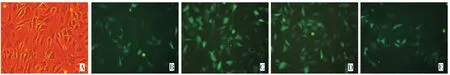
图2 不同时间点病毒液转染BMSCs后EGFP阳性表达率的荧光观察(100×)Fig.2 Fluorescent observation of expression rates of EGFP,after BMSCs were transfected by the retrovirus supernatant at different time(100×)

图3 不同时间点病毒液转染BMSCs后EGFP阳性表达率的流式分析Fig.3 Flow analysis of expression rates of EGFP,after BMSCs were transfected by the retrovirus supernatant at different time

图4 以优化方法转染BMSCs,EGFP阳性表达率的荧光观察(40×)和流式分析Fig.4 Fluorescent observation and flow analysis of expression rates of EGFP,after BMSCs were transfected using the optimal method(40×)
3 讨论
细胞标记一直是组织工程种子细胞研究的重要课题,对于明确构建组织的细胞来源以及植入体内后种子细胞的分布、分化、最终转归及其与宿主细胞间的相互作用机制等具有重要意义。目前常用的细胞标记方法很多,但每种标记方法均有其各自的优缺点,如:染色标记法持续时间短、衰减快;β半乳糖苷酶(β-Gal、LacZ)基因转染率低、检测困难;BrdU标记法作用时间短,浓度高时易损伤细胞等。与这些方法相比,以逆转录病毒为载体的绿色荧光蛋白(GFP)基因转染具有明显的优势[4-5],标记成功后可直接通过荧光显微镜或流式细胞仪直观、灵敏地检测活细胞的阳性细胞率。更重要的是,标记细胞体外扩增后,荧光强度不变而数量增多,植入体内也会永久表达EGFP。因此,该方法具有稳定、直观、灵敏且检测方便等诸多优点,成为组织工程领域研究种子细胞分布、转归及细胞间相互作用的首选细胞标记方法[6]。但该方法也存在明显不足,其中最大的问题就是转染效率相对较低,尤其是对于静止期细胞和增殖能力较低的细胞,几乎很难将EGFP基因转入。细胞筛选虽然可以显著提高阳性细胞率,但长期筛选会损失大量目的细胞,并加快细胞老化,明显影响细胞活力甚至改变细胞原有的生物学特性,这些问题严重限制了其应用范围。本实验试图在提高EGFP逆转录病毒表达系统转染效率的同时,尽量保证转染后细胞仍具有原来的增殖活力和生物学特性。
大量研究表明,逆转录病毒转染效率受包装细胞质量、血清浓度、病毒滴度、病毒收集时间、转染目的细胞时机、转染时间及筛选时间等诸多因素的影响,只有优化组合这些相关参数,才能得到较高的病毒转染效率并维持目的细胞的正常生长代谢[7-8]。在实验中我们发现,病毒转染率较低的问题主要与包装细胞质量不佳、病毒收集时间不当、目的细胞未处于增殖期等有关,致使一次转染率普遍不高。随后进行的长期筛选,虽然能够大幅提高转染率,但细胞的活力和功能受到极大影响。因此,筛选后的细胞普遍存在增殖能力差、细胞老化和生物特性改变等现象,某些筛选后干细胞甚至丧失部分或全部分化潜能,无法进行组织工程种子细胞特性方面的研究。我们认为,解决上述问题的最根本措施是提高病毒首次转染效率,这就要求将包装细胞和目的细胞都调整到最佳状态,在病毒滴度最高时转染目的细胞。若要进一步提高转染率,可做二次转染,必要时行短暂筛选,但绝对不可大剂量、长期筛选,以免细胞活力明显下降,造成转染失败。
本实验在包装细胞PG13复苏早期,便对细胞状态进行调整,并选择应用20%的胎牛血清,以0.5×104cells/cm2的接种密度对PG13进行培养扩增,尽量争取在接种24 h时达到对数生长期,48 h时基本融合。这样除了能在细胞增殖最旺盛时获得大量病毒液外,还能保证细胞融合后,病毒液仍然具有充足营养,以利于日后的转染。此外,被标记目的细胞的生长状态也是影响转染效率的重要因素。我们在准备目的细胞前,通过预实验确定了接种的最佳浓度,使之在传代后24 h时达到对数生长期,让大多数细胞在转染期内完成有丝分裂,从而提高转染效率。这些因素的优化是本实验能够显著提高转染效率的基本前提。
在优选了这些基本转染条件后,最重要的问题就是如何确定收集病毒液的最佳时间。因为包装细胞扩增过程中培养液中的病毒滴度会随细胞增殖而不断升高,但同时培养液的营养条件也不断下降。病毒滴度上升显然有利于提高转染率,但营养条件下降不利于目的细胞增殖,从而不利于提高转染率。因此,选择一个既能保证具有较高的病毒滴度,又具有良好的营养条件的病毒液收集时间点至关重要。本实验中,我们系统地比较了不同时间点(12 h、24 h、36 h和48 h)收集病毒上清对BMSCs转染效率的影响。结果表明,24 h收集的病毒液转染效率最高,一次转染的阳性率已超过60%,明显高于以往报道的结果,说明24 h时,PG13细胞分泌的病毒数量与营养水平之间达到了相对平衡。36 h和48 h收集的病毒液虽然病毒滴度可能高于24 h,但其培养液的营养条件下降,所以转染率也随之下降,而对12 h的病毒液来讲,尽管其培养条件最好,但因为病毒滴度太低也不利于转染效率的提高,这与我们预想的结果基本一致。
为进一步提高转染率,本实验还尝试对目的细胞进行再次转染,两次转染时间仅相差6 h,以免间隔时间过长,目的细胞融合发生接触抑制,影响转染效果。根据我们的观察结果,按照以上方法对目的细胞进行两次转染后,即能达到较高转染率 (70%以上),对于一般的研究来讲已不必再作筛选。若选用小剂量嘌呤霉素作短暂筛选(6 h以内),通常情况下也不会对目的细胞造成太大影响,并且最终可使转染率达到80%以上,完全能够满足组织工程对标记后种子细胞阳性率和功能方面的要求。为较全面地明确这种优化的细胞标记技术在其他细胞中应用的可行性,我们又对组织工程中较为常用的ADSCs、FBs进行同样的EGFP基因转染标记。初步结果表明,该技术完全适用于其他干细胞或成熟分化细胞,说明本实验建立的方法具有普遍适用性,可用于组织工程中多种种子细胞的标记。
综上所述,本实验通过研究影响EGFP逆转录病毒表达系统转染活细胞效率的主要相关参数,建立了一种稳定高效的活细胞EGFP标记技术,以该技术标记成体干细胞和成熟分化细胞均取得较高转染率,而且转染后细胞基本保持了原有细胞的生长代谢及生物学特性。因此,该技术的建立可为研究组织工程种子细胞的体内外转归及细胞间相互作用提供稳定、直观的检测手段。
[1] Prasher DC,Eckenrode VK,Ward WW,et al.Primary structure of the Aequorea victoria green-fluorescent protein[J].Gene,1992, 111(2):229-236.
[2] Blerhuizen MF,Westermany Y,Visser TP,et al.Enhanced green fluorescent protein as selectable marker of retroviral mediated gene transfer in immature hematopoietic bone marrow cells[J].Blood, 1997,90(9):3304-3315.
[3] 傅建新,白霞,王玮,等.流式细胞术快速测定逆转录病毒滴度的研究[J].苏州大学学报(医学版),2002,22(1):30-33.
[4] 李科成,常强,鲁峰,等.三种示踪技术标记人脂肪组织来源干细胞的对照研究[J].南方医科大学学报,2011,31(4):582-586.
[5] 陈子秋,郭伟韬.绿色荧光蛋白在细胞标记及活体示踪领域的应用[J].中山大学研究生学刊(自然科学与医学版),2010,31(2): 15-20.
[6] 宗兆文,程天民.绿色荧光蛋白标记在干细胞移植中的应用[J].中国组织工程研究与临床康复,2006,10(29):141-143.
[7] Cashion LM,Bare LA,Harvey S,et al.Use of enhanced green fluorescent protein to optimize and quantitate infection of target cells with recombinant retroviruses[J].Biotechniques,1999,26(5): 924-932.
[8] Macdonald C,Walker S,Watts M,et al.Effect of changes in expression of the amphotropic retroviral receptor PiT-2 on transduction efficiency and viral titer:implications for gene therapy[J]. Hum Gene Ther,2000,11(4):587-599.
The Effectiveness of Labeling Technique of Enhanced Green Fluorescent Protein by Transfection into Living Cell
LU Xiaojie1,ZHOU Guangdong2,MA Lijun3,LIU Xia4,CAO Yilin2,4.1 General Hospital of Second Artillery,Beijing 100088, China;2 Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China;3 Renji Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200001,China;4 Plastic Surgery Hospital, Chinese Academy of Medical Sciences,Beijing 100144,China.Corresponding author:ZHOU Guangdong (E-mail: guangdongzhou@126.com).
Objective To explore the vital parameters which affect transfection efficiency of Enhanced Green Fluorescent Protein (EGFP)retrovirus expression system in living cells and to establish a stable and effective labeling technique of living cells.Methods PG13 cells with EGFP retrovirus vector were expanded in vitro and the supernatant was respectively collected at 12 h,24 h,36 h,48 h for the retrovirus transfection of BMSCs.The transfection efficiencies of retrovirus in BMSCs were detected by flow cytometer and fluorescent microscope to confirm the optimal collection time of the retrovirus supernatant.BMSCs were transfected twice by the optimal supernatant and then were selected by low-dose puromycin for 6 h. Transfection efficiency and cell vitality were detected to evaluate the effect of transfection.ADSCs and FBs were transfected with optimal condition to explore the feasibility of labeling technique in other stem cells or differentiated cells.Results According to the results of flow cytometer and fluorescent microscope,the retrovirus supernatant collected at 24 h reached the highest transfection efficiency of(64.56±2.53)%.The high transfection efficiency was also reached(56.98±3.22)%at 36 h while relatively low at 12 h and 48 h,(47.39±1.82)%and (37.84±1.77)%.After transfected twice and selected,over 80% BMSCs expressed EGFP with fine cell vitality and morphology.Using this transfection methods,ADSCs and FBs weretransfected likewise and both of them reached high transfection efficiencies of over 80%.Conclusion This study established a stable and effective cell abeling technique of EGFP,which can be widely used for the related research of cell tracing and cell interaction in tissue engineering.
Enhanced Green Fluorescent Protein;Retrovirus;Cell labeling;Tissue engineering
Q813.1+2
A
1673-0364(2011)04-0181-05
2011年7月19日;
2011年8月14日)
10.3969/j.issn.1673-0364.2011.05.001
国家自然科学基金(30300353)。
100088 北京市 中国人民解放军第二炮兵总医院(吕晓杰);200011 上海市 上海交通大学医学院附属第九人民医院整复外科(周广东,曹谊林);200001 上海市 上海交通大学医学院附属仁济医院 (马俐君);100044 北京市 中国医学科学院整形外科医院(曹谊林、刘霞)。
通迅作者:周广东(E-mail:guangdongzhou@126.com)。
