米曲霉HDF-7蛋白酶的分离纯化及酶学性质研究
2011-03-19于艳颖董海莉平文祥葛菁萍
于艳颖,董海莉,平文祥,葛菁萍
(黑龙江大学 a.生命科学学院;b.微生物黑龙江省重点实验室,哈尔滨 150080)
0 引 言
豆酱是我国四大传统发酵豆制品之一,含有人体所需的多种营养成分,具有许多独特的生理调节功能,如抑制胆固醇、抗癌作用[1]、降血压[2]、溶解血栓、抗氧化性,此外豆酱还被认为具有防止胃溃疡的功效[3]。人们还期望豆酱作为促进分泌胰岛素的食品,起到预防和改善糖尿病症和抑制癌细胞增殖的效果[4]。
豆酱的发酵主要依赖米曲霉所产生的蛋白酶、淀粉酶的作用。研究发现,米曲霉分泌的蛋白酶主要以中性蛋白酶和碱性蛋白酶为主[5],特别是碱性蛋白酶的含量占40%~60%,蛋白酶能将豆酱中的大豆蛋白质水解成低分子蛋白胨、朊、多肽及氨基酸,使其成为营养丰富、含有鲜味的调味品[6]。本课题组从农家自酿豆酱中分离得到一株蛋白酶活力较高的米曲霉菌株HDF-7。本文报道了该米曲霉蛋白酶的分离纯化及其酶学性质的研究。
1 材料和方法
1.1 菌株
米曲霉HDF-7(由黑龙江大学微生物重点实验室从豆酱中分离并保存)。
1.2 发酵培养基
葡萄糖10 g,大豆蛋白胨5 g,麦芽浸膏3 g,酵母提取物3 g,蒸馏水1 000 mL,pH值自然, 121℃灭菌20 min[7]。
1.3 不同培养时间对菌体产酶的影响
制备单孢子悬液,1%接种于发酵培养基, 28℃180 r/min摇床培养。每24 h取1次样,过滤获得粗酶液,测定其酶活力。绘制时间-蛋白酶活力曲线(图1),以确定最佳产酶时间。
1.4 分析方法[8]
蛋白酶的活力测定(Folin法):在40℃下1 min水解干酪素产生1 μ g酪氨酸,定义为一个蛋白酶活力单位。
蛋白质浓度的测定:Braford法。
1.5 蛋白酶的分离纯化
1.5.1 (NH4)2SO4盐析曲线的制备
分别在10 mL粗酶液中缓慢逐步加入不同重量的固体硫酸铵,使其饱和度分别达到 0%, 10%,20%,30%,40%,50%,60%,70%, 80%(W/V)。边加边混匀,不得剧烈搅拌,避免产生气泡,直至硫酸铵完全溶解,置于4℃冰箱24 h。4℃,10 000 r/min离心20 min,测定上清的剩余酶活力,确定硫酸铵沉淀蛋白酶的最适饱和度。
1.5.2 Sephadex G-50层析
将盐析沉淀溶解于0.05 mol/L Tris-HCl缓冲液(pH7.2),过滤去除不溶物。采用Sephadex G-50层析除盐,柱床规格为 Φ 1.6×20 cm,先用0.05 mol/L T ris-HCl缓冲液 (pH7.2)平衡至流出液恒定在pH7.2。上样量为5 mL,用 0.05 mol/L Tris-HCl缓冲液 (pH7.2)洗脱,洗脱流量控制在2 mL/min。检测洗脱液的蛋白质浓度和酶活力,收集酶活力峰。
1.6 电泳分析[9]
SDS聚丙烯酰胺凝胶电泳。电泳条件:分离胶12%,浓缩胶4%,电泳电压恒定为160 V。
1.7 酶学性质研究
1.7.1 反应最适温度
在不同的温度下 (30℃,35℃,40℃,45℃,50℃,55℃,60℃,65℃)测定蛋白酶活力,将最高的酶活力定义为100%,计算不同温度条件下蛋白酶的相对酶活。
1.7.2 反应最适pH值
不同pH值条件下 (pH值为3、4、5、6、7、8、9、10)进行反应,测定蛋白酶活力,将最高的酶活力定义为100%,计算不同pH值条件下蛋白酶的相对酶活。
1.7.3 热稳定性
将酶液分别置于不同的温度条件下 (20℃, 30℃,40℃,50℃,60℃)保温不同的时间 (0 min,20 min,40 min,60 min,80 min,100 min,120 min)后,立即在0℃冰浴中冷却,然后在40℃下测酶活,将最高的酶活力定义为100%,分别计算不同温度条件下蛋白酶的剩余酶活与最高酶活的比值。
1.7.4 pH稳定性
将酶液分别在不同pH值的缓冲液(pH3.0~10.0)中稀释,40℃保温2 h后,将体系的pH值调整至酶反应的最适pH值,测定剩余的酶活力,将最高的酶活力定义为100%,分别计算不同pH值条件下蛋白酶的剩余酶活与最高酶活的比值。
1.7.5 各种金属离子、NH+4对蛋白酶活力的影响
在蛋白酶与其底物进行反应体系中,分别加入不同的金属离子 (Li+,Na+,Mg2+,Al3+,K+, Ca2+,Fe2+,Fe3+,Mn2+,Zn2+,Cu2+,Ag+)、NH+4,并使其离子的最终浓度为0.01 mol/L,以不加金属离子的反应体系中的酶活力定义为100%,分别测定加入金属离子后各反应体系中蛋白酶的相对酶活。
1.7.6 酪蛋白浓度对蛋白酶水解速度的影响-Km的测定
以不同浓度的酪蛋白为底物,与提取的蛋白酶反应,在标准条件下测定酶活力。酪蛋白浓度依次为0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mg/mL,以浓度的倒数1/[S]为横坐标,反应速率的倒数1/v为纵坐标作Lineweaver -Burk图。
2 结果与讨论
2.1 不同培养时间对菌体产酶的影响
将米曲霉接种于液体发酵培养基,于不同时间取样测定蛋白酶活性。结果见图1。该菌在培养1~2 d蛋白酶活性没有明显变化,之后酶活急剧升高,在3~4 d酶活达到最高峰并保持相对稳定,在培养4 d后,随着底物含量的减少,蛋白酶活性也逐渐降低。据此确定最佳的培养时间为3 d。
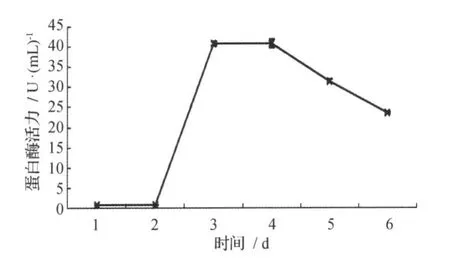
图1 不同培养时间对菌体产酶的影响Fig.1 Effects of different incubation time on Aspergillus oryzae protease activity
2.2 (NH4)2SO4盐析饱和度的确定
盐析法的优点是在常温沉淀过程中不会造成酶的失活,沉淀物在室温下长时间放置也不易失活。(NH4)2SO4是较为常用的盐析剂,溶解的温度系数小,在较低温度下其溶解度较高,浓度高时也不易引起蛋白质生物活性的丧失。(NH4)2SO4沉蛋白酶的盐析曲线见图2。由图2可见,(NH4)2SO4沉淀蛋白酶的饱和度应为70%。
2.3 Sephadex G-50层析

图2 硫酸铵盐析曲线Fig.2 Ammonium sulfate salting-out curve
Sephadex G-50的分离范围是1 000~30 000 Da,主要用于肽类分离、脱盐和分子量鉴定。盐析沉淀复溶于缓冲液中,经过Sephadex G-50凝胶层析得到洗脱峰1和2(图3),根据凝胶过滤的原理,大分子先出来,小分子后出来,可以断定洗脱峰1的分子量大于洗脱峰2的分子量,分别收集洗脱峰1和2,测定酶活,发现酶活主要集中在洗脱峰1上。保留洗脱峰1的收集液,留待下一步检测纯度并鉴定分子量。
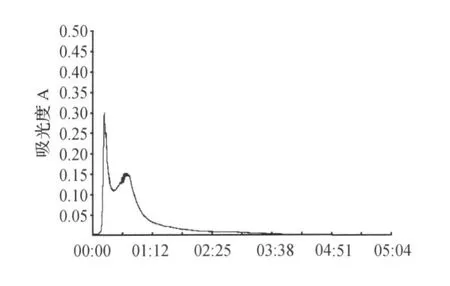
图3 Sephadex G-50洗脱图谱Fig.3 Sephadex G-50 molecular sieve chromatography
2.4 蛋白酶纯化总过程
30 mL粗酶液经70%饱和 (NH4)2SO4沉淀,结果酶的比活力为127.56 U/mg,纯化了1.08倍,回收率55.29%,说明在沉淀的过程中蛋白酶会有一定的损失,再经过Sephadex G-50凝胶过滤层析后,比活力为343.04 U/mg,被纯化了2.89倍,活力回收率为5.13%。整个纯化过程见表1。
2.5 SDS聚丙烯酰胺凝胶电泳
将纯化后的蛋白酶进行SDS聚丙烯酰胺凝胶电泳,经染色脱色后,得到图4。如图4所示,泳道M是蛋白质分子量标准,泳道1是已纯化的蛋白酶,得到单一条带,说明该蛋白酶已经达到电泳纯,并且推测该蛋白酶的相对分子质量约为 30 KDa。
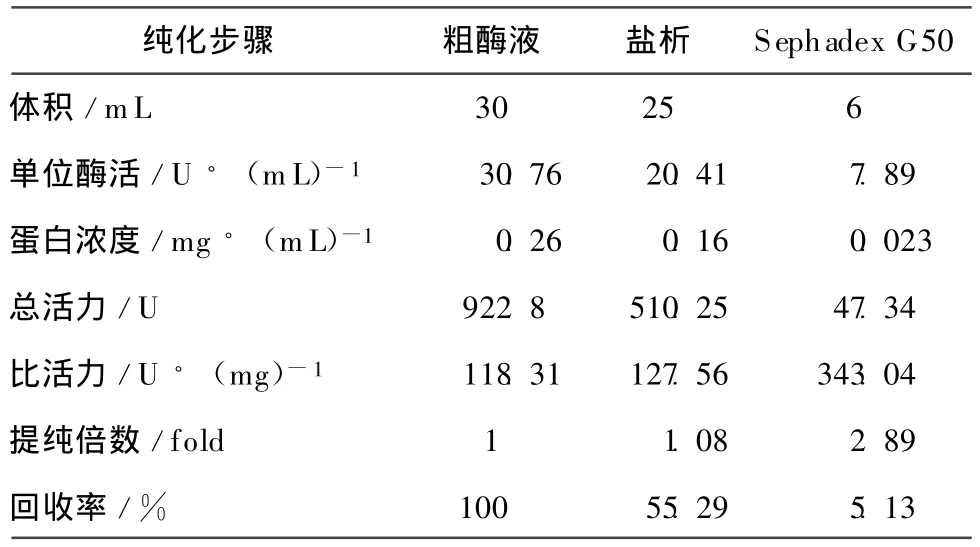
表1 纯化过程总表Table 1 Purification of protease from Aspergillus oryzae
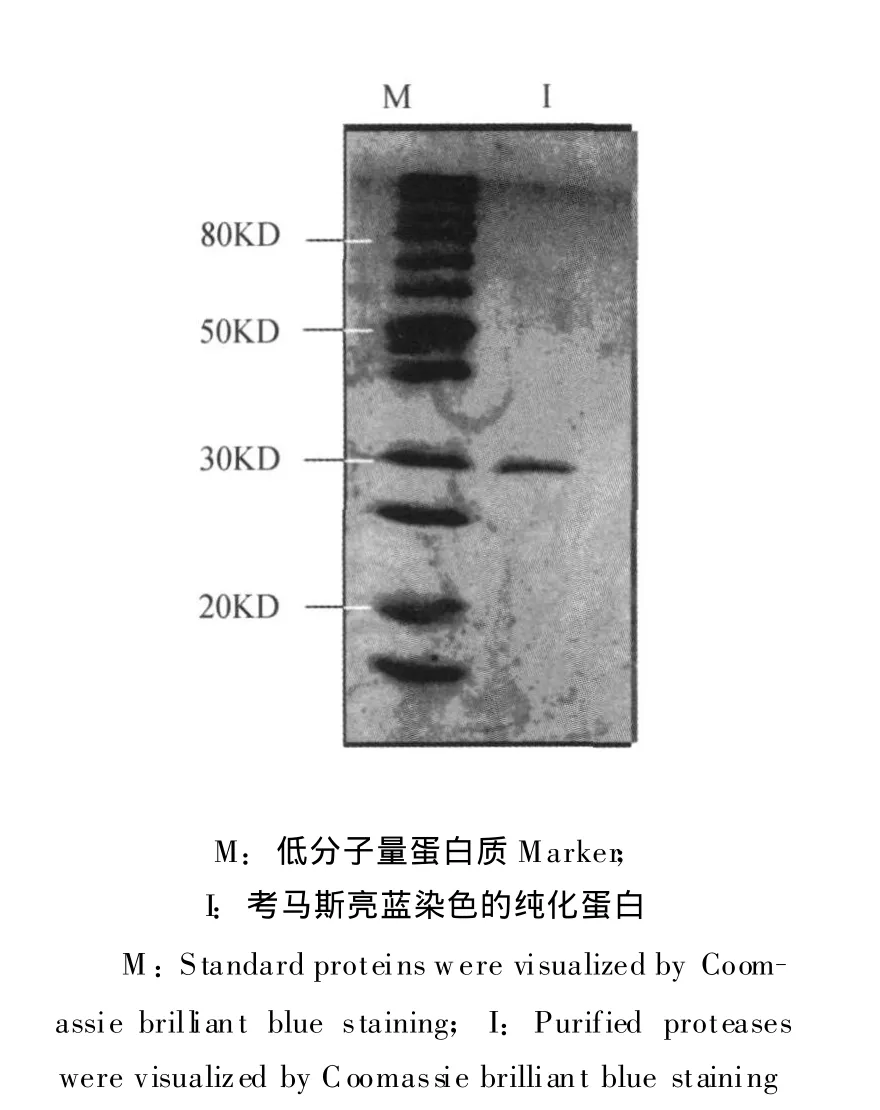
图4 SDS-PAGE电泳图Fig.4 SDS-PAGE pattern of the purified protease from Aspergillus oryzae
2.6 蛋白酶的最适反应温度
在其他因素不变的情况下,在不同的温度下将纯化的蛋白酶和底物反应10 min,检测蛋白酶活性,结果见图5。由图5可见,该蛋白酶的最适反应温度为50℃,此时酶的催化反应活性最高。30℃时酶的活性受低温的抑制,不能充分发挥酶的活性;60℃及以上的温度时,温度过高使酶变性失活造成酶的活性下降。文献 [10]报道,米曲霉在50℃时水解酪蛋白的速率是最快的。
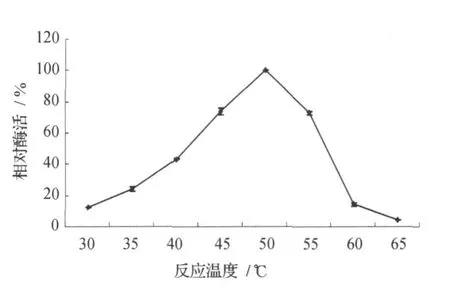
图5 反应温度对蛋白酶活性的影响Fig.5 Effects of reaction temperature on the protease activity
2.7 蛋白酶的热稳定性
将酶液在不同的温度下分别保温不同的时间后,立即冰浴冷却,然后再与底物进行酶反应,测定酶活,以剩余的酶活性作为评价酶的热稳定性的指标。结果见图6。该蛋白酶在20℃下相对稳定, 30℃处理40 min后,酶活力仍保持66.7%;40℃处理20 min后,酶活力保持59.92%;50℃处理20 min后,酶活力保持了52.67%;60℃处理20 min后,酶活力只保持了45.43%。与米曲霉M3[11]所产蛋白酶相比,该蛋白酶不耐热,酶活下降较慢,但是其稳定性仍不如今野曲霉[12]。
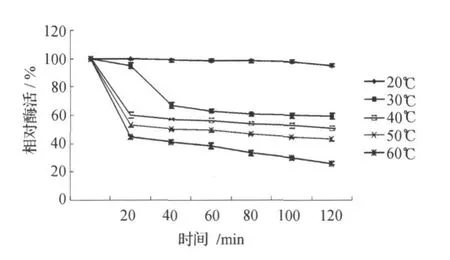
图6 蛋白酶的热稳定性Fig.6 Temperature stability of protease
2.8 蛋白酶的最适反应pH
在其他因素不变的情况下,不同的pH值缓冲液进行酶与底物的反应,检测酶活性,图7表明, pH3~5时,酶活只有60%~70%,随着 pH增大,酶活逐渐提高,pH7.0时酶活最高,之后随着pH增大,酶活显著降低,pH10时酶活只有48.92%。说明该蛋白酶的最适反应pH值为7.0,在酸性或碱性条件下酶活均较低,说明该蛋白酶属于中性蛋白酶。
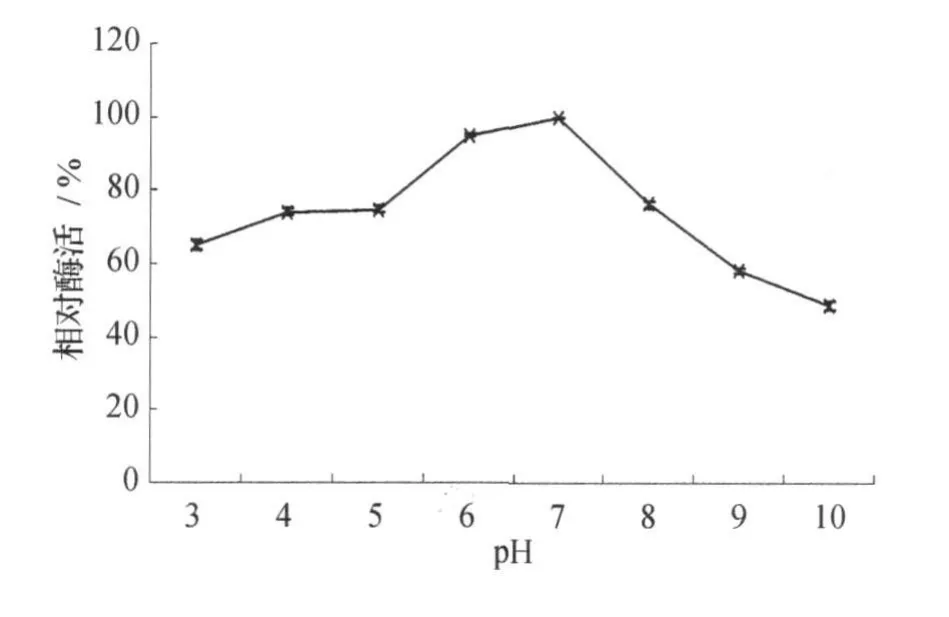
图7 pH值对蛋白酶活性的影响Fig.7 Effects of reaction pH on the protease activity
2.9 蛋白酶的pH稳定性
在其他因素不变的情况下,分别取用不同pH的缓冲液稀释的酶液置于40℃恒温水浴中保温2 h后,用pH值为7.0的缓冲液适当稀释,使其终体积均相等,pH均为7.0,再进行酶反应,测定其剩余酶活,将最高的酶活力定义为100%,分别计算不同温度条件下蛋白酶的剩余酶活与最高酶活的比值。结果如图8,该蛋白酶在pH3.0~6.0时剩余酶活逐渐上升,在pH6.0~8.0时相对稳定, pH 7.0时酶活最高,pH8.0~10.0时酶活缓缓下降。说明该蛋白酶适宜在中性条件下保存。该蛋白酶pH稳定性与米曲霉M3相当,比米曲霉311、沪酿3.042、今野曲霉[13]稳定范围要宽。
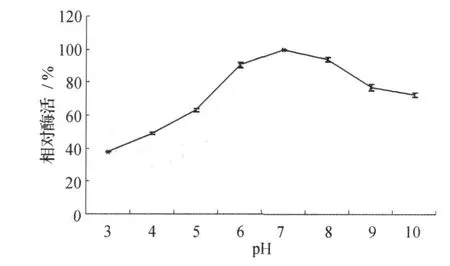
图8 蛋白酶的pH稳定性Fig.8 pH stability of the protease
2.10 某些金属离子、NH+4对酶活性的影响
在其他因素不变的情况下,在酶液中加入各种金属离子和NH+4使其浓度均达0.01 mol/L,以不加金属离子的酶活为100%,测定其相对酶活。结果见图9。Ca2+,Mn2+,Zn2+对该蛋白酶有激活作用,其中Mn2+的激活作用最明显;NH+4,K+, Ag+对酶活影响不大;Li+,Na+,Mg2+,Al3+, Fe2+,Fe3+,Cu2+对该蛋白酶有抑制作用,其中Cu2+的抑制作用最明显。Ca2+,Zn2+对大多数中性蛋白酶都有激活作用,Ca2+常被添加在培养基中促进蛋白酶的产生[14]。
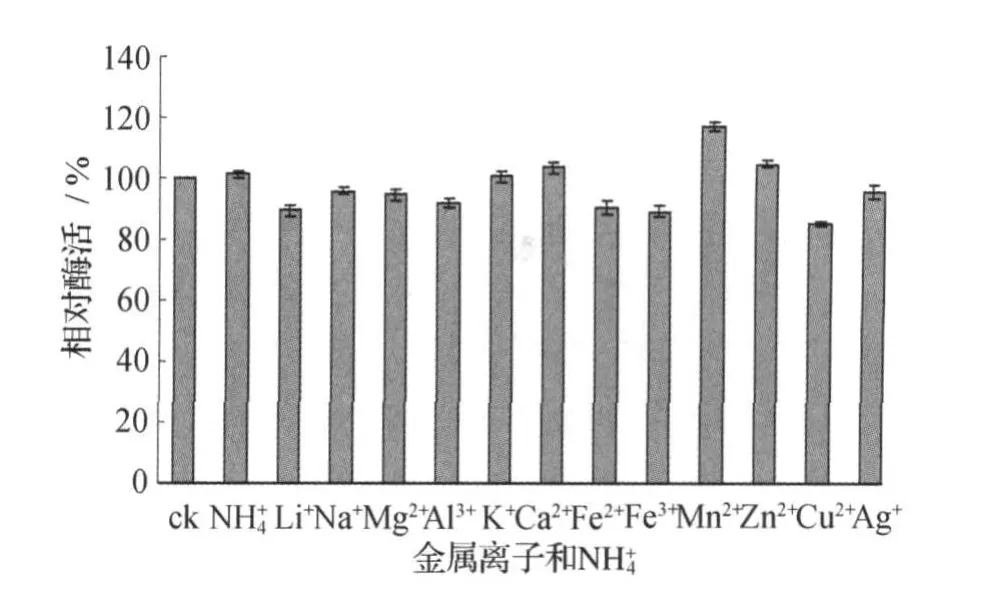
图9 各种金属离子、NH4+对蛋白酶活性的影响Fig.9 Effect of metal ions and NH4+on protease activity
2.11 酪蛋白浓度对蛋白酶水解速度的影响-Km的测定
以不同浓度的酪蛋白为底物,与纯化的蛋白酶反应,其他因素不变,测定酶活力。以浓度的倒数1/[S]为横坐标,反应速率的倒数1/v为纵坐标作图,见图 10。以酪蛋白为底物时,Km值为78 μ g/mL,最大反应速度Vmax为6.29 μ g/min,米氏常数数值等于酶促反应最大速度的1/2时所需的底物浓度。它表示酶和底物之间的亲和能力,Km值越大,说明需要更多的底物才能达到最大反应速度的1/2,即酶的亲和能力越弱,反之亦然。该酶的米氏常数较小,说明其对酪蛋白的亲和力较强。
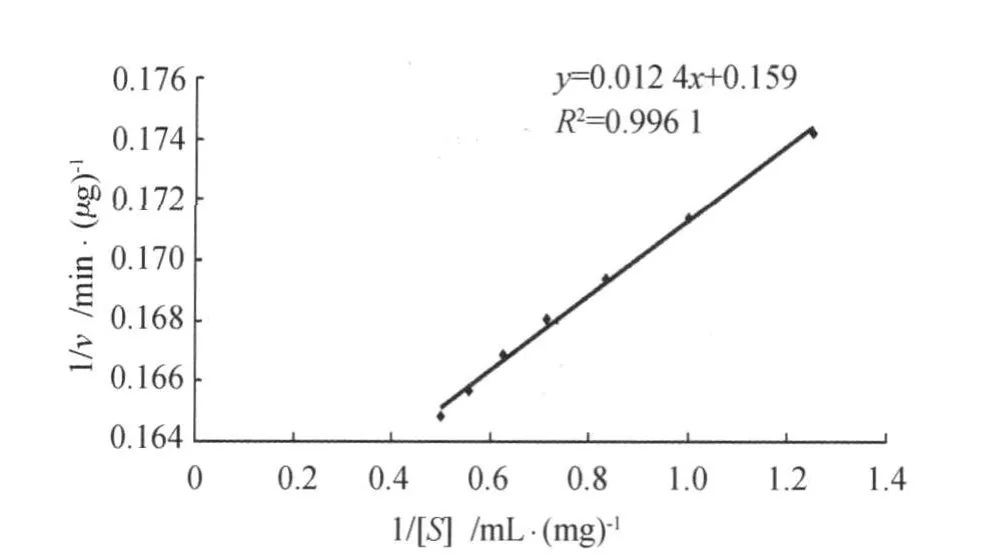
图10 蛋白酶的Lineweaver-Burk图Fig.10 Lineweaver-Burk's plot of protease
3 结 论
试验就米曲霉菌种HDF-7所产蛋白酶的分离纯化及部分酶学性质进行了研究。结果表明该米曲霉所产蛋白酶硫酸铵沉淀的最佳饱和度为70%,经硫酸铵沉淀和凝胶过滤层析得到电泳纯的蛋白酶,经SDS-PAGE电泳测定其相对分子质量约为30 KDa。最适作用温度为50℃,最适 pH值为7.0;20℃下酶稳定性较好,60℃下处理20 min,酶活减少到1/2以下,说明该酶不耐热,不宜长时间在室温下存放;其pH为6.0~8.0。以酪蛋白为底物时,Km值为 78 μ g/mL,最大反应速度Vmax=6.29 μ g/min。Ca2+,Mn2+,Zn2+对该蛋白酶有激活作用,其中Mn2+的激活作用最明显; NH+4,K+,Ag+对酶活影响不大;Li+,Na+, Mg2+,Al3+,Fe2+,Fe3+,Cu2+对该蛋白酶有抑制作用,其中Cu2+的抑制作用最明显。
[1]Barnes,S.,Grubbs,C.,Setchell,K.D.,et al.Soybeans inhibit mammary tumors in models of breast cancer[J].Prog.Clin.Biol.,1990,347:239-253.
[2]Emiko,Kinoshita.,Jun,Yamakoshi.,et al.Purification and identification of an angiotensin I-converting enzyme inhibitor from soy sauce[J].Biosci.Biotech. Biochem,1993,57(7):1 107-1 110.
[3]陈九武,杨 军.发酵豆制品的保健功能 [J].大豆通报,1998,(4):25-26.
[4]五明纪春,陈晓光,刘宇峰.大豆豆酱、酱油中褐色色素的生理功能作用[J].大豆通报,2001,(1):28-29.
[5]孙常雁,马 莺,李德海,等.自然发酵黄豆酱酱曲培养过程中蛋白酶的形成及蛋白质的分解 [J].食品科技,2007,(8):188-192.
[6]胡学智,王 俊.蛋白酶生产和应用的进展[J].工业微生物,2008,(4):49-60.
[7]张建华.曲霉型豆豉发酵机理及其功能性的研究[D].北京:中国农业大学,博士学位论文,2003.
[8]于洪梅.风味粟米酱米曲霉的分离筛选及诱变育种的研究[D].长春:吉林大学,硕士学位论文,2007.
[9]高 莹.副干酪乳杆菌 (Lactobacillus paracasei) HD1.7产肽条件优化及肽类分离研究[D].哈尔滨:黑龙江大学,硕士学位论文,2008.
[10]张 青,许学书,谢静莉.米曲霉蛋白酶动力学特性研究[J].食品科学,2007,28(6):213-217.
[11]邓 靖,林亲录,赵谋明,等.米曲霉M3中性蛋白酶的提取及酶学特性研究[J].中国食品添加剂, 2005,(2):21-24.
[12]张淑娟,田利强.米曲霉菌今野菌株所产蛋白酶性质的研究[J].中国调味品,2001,(11):15-17.
[13]李素俭,卫亚红,程丽娟,等.三株酱油曲霉蛋白酶特性的研究[J].中国酿造,2000,(1):9-10.
[14]Ruohang Wang,Rocky Chau Sing Law,Colin Webb. Protease production and conidiation byAspergillus oryzae in flour fermentation[J].Process Biochemistry,2005,40,(1):217-227.
