μ阿片样受体 A118G基因多态性对男性手术患者电刺激痛觉敏感性的影响
2011-03-19张豪勇阚全程常琰子王中玉袁静静储勤军
张 卫,张豪勇,阚全程,常琰子,王中玉,袁静静,储勤军
1)郑州大学第一附属医院麻醉科郑州 450052 2)郑州大学第一附属医院临床药理基地;河南省高等学校临床医学重点学科开放实验室郑州 450052
#通讯作者,男,1963年9月生,博士,教授,主任医师,研究方向:免疫药理,E-mail:kanquancheng2008@163.com
人体对疼痛刺激的反应存在巨大的个体差异,越来越多的研究[1]表明遗传因素是产生这种差异的重要原因。μ阿片样受体(mu-opioid receptoru, OPRM1)A118G多态性是研究最多的位点,位于外显子 1第 118位,导致第 40位氨基酸由天冬酰胺变为天冬氨酸[2]。研究[3]证实OPRM1 A118G是一个有意义的突变,不仅与吗啡等阿片类药物效应有关,也与对疼痛刺激反应的个体差异有关。目前,有关OPRM1 A118G多态性对不同实验性疼痛模型的疼痛敏感性指标痛阈和耐痛阈的影响尚无定论[1,4];研究[5]表明在电刺激测痛条件下女性患者中携带突变等位基因的个体比野生型纯合子耐痛阈降低,但由于痛觉敏感性性别差异的存在[6],OPRM 1 A118G基因多态性对男性电刺激痛觉敏感性的影响尚不清楚。该研究选用电刺激痛指标评价男性手术患者OPRM1 A118G多态性对痛阈和耐痛阈的影响。
1 对象与方法
1.1 对象 2009年 10月至 2010年 8月择期拟行开腹手术男性患者 132例(其中肾占位切除术 68例,肝占位切除术 54例,腹膜后占位切除术10例),汉族,年龄20~60岁,体质指数18~24 kg/m2,ASAⅠ或Ⅱ级。既往无吸烟、酗酒史,无心血管疾病、肾脏疾病、肝脏疾病和糖尿病病史,无慢性疼痛史及无使用镇痛药物史,无精神系统疾患史和家族史。该研究经郑州大学第一附属医院伦理委员会批准,所有患者均签署知情同意书。
1.2 基因型检测 采集患者外周静脉血样 2m L,采用酚-氯仿法抽提DNA。采用聚合酶链反应-限制性片段长度多态性技术(PCR-RFLP)进行OPRM 1 A118G多态性位点的检测。引物由大连宝生物有限公司合成。引物序列:上游5'-GGTCAACTTGTC CCACTTAGATCGC-3',下游5'-AATCACATACAT GACCAGGAAGTTT-3',扩增包含有118位核苷酸多态性位点的193 bp的基因片段。PCR反应体系: 2×PCR Taq Mix 10μL,10 nmol/L上下游引物各1 μL,DNA模板2μL,最后加超纯水至20μL。PCR反应条件:94℃预变性3 min;94℃变性30 s,62℃退火60 s,72℃延伸 60 s,共进行 38个循环;然后72℃延伸 10min,4℃保存。使用限制性内切酶切PCR反应产物。酶切反应体系:内切酶Bsh1236Ⅰ(北京康为生物有限公司)2μL,Buffer R 2μL,PCR产物10μL,加无菌去离子水 18μL,37°C水浴12 h。酶切反应完毕,取酶切产物 5μL,以核酸染料(大连宝生物有限公司)为染色剂,于20 g/L琼脂糖凝胶上电泳60 min(0.5×TBE电泳液,电压5 V/ cm),分子量标准为50 bp DNA Ladder。取PCR扩增产物进行测序,验证分型结果。根据 OPRM1 A118G基因型检测结果将患者分为野生型纯合子(A/A)、突变型杂合子(A/G)和突变型纯合子(G/ G)3组。
1.3 痛阈和耐痛阈测定 采用MEB-5100型电刺激仪(日本光电公司)测定患者的痛阈和耐痛阈。患者取仰卧位,两电极固定在右侧上臂三角肌部位,两电极均1 cm×1 cm大小,电极间距离1.5 cm,刺激频率50 Hz,波宽0.5 ms,电压220 V,刺激个数为64个。电流强度从 0mA开始,每次递增 0.2 mA,逐渐调大输出电流强度并询问和观察患者的反应,分别记录患者开始有轻微刺痛感觉时的电流值和不能耐受疼痛时的电流值,即为痛阈和耐痛阈。重复测定3次。
1.4 统计学处理 采用SPSS 10.0分析,3组患者年龄、体质指数、痛阈和耐痛阈的比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1 各基因型患者一般情况 OPRM1 A118G基因分型后A/A型56例,A/G型60例,G/G型16例,G等位基因频率为 34.8%。各基因型患者年龄和体质指数比较见表 1。

表1 各基因型患者年龄和体质指数的比较
2.2 各基因型患者痛阈和耐痛阈比较 见表2。
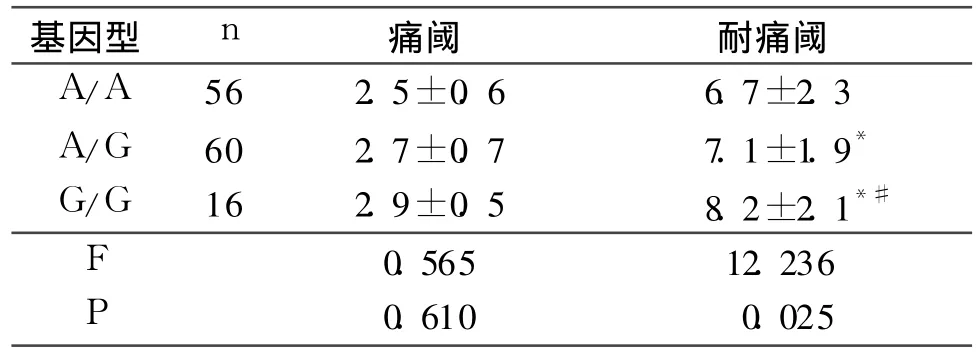
表2 各基因型患者痛阈和耐痛阈的比较 mA
3 讨论
该研究中G等位基因频率为34.8%,与Tan等[7]报道的中国人G等位基因频率约35.1%基本一致。
临床实验性疼痛研究[8]中常用的痛刺激方法包括热冷刺激、机械压力、化学刺激、电刺激和缺血刺激,其中电刺激起始、终止快,可重复,操作方便,是较理想的方法 。研究[9-10]表明对正常人和疼痛患者的电痛阈进行比较,疼痛患者的电痛阈显著低于正常人,电痛阈的测量具有很好的稳定性和可靠性[9],经皮神经电刺激法并不会升高痛阈值[10]。因此作者选择经皮电刺激测痛阈与耐痛阈,电刺激部位均选择右侧上臂三角肌中部,统一标准进行比较。Jamie等[6]研究认为不同性别患者痛阈、耐痛阈存在差异。该研究病例均为男性,排除了性别差异的影响。
该研究结果显示:G/G基因型患者耐痛阈高于A/A基因型和A/G基因型,A/G基因型患者耐痛阈高于A/A基因型。提示OPRM 1 A118G等位基因突变可导致男性手术患者电刺激痛的耐痛阈升高。OPRM1基因突变影响痛觉敏感性的机制目前尚未清楚。Bond等[11]报道 G等位基因纯合子个体OPRM1与β-内啡肽的亲和力是A等位基因纯合子的3倍,可能是由于OPRM1基因突变致β-内啡肽与 μ阿片受体亲和力增加,进而导致突变等位基因携带个体产生更加持久有效的内源性抑制疼痛作用。研究[1]表明,OPRM 1 A118G等位基因A/G杂合子和G/G纯合子的压力痛痛阈和耐痛阈均高于A/A纯合子,与该研究结果基本一致。结果还显示,OPRM1 A118G基因多态性对电刺激痛阈无明显影响,可能与测量痛阈的刺激强度远低于耐痛阈的刺激强度,兴奋的传入神经纤维不同有关。此外,疼痛受多种遗传因素与非遗传因素调控,目前已知的OPRM1基因突变位点有 40多个[12],影响疼痛的非遗传因素包括心理生理状态等,仅按A118G基因型分组还不够科学。
作者仅就中国人群常见的单个基因的单个突变位点进行分析,未能完全排除其他相关因素的干扰,尚无法综合评价疼痛感知的个体差异。这可能是本试验中痛阈和耐痛阈无法平行改变的原因。所以,疼痛的多模式以及联合多基因的研究很有必要。
[1]Fillingim RB,Kap lan L,Staud R,et al.The A 118G single nucleotide polymorphism of the mu-opioid recep tor gene (OPRM 1)is associated with p ressure pain sensitivity in humans[J].JPain,2005,6(3):159
[2]Pasternak GW.Mu ltipleopiate receptors:déjàvu all over again[J].Neuropharmacology,2004,47(Suppl 1):312
[3]Sia AT,Lim Y,Lim EC,et al.A 118G single nucleotide polymorphism of human mu-opioid recep tor gene in fluences pain perception and patient-controlled intravenous morphine consumption after intrathecalmorphine for postcesareanan algesia[J].Anesthesiology,2008,109(3):520
[4]王中玉,张卫,阚全程,等.μ阿片受体 A118G基因多态性对妇科手术患者电刺激痛阈、耐痛阈的影响[J].中华麻醉学杂志,2010,30(2):159
[5]Zhang W,Chang YZ,Kan QC,et al.Association of human m icro-opioid receptor gene polymorphism A 118G with fentanyl analgesia consumption in Chinese gynaecological patients[J].Anaesthesia,2010,65(2):130
[6]Rhudy JL,Bartley EJ,W illiams AE,et al.Are there sex differences in affectivemodulation of spinalnociception and pain?[J].JPain,2010,11(12):1
[7]Tan EC,Tan CH,Karupathivan U,etal.Mu opioid recep-tor gene polymorphisms and heroin dependence in Asian popu lations[J].Neuroreport,2003,14(4):569
[8]张立生,刘小立.现代疼痛学[M].石家庄:河北科学技术出版社,1999:165
[9]Lund I,Lundeberg T,Kowalski J,etal.Evaluation of variations in sensory and pain threshold assessments by elect rocutaneous stimu lation[J].Physiother Theory Pract, 2005,21(2):81
[10]Schäfer E,Finkensiep H,Kaup M.Effectof transcutaneous electrical nerve stimulation on pain perception threshold of human teeth:a double-blind,placebo-controlled study[J]. Clin Oral Investig,2000,4(2):81
[11]Bond C,LaForge KS,Tian M,et al.Single-nucleotide polymorphism in the human mu opioid recep tor gene alters beta-endorphin binding and activity:possible implications for opiate addiction[J].Proc Natl Acad Sci USA,1998,95 (16):9608
[12]Hoehe MR,Kopke K,Wendel B,etal.Sequence variability and candidate gene analysis in complex disease:association of mu opioid receptor gene variation with substance dependence[J].Hum Mol Genet,2000,9(19):2895
