饲料中不同类型的硒对仿刺参幼参生长和免疫指标的影响
2011-03-18王吉桥王志香于红艳姜玉声张剑诚
王吉桥,王志香,于红艳,姜玉声,张剑诚
(1.大连海洋大学生命科学与技术学院,辽宁大连116023;2.大连棒槌岛海产股份有限公司,辽宁大连116100)
饲料中不同类型的硒对仿刺参幼参生长和免疫指标的影响
王吉桥1,王志香1,于红艳1,姜玉声1,张剑诚2
(1.大连海洋大学生命科学与技术学院,辽宁大连116023;2.大连棒槌岛海产股份有限公司,辽宁大连116100)
在水温为13.0~20.0℃、盐度为31.0~32.0和pH为7.5的条件下,将初始体质量为5.36~5.57 g的仿刺参Apostichopus japonicus幼参放养在塑料水槽中(40 L),每箱15头,分别投喂在基础饲料中添加0.4 mg/kg硒粉、富硒酵母、蛋氨酸硒和亚硒酸钠的试验饲料,以未添加硒的基础饲料作为对照组,每个试验组设3个重复。60 d的饲养结果表明:摄食添加硒饲料的仿刺参的增重率、体壁的粗蛋白含量和对饲料中粗蛋白的表观消化率均显著高于对照组(P<0.05),其中摄食添加蛋氨酸硒一组的仿刺参增重最大,摄食添加富硒酵母的次之;摄食添加硒饲料的仿刺参体腔液中超氧化物岐化酶(SOD)和过氧化氢酶(CAT)的活性均高于对照组,但差异不显著(P>0.05),而摄食添加酵母硒组的仿刺参体腔液中酸性磷酸酶(ACP)的活性显著高于对照组(P<0.05)。饲料硒能促进仿刺参的生长,可能与提高饲料蛋白质的消化率有关;饲料硒能提高仿刺参的成活,可能与提高体腔中SOD、CAT和ACP的活性有关。试验表明,饲料中的有机硒能促进仿刺参对饲料蛋白质的消化和积累,进而促进其生长的效果优于无机硒。
仿刺参;饲料;硒;生长;免疫
硒是动物体必需的微量元素,是谷胱甘肽过氧化物酶(GSH-Px)的辅助因子,此酶能减少动物体内过氧化氢、脂肪酰氢过氧化物和脂肪酰乙醇的含量,减少脂肪的氧化。畜禽缺硒会影响其繁殖,但过量的硒对畜禽也有毒性[1]。许多研究表明,鲑科鱼类缺硒时会导致肌营养不良、贫血,甚至死亡[2]。每公斤饲料中添加0.17~2.02 g亚硒酸钠等无机硒和富硒酵母等有机硒,能显著提高草鱼Ctenopharyngdon idella[3]、石斑鱼Epinephelus malabaricus[4]、鲫Carassius auratus gibelio[5]、斑点叉尾鮰Ictalurus punctatus[6]、尼罗罗非鱼Oreochromis niloticus[7]、中国对虾Fenneropenaeus chinensis[8]、凡纳滨对虾Litopenaeus vannamei[9]、中华鳖幼鳖Trionyx sinensis[10]和皱纹盘鲍Haliotis discus hannai Ino[11]等经济水生动物的生长速度、成活率和消化酶活性,增强其免疫力。但是,目前有关在饲料中添加硒对仿刺参Apostichopus japonicus生长和免疫能力的影响尚未见报道,仿刺参饲料中适宜的硒类型和剂量等尚属空白。
仿刺参的营养和药用价值很高,是中国北方海水养殖的新增长点。随着中国经济的发展和人们保健意识的增强,仿刺参的消费量急剧增加,而养殖水域的极大减少又刺激了仿刺参养殖的快速和无序发展,导致病害不断滋生蔓延。滥用抗菌素等化学药物威胁着环境和食品安全。因此,高效、经济、安全且具有免疫增强功能的饲料是仿刺参养殖业可持续发展的物质基础。在饲料中添加适宜类型和剂量的硒是研发增强仿刺参免疫功能饲料的途径之一。目前畜禽和鱼、虾饲料中补充的硒制剂主要有两种,即亚硒酸钠等无机硒和富硒酵母等有机硒。本试验中,作者在饲料中添加亚硒酸钠、酵母硒、蛋氨酸硒和硒粉,探讨硒的剂型对仿刺参生长及免疫能力的影响,旨在为科学配制仿刺参饲料,提高仿刺参养殖的经济和生态效益提供参考。
1 材料与方法
1.1 材料
试验用仿刺参Apostichopus japonicus初始体质量为5.36~5.57 g,取自盘锦市每日集团水产苗种繁育基地。硒粉由北京生化制剂厂生产(硒含量为99.99%);酵母硒(硒含量为100 mg/kg)、蛋氨酸硒(含硒量为1 500 mg/kg)和亚硒酸钠(含硒量为44.7%)分别购自安琪酵母有限公司、浙江伟丰公司和上海生化药品公司。
1.2 方法
1.2.1 试验饲料的配制 基础饲料配方为(均为质量分数):大豆蛋白7.0%,鱼粉11.0%,山药粉30.0%,海泥40.0%,虾糠5.0%,贝壳粉3.8%,酵母1.0%,矿物盐0.7%,黏合剂0.2%,赖氨酸0.36%,蛋氨酸0.37%,苏氨酸0.37%,黄原胶0.2%。
将山药粉在120℃的高压锅内糊化15 min,然后烘干、研磨、粉碎。饲料中所有原料均经100目筛绢过滤,除去上层,混合均匀,做成粉状混合物。投喂前用80℃左右的热水搅拌均匀,置于室内,待酵母发挥作用后即成为松软合适的膏状饲料。饲料中添加黄原胶增稠剂,使饲料不易分散。
试验设置5组,在基础饲料中分别添加0.4 mg/kg酵母硒(第1组)、蛋氨酸硒(第2组)、亚硒酸钠(第3组)和硒粉(第4组)作为`第1~4组试验的饲料,以只投喂基础饲料为对照组(第5组)。用原子吸收光谱法测定海水(0.03~6.00 μg/L)、鱼粉(为0.0013 μg/g)和海泥中的硒含量都极低,不影响饲料中硒的含量。
1.2.2 饲养管理 试验用仿刺参在实验室的水槽中驯养20 d后,选择体质量相近的健康个体分成5组,分别放入40 L的塑料水箱中,每箱15头,投喂5种饲料,每种饲料设3个平行。
试验期间,水箱内24 h充气。水温为13.0~20.0℃,盐度为31.0~32.0,pH为7.5左右。采用自然光照,隔天换水100%。在换水的当天17:00投喂,开始时投喂量为仿刺参体质量的2.0%,随着仿刺参生长和摄食量的增加而增大,略过量投喂。投喂时将糊状饲料均匀涂在波纹板上,放在水槽底部,将充气石压在板下,涂抹饲料面朝上。仿刺参摄食后排出的粪便呈规则的长条状,不分散,有利于残饵和粪便的辨别和收集。
试验分3个周期,每个周期为20 d,共进行60 d。
1.2.3 测定项目与方法 试验结束时,从每组随机取20头仿刺参,抽取体腔液,在-20℃下保存,用于测定体腔液中的酶活力;每组留约30 g体壁,用于测定体壁中硒的含量,其余的用于体壁成分等指标的测定。
采用氢化物发生-原子吸收光谱法测定仿刺参体壁中硒的含量。
用南京建成生物工程研究所生产的试剂盒测定仿刺参体腔液中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和酸性磷酸酶(ACP)的活性。
每饲养20 d计算仿刺参的特殊增重率,计算公式为
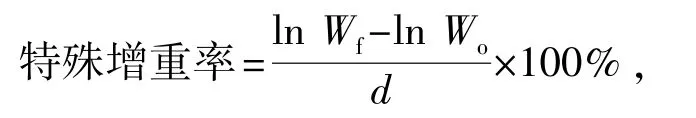
其中:Wf为试验结束时的体质量;Wo为试验初始的体质量;d为饲养天数。
在每个饲养周期结束前5 d,投喂添加质量分数为0.5%的三氧化二铬(Cr2O3)饲料,收集无破损的粪便,烘干,用来测定和计算消化率:
总表观消化率=(1-饲料中Cr2O3的含量/粪便中Cr2O3的含量)×100%。
1.2.4 数据处理 试验数据均以平均值±S.E.表示,用SPSS 16.0软件进行相关性检验、方差分析和LSD多重比较,以P<0.01为差异极显著,以P<0.05为差异显著。
2 结果
2.1 硒饲料对仿刺参生长和成活的影响
从表1可见:整个试验期间,摄食不同试验饲料仿刺参的成活率为95.66%~100%,摄食添加硒饲料仿刺参的成活率均大于摄食对照饲料的仿刺参,但各组之间差异不显著(P>0.05);除饲料中添加硒粉组外,其它硒饲料组仿刺参的特殊增重率均高于对照组,其中添加蛋氨酸硒组显著高于对照组(P<0.05),比对照组高74.35%,添加酵母硒和亚硒酸钠组均比对照组高46.15%,即蛋氨酸硒促进仿刺参生长的效果最好。
整个饲养期间,摄食不同试验饲料仿刺参的生长速度呈“低—高—低”的变化趋势(图1)。试验初期,由于仿刺参摄食的饲料和饲养环境的改变,其尚未完全适应,故生长速度参差不齐,甚至出现负值;第二阶段,仿刺参完全适应了试验饲料和环境,水温又在适宜范围内,因此,其生长速度加快,饲料中硒的促长作用得以显现;第三阶段,仿刺参生长速度仍很快,但由于个体增大,特殊增重率略低于第二阶段。
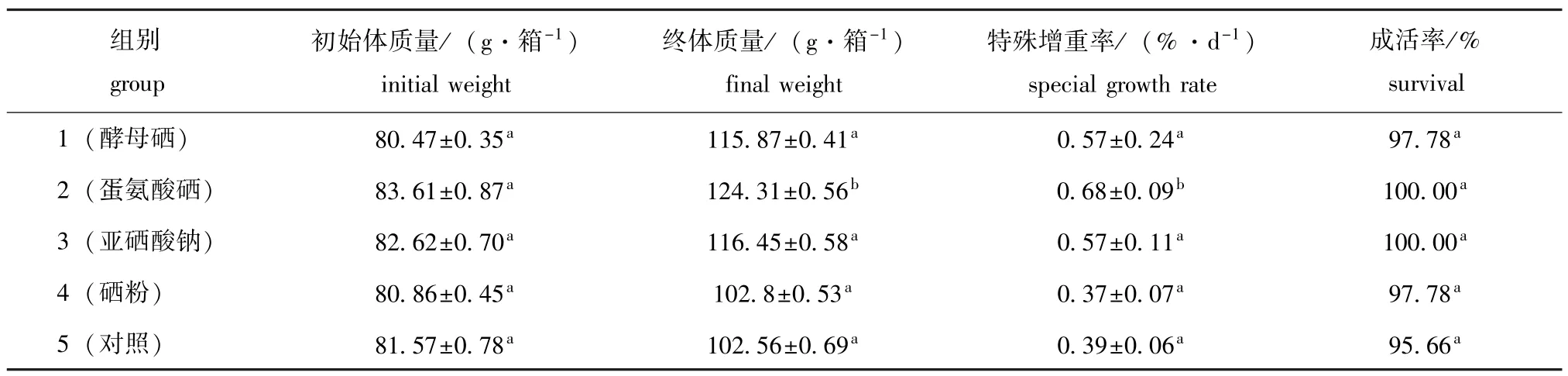
表1 仿刺参摄食添加不同类型硒的饲料时的生长和成活率Tab.1 Growth and survival of the sea cucumber juveniles fed the diets containing various types of selenium
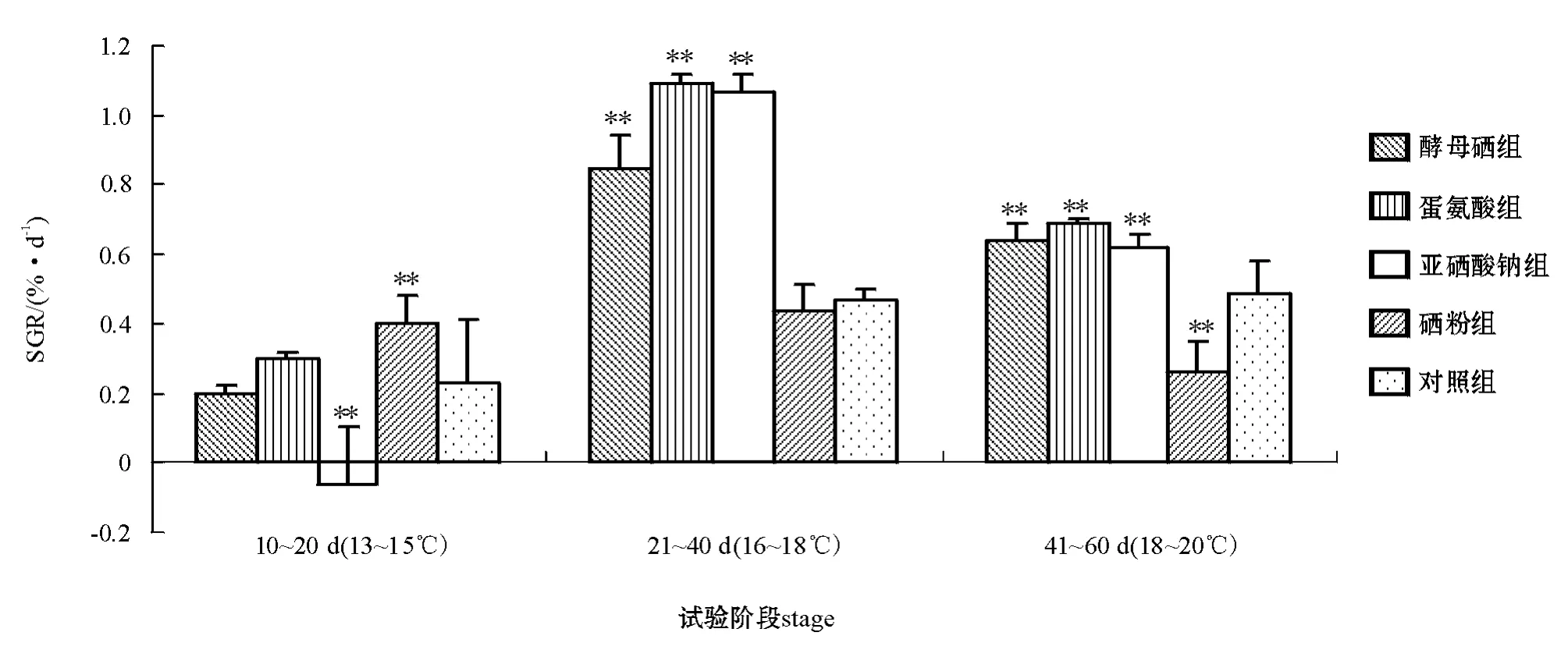
图1 仿刺参摄食添加不同类型硒的饲料时不同饲养阶段的生长Fig.1 Special growth rate of the sea cucumber juveniles fed the diets containing various types of selenium at different rearing stages
2.2 硒饲料对仿刺参消化率的影响
从表2可见:仿刺参摄食添加蛋氨酸硒和酵母硒等有机硒的饲料时,对饲料干物质的表观消化率显著高于无机硒组和对照组(P<0.05)。其中摄食添加蛋氨酸硒饲料的仿刺参对饲料干物质的表观消化率最高,比对照组高20.88%。摄食不同饲料的仿刺参对饲料中粗脂肪的消化率比较高,各组间差异均不显著(P>0.05),但仿刺参摄食添加硒饲料时对饲料中粗蛋白的表观消化率显著增高(P<0.05),由高至低依次为蛋氨酸硒组>亚硒酸钠组>酵母硒组>硒粉组,即摄食添加蛋氨酸硒、亚硒酸钠、酵母硒和硒粉饲料的仿刺参对饲料中粗蛋白的表观消化率分别比对照组高18.79%、17.96%、16.91%和15.78%,而摄食添加硒饲料的仿刺参组间差异均不显著(P>0.05)。
2.3 摄食不同饲料的仿刺参体壁的成分和硒含量
从表3可见:摄食添加硒饲料的仿刺参体壁的粗蛋白含量均高于摄食对照饲料的仿刺参,其中添加蛋氨酸硒和酵母硒两组的仿刺参干物质中粗蛋白的含量显著高于无机硒组和对照组(P<0.05),其它各组间差异不显著(P>0.05),表明饲料中的有机硒促进了仿刺参对饲料蛋白质的积累;摄食不同试验饲料的仿刺参体壁中粗脂肪和灰分含量差异均不显著(P>0.05)。
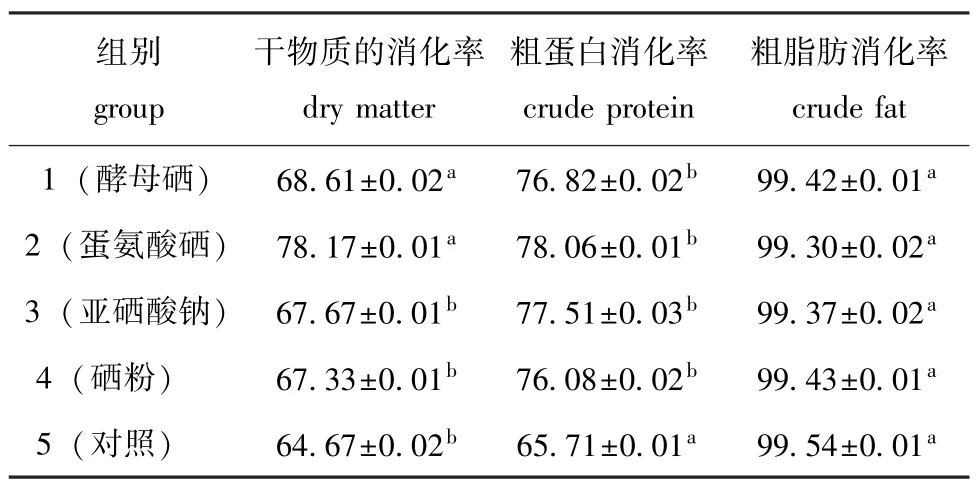
表2 仿刺参摄食添加不同类型硒的饲料时的表观消化率Tab.2 Apparent digestibility of the sea cucumber juveniles fed the diets containing various types of selenium%
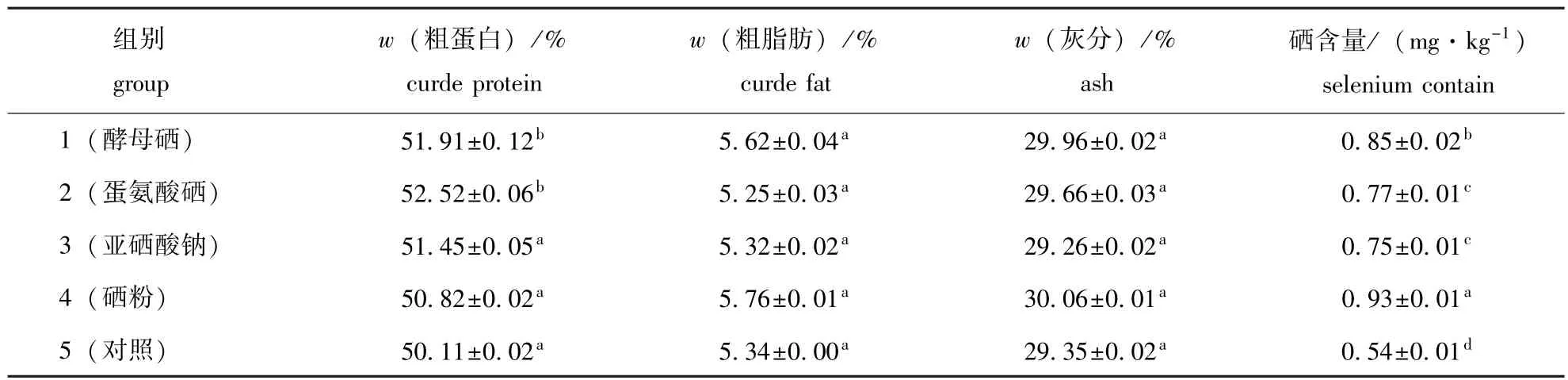
表3 摄食不同试验饲料的仿刺参体壁干物质中各种成分的含量Tab.3 Approximate composition in dry matter in the sea cucumber juveniles fed the diets containing various types of selenium
从表3看出,摄食添加硒的各组仿刺参体壁中硒含量均显著高于对照组(P<0.05),其中硒粉组仿刺参体壁中硒含量最高,其次是添加酵母硒组。
2.4 摄食不同饲料的仿刺参体腔液中免疫酶的活力
从表4可见:摄食添加有机硒饲料的仿刺参体腔液中超氧化物岐化酶(SOD)的活性高于摄食添加无机硒饲料和对照饲料的仿刺参,但各组之间差异不显著(P>0.05);摄食添加酵母硒饲料的仿刺参体腔液中过氧化氢酶(CAT)的活性高于其它各组的仿刺参,但与其它组差异不显著(P>0.05);摄食添加硒饲料的仿刺参体腔液中酸性磷酸酶(ACP)的活性显著高于摄食对照饲料的仿刺参(P<0.05),其中添加蛋氨酸硒组仿刺参体腔液中ACP的活力最高,酵母硒组次之,分别比对照组高100.0%和81.1%。
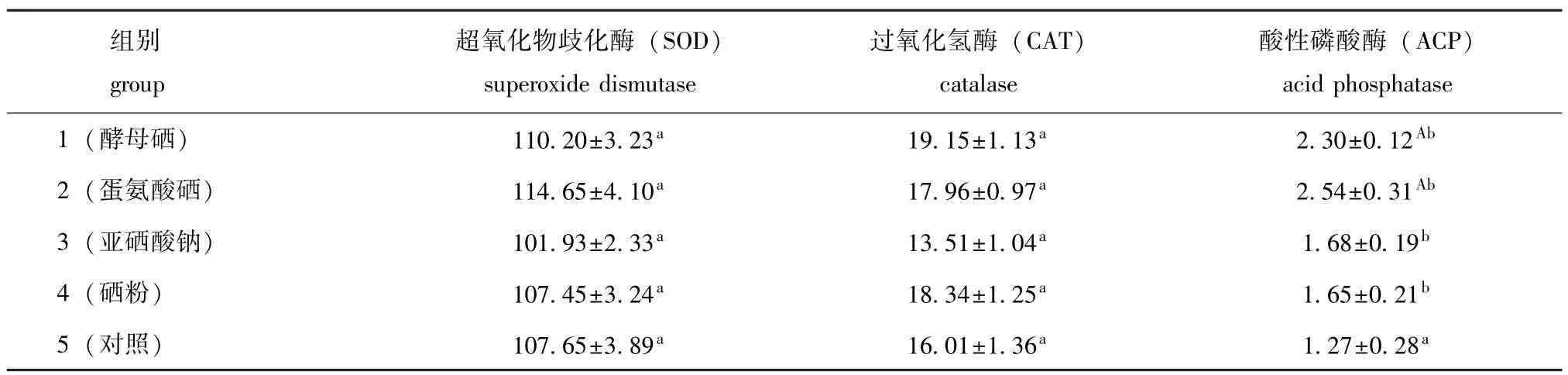
表4 仿刺参摄食添加不同类型硒的饲料时体腔液中几种免疫酶的活力Tab.4 Activities of some immune enzymes in coelomic fluid of the sea cucumber juveniles fed the diets containing various types of seleniumU/mL
3 讨论
3.1 仿刺参对饲料硒的需要量
Bell等[12]给大西洋鲑Salmo salar投喂鱼粉、亚硒酸钠、半胱氨酸硒和蛋氨酸硒等不同形式的硒,结果发现:饲料中添加硒组鱼的增重率大于缺硒组的鱼;鲑对蛋氨酸硒的消化率最高(92%),对鱼粉的消化率最低(47%)。在异育银鲫饲料中添加有机硒(多糖硒和蛋白硒,0.2 mg/kg)时,鱼的增重率比对照组和无机硒组分别高15.29%和14.59%,饲料系数降低12.49%和12.35%[5]。本试验中,添加硒的各组仿刺参增重率均高于对照组,这说明在仿刺参饲料中添加硒是必要的。仿刺参对有机硒(尤其是蛋氨酸硒和酵母硒)的利用率高于无机硒,这与目前对鱼类营养学的研究结果相一致。按Weinberg原理,动物对硒的营养需要存在一个适宜剂量范围,即要符合硒的剂量-效应关系曲线[18]。超过这个范围,会引起动物患硒缺乏症或慢、急性中毒。仿刺参饲料中硒的适宜剂量目前还未见报道,有待深入研究。
当饲料中添加0.6 mg/kg硒时,草鱼肝胰脏和肠道中蛋白酶、淀粉酶和脂肪酶的活性最高,增重率和饲料效率最高[3]。本试验中,添加蛋氨酸硒组的仿刺参对蛋白质的消化率显著高于对照组,这可能是饲料中的有机硒促进了仿刺参的生长。通常,硒以两种形式存在于蛋白质中:一是可离解的因子,另一种是与氨基酸结合以共价键的形式存在。以第一种形式存在的硒多见于细菌。哺乳动物中的硒是以共价键的形式存在于蛋白质中,其中主要涉及到两个氨基酸,即硒半胱氨酸(Se—Cys)和硒蛋氨酸(Se—Mys),后者在蛋白质中可代替蛋氨酸的存在,而Se—Cys只在蛋白质的特定位点发挥特殊的功能,主要是催化氧化—还原反应[13],促进仿刺参合成自身蛋白质。这与饲料中硒的水平为0.4 mg/kg时,鲈体中蛋白质含量显著高于其它试验组(P<0.05)相一致[14]。
本试验中,添加硒粉组的仿刺参体壁中硒含量最高,其次是添加蛋氨酸硒组的仿刺参,说明硒在仿刺参体内有富集。硒粉是由硒原子构成,仿刺参摄食后不能将其转化为有机硒,不能代谢利用,因而富集于硒。硒在机体内长时间大量富集,容易引起硒中毒,所以在饲料中不宜添加硒粉,而应以添加蛋氨酸硒为宜。这与很多学者的结论不谋而合。Ashmead[15]认为,螯合硒可完整地被动物吸收并运输至组织中,吸收率较无机硒高。Wang等发现[6],饲料中蛋氨酸硒含量与斑点叉尾鮰肌肉中硒含量的相关性最好,酵母硒次之。Lorentzen等[16]也发现,有机硒在大西洋鲑肌肉中的保留率更高。
沈梅等[17]的研究表明,饲料中硒含量的差异对动物体内硒含量影响较大,饲料中添加硒可以直接提高体壁中硒的含量。本试验中,摄食添加蛋氨酸硒和酵母硒的仿刺参体壁干物质中硒含量高于摄食添加亚硒酸钠组的含量,说明饲料中的硒是仿刺参体壁中硒的重要来源,仿刺参对有机硒的利用率高于无机硒。很多养殖动物体内都缺乏硒。仿刺参作为重要的海水养殖对象,体壁中若有机硒的含量高,则能够满足人类对硒的需求,养殖含硒量高的富硒海参,值得深入研究。
3.2 硒对仿刺参体腔液中免疫酶活力的影响
SOD是生物体内清除活性氧、免受细胞氧化伤害的主要抗氧化酶类之一,在防御机体衰老和生物分子损伤等方面有极为重要的作用。当生物体受到轻度逆境胁迫时,通常SOD活性升高,表现为一种抗应激反应;而当生物体受到重度逆境胁迫时, SOD活性通常降低,因而导致机体内积累过量的活性氧,对生物体造成伤害[18]。
本试验中,饲料中添加各种硒对仿刺参体腔液的SOD活力虽然无显著影响,但摄食添加蛋氨酸硒、酵母硒饲料的仿刺参体腔液中SOD的活力均高于对照组,尤其是蛋氨酸硒组的活力最高,而添加硒粉组的活力却和对照组相同,说明仿刺参更能利用蛋氨酸硒,提高体腔液中SOD的活力。饲料中添加各种硒对仿刺参体腔液中过氧化氢酶(CAT)活力的影响也不显著,但添加蛋氨酸硒、酵母硒组的仿刺参体腔液中CAT活力均高于对照组。这表明饲料中添加蛋氨酸硒和酵母硒对仿刺参体腔液中SOD和CAT的活力有影响,只是不显著,可能是本试验中硒的添加量不是仿刺参的适宜添加量所致。这与王宏伟等[19]发现中华米虾摄食补硒饲料后,肌肉中SOD活性升高的试验结果相似。
酸性磷酸酶(ACP)能参与水生动物的磷酸酯代谢,调节新陈代谢、能量转化、信号传导等作用。本试验中摄食添加蛋氨酸硒组仿刺参的ACP酶活力最高,其次是添加酵母硒组。这表明添加蛋氨酸硒和酵母硒能促进仿刺参对生物磷的代谢,提高其新陈代谢,进而促进仿刺参的生长。
[1] 张春善.动物必需微量元素[M].北京:高等教育出版社, 2007.
[2] Bell J G,Cowey C B,Adron J W,et al.Some effects of vitamin E and selenium deprivation on tissue enzyme levels and indices of tissue peroxidation in rainbow trout(Salmo gairdneri)[J].British Journal of Nutrition,1985,53(1):49-57.
[3] 苏传福,罗莉,文华,等.硒对草鱼生长、营养组成和消化酶活性的影响[J].上海水产大学学报,2007,16(2):124-129.
[4] Lin Y-H,Shiau S-Y.The effects of dietary selenium on the oxidative stress of grouper,Epinephelus malabaricus,fed high copper [J].Aquaculture,2007,267:38-43.
[5] Zhou Xuxia,Wang Yanbo,Gu Qing,et al.Effects of different dietary selenium sources(selenium nanoparticle and selenomethionine) on growth performance,muscle composition and glutathione peroxidase enzyme activity of crucian carp(Carassius auratus gibelio) [J].Aquaculture,2009,291:78-81.
[6] Wang C,Richard T,Lovel I.Organic selenium sources,selenomethionine and selenoyeast,have higher bioavailability than an inor-ganic selenium source,sodium selenite,in diets for channel catfish(Ictalurus punctatus)[J].Aquaculture,1997,152:223-234.
[7] 邓岳松,陈权军.纳米硒对尼罗罗非鱼生长的影响[J].内陆水产,2003(6):28-30.
[8] Ren Qian,Sun Rongrong,Zhao Xiaofan,et al.A selenium-dependent glutathione peroxidase(Se-GPx)and two glutathione S-transferases(GSTs)from Chinese shrimp(Fenneropenaeus chinensis) [J].Comparative Biochemistry and Physiology,Part C,2009,149: 613-623.
[9] Wang Weina,Wang Anli,Zhang Yajuan.Effect of dietary higher level of selenium and nitrite concentration on the cellular defense response of Penaeus vannamei[J].Aquaculture,2006,256:558-563.
[10] 王亭亭,蔡宗其.饲料中添加花粉和酵母硒对中华鳖幼鳖生长和非特异性免疫功能的影响[J].上海水产大学学报,2005 (6):97-102.
[11] 万敏,麦康森,马洪明,等.硒和维生素E对皱纹盘鲍血清抗氧化酶活力的影响[J].水生生物学报,2004,28(5):496-502.
[12] Bell J G,Cowey C B.Digestibility and bioavailability of dietary selenium from fishmeal,selenite,selenomethionine and selenocystine in Atlantic salmon(Salmo salar)[J].Aquaculture,1989, 81:61-68.
[13] Gladshev V N,Khangulo S V,Stadtman T C.Properties of the selenium and molybdenum-containing nicotinic acid hydroxylase from postridium barkeri[J].Biochemistry,1996,39:212-223.
[14] 梁萌青,王家林,常青,等.饲料中硒的添加水平对鲈鱼生长性能及相关酶活性的影响[J].中国水产科学,2006,13(6): 1017-1022.
[15] Ashmead H D.The roles of amino acid chelates in animal nutrition[M].New Jersey:Noyes Publication,1992:479.
[16] Lorentzen M,Maage A,Julshamn K.Effects of dietary selenite or selenomethionine on tissue selenium levels of Atlantic salmon (Salmo salar)[J].Aquaculture,1994,121:359-367.
[17] 沈梅,马安德.饲料中含硒量的差异对动物体内硒含量的影响[J].广东微量元素科学,2001,8(11):44-46.
[18] 徐辉碧,黄开勋.硒的化学、生物化学及其在生命科学中的应用[M].武汉:华中理工大学出版社,1994:25-35.
[19] 王宏伟,赵建华,崔爽,等.饲料中硒的添加量与中华米虾肌肉中SOD的活性[J].动物学杂志,2005,40(5):91-94.
Effects of dietary selenium sources on growth and immune indices in juvenile sea cucumber Apostichopus japonicus
WANG Ji-qiao1,WANG Zhi-xiang1,YU Hong-yan1,JIANG Yu-sheng1,ZHANG Jiang-cheng2
(1.Life Science and Technology Institute,Dalian Ocean University,Dalian 116023,China; 2.Dalian Bangchuidao Seafood Co.,LtD,Dalian 116100,China)
Juvenile sea cucumber Apostichopus japonicus Selenka with initial body weight of 5.36-5.57 g were stocked into 40 liter plastic tanks at a rate of 15 individuals per tank and fed the diets containing selenoyeast,sodium selenite,selenomethionine,or selenium powder at a rate of 0.4×10-6selenium(without addition of selenium as control)with triplication at water temperature of 13.0-20.0℃,a salinity of 31-32,and pH 7.5 for 60 days.The results showed that the sea cucumber fed the diets supplemented with selenium had significantly higher special growth rate than the animals fed the diets without supplementation of selenium did(P<0.05),the maximal body weight gain being observed in the sea cucumber fed the diets containing selenomethionine.There were no significant differences in the activities of superoxide dismutase(SOD),and catalase(CAT)in the coelomic fluid of the sea cucumber between the treatment and the control groups.However,it was found that the acid phosphatase(ACP) in the coelomic fluid was significantly higher in the selenoyseast group than that in the control group,indicating that the selenium supplementation significantly improved the growth performance in the sea cucumber.Improvement of sea cucumber growth by supplementation of selenium was found to be attributed to the increase in digestibility of dietary protein;high survival of sea cucumber by supplementation of selenium was shown to be dependent on the high activities of SOD,CAT,and ACP in the coelomic fluid.There was better improvement of digestibility and retention of dietary protein,leading to higher special growth rate,by organic selenium than by inorganic selenium.
Apostichopus japonicus;feed;selenium;growth;immune
S963.73
A
2095-1388(2011)04-0306-06
2010-09-06
辽宁省教育厅高等学校科研计划项目(20060186);辽宁省海洋与渔业厅资助项目
王吉桥(1950-),男,博士,教授。E-mail:jqwang1950@163.com
