库页岛厚蛤蜊的人工繁殖和胚胎发育
2011-03-14丛日浩王庆志孔令锋
孔 宁,李 琪,丛日浩,王庆志,孔令锋
(中国海洋大学 海水养殖教育部重点实验室,山东 青岛 266003)
库页岛厚蛤蜊 (Pseudocardium sachalinense),又称北寄贝、北极贝,属软体动物门,瓣鳃纲,帘蛤目,蛤蜊科,是分布于日本北方沿海、库页岛、朝鲜半岛东岸的大型冷水性贝类。成体主要生活在潮下带至12 m深的沙底浅海区,在日本北方、韩国和朝鲜是重要的滩涂经济贝类[1]。库页岛厚蛤蜊的软体部具有肉味鲜美、营养价值高、胆固醇低等优点,特别是其足在加热后呈红色,颜色鲜艳美丽,深受消费者的欢迎。近年来,由于过度捕捞、环境破坏等原因,库页岛厚蛤蜊的渔获量大幅下降。为恢复库页岛厚蛤蜊的自然资源,从20世纪90年代初开始,日本水产研究机构相继开展了库页岛厚蛤蜊人工育苗技术的研究工作[2],但没有建立起完整的规模化人工苗种生产技术。
山东、辽宁等地沿海滩涂面积广阔,具备库页岛厚蛤蜊生存的自然条件。引进这一名贵海产贝类,在我国开展库页岛厚蛤蜊的人工繁殖及增养殖,对于有效利用我国滩涂资源,开发养殖新品种等具有重要意义。目前,国内对库页岛厚蛤蜊的相关研究报道较少,高悦勉等[3]综述了形态构造、生活习性、繁殖习性等方面的相关报道,并研究了其精子的超微结构[4]。本研究报道了库页岛厚蛤蜊的亲贝促熟、人工催产和胚胎发育等人工繁育关键技术,旨在为我国开展库页岛厚蛤蜊的人工养殖提供基础资料。
1 材料与方法
1.1 亲贝的促熟
人工育苗试验在山东省文登市水产综合育苗实验基地进行。试验用亲贝于2010年4月采捕于朝鲜北部海域。将亲贝洗刷干净后置于室内15 m3水泥池中促熟。亲贝入池后先暂养5~7 d,不进行升温; 然后以每天 0.5~1.0℃的幅度升至 20 ℃,培育 3~5 d,再升温至24℃,等待产卵。促熟期间日投饵两次,饵料以金藻(Isochrysis zhanjiangensis)、小球藻(Chlorella vulgaris)和扁藻(Platymonas subcordiformis)为主,辅以人工配合饵料螺旋藻粉、活酵母等。每日倒池 1次,同时检查亲贝的存活状况,连续充气。
1.2 亲贝的诱导排放
将亲贝置于含有 50×10-6~150×10-6氨水的海水中诱导其排放精卵。发现有个体开始排放后,立即将全部亲贝转入水温为22~24 ℃的15 m3水泥池中,待其排放结束后及时移走亲贝。
1.3 胚胎发育
在显微镜下连续观察其胚胎发育过程,记录各发育阶段的相应时间。
1.4 幼体培育
胚胎发育至D形幼体阶段后,将其选优至15 m3的水泥池中进行幼体培育。日投饵3~5次,幼体在壳顶前期仅投喂金藻,进入壳顶期后开始投适量扁藻和小球藻。幼体培育期的日换水量为培育水体的1/3~1/2,每5~10 d倒池一次。培育用水为二级砂滤海水,盐度28~30,水温22~24℃。
1.5 附着变态
幼体出现足和雏形水管时,进入附着变态阶段,采用无附着基采苗,使幼体在培育池的池底完成变态。幼体变态期间,适当加大充气量和投饵量。
在 100 L的聚乙烯塑料桶内,分别以桶底、细砂(粒径:0.7~1.0 mm)、波纹板和网衣为附着基,研究不同附着基对幼体附着变态效果影响。幼体培育密度为1个/mL,每组试验设3个重复。投放附着基7 d后,统计各附着基幼体的单位面积(cm2)附苗量。
1.6 统计分析
用单因素方差分析(ANOVA)比较不同附着基的附苗效果,并进行 Duncan多重比较。统计分析在软件 SPSS 16.0上完成,差异显著性水平设为P< 0.05。
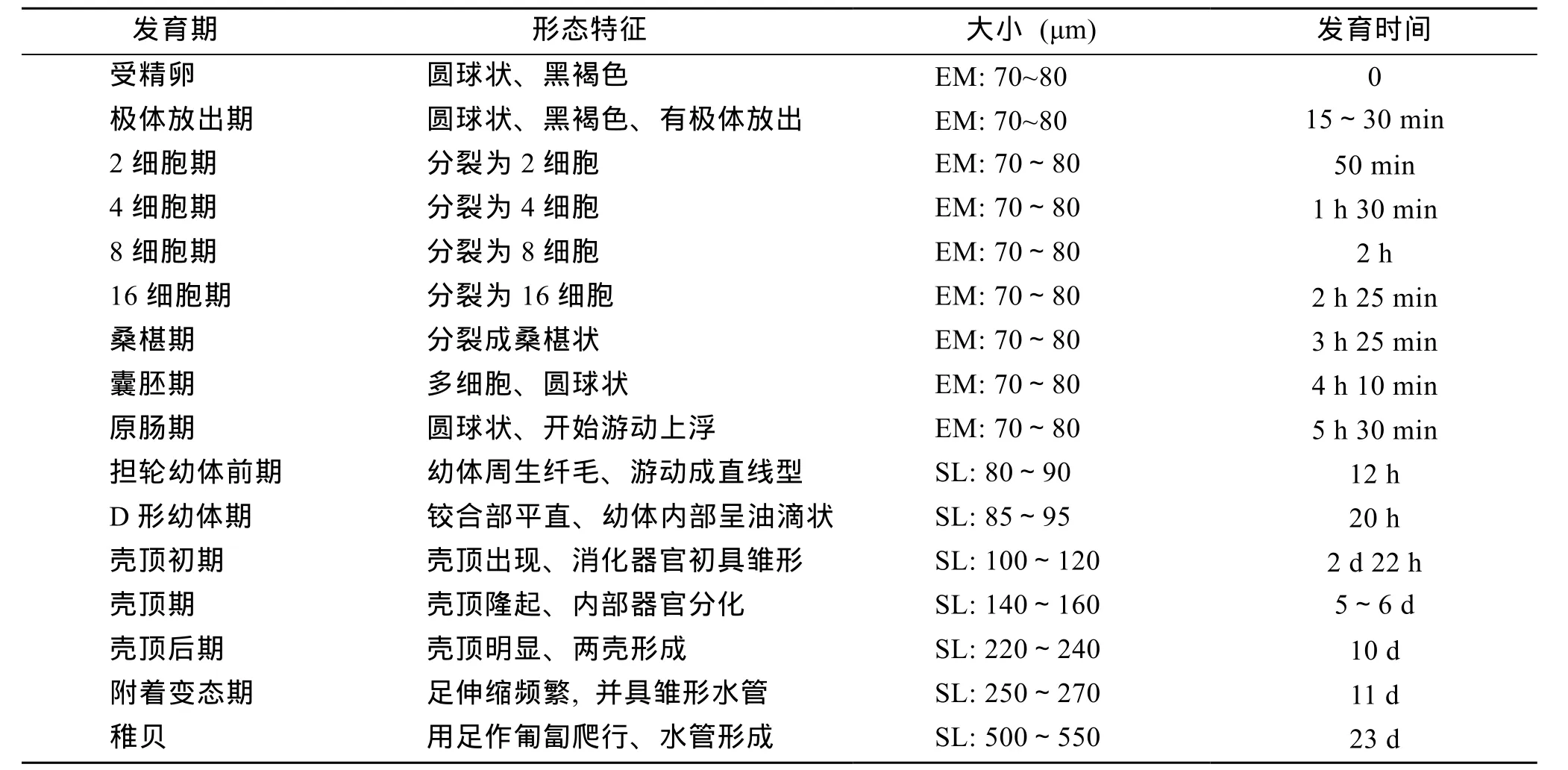
表1 库页岛厚蛤蜊不同胚胎发育阶段的发生时间Tab.1 Developmental timetable of embryos of the clam P. sachalinense
2 结果
2.1 胚胎发育
在水温 22~24℃,盐度 28~30条件下,库页岛厚蛤蜊的胚胎发育如表1和图1。库页岛厚蛤蜊受精卵在海水中呈球形(图1A),卵径为70~80 μm。受精卵经约50 min开始卵裂(图1C); 3.5 h发育至桑椹期(图1G); 5.5 h发育至原肠胚(图1I),此时幼体开始上浮; 约12 h后进入担轮幼体前期(图1J),幼体周生纤毛,运动转为直线运动; 20 h后面盘形成,进入D形幼体期(图1K),幼体游动活泼,平均壳长为85~95 μm,胃肠区不明显,经约3 d后幼体胃肠区趋于明显,消化器官初具雏形,壳顶略微隆起,进入壳顶初期(图1L),此时平均壳长为100~120 μm; 5~6 d后壳顶更趋明显,平均壳长为140~160 μm,幼体进入壳顶期(图1M); 当壳长生长至 220~240 μm 时,进入壳顶后期(图1N),此时幼体处于附着变态前期,面盘尚存,能观察到部分个体有足伸缩; 幼体壳长生长至 250~270 μm 时,足伸缩频繁,并具雏形水管(图 1O),此时进入附着变态阶段。随着足的频繁伸缩,面盘脱落,幼体转入底栖生活。
2.2 幼体与稚贝生长
幼体和稚贝的生长曲线如图 2。附着变态前(1~11 d),壳高平均日增长16.76 μm,壳长平均日增长 17.68 μm; 变态后(11~23 d),壳高日增长达22.49 μm,壳长日增长达23.15 μm。变态后稚贝经7 d全部下潜。水温25~27℃条件下,稚贝下潜12 d后壳长达 500~550 μm。

图1 库页岛厚蛤蜊的胚胎发育过程Fig.1 The process of embryonic development of P.sachalinense

图2 库页岛厚蛤蜊幼体与稚贝的生长Fig.2 Growth of larval and juvenile of P.sachalinense
2.3 附着基对幼体附着变态的影响
投放附着基7 d后,波纹板、网衣、细砂3种附着基的单位面积附苗量分别为 0.70个/cm2±0.14个/cm2、0.35 个/cm2±0.07 个/cm2、1.25 个/cm2±0.35 个/cm2,桶底为 2.50个/cm2±0.35个/cm2(图 3)。不同附着基的采苗率依次为:无附着基采苗>细砂>波纹板>网衣,各组之间差异性显著(P< 0.05)。
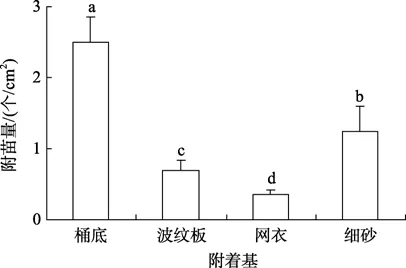
图3 库页岛厚蛤蜊幼体不同附着基附苗量Fig.3 The settling rates of P.sachalinense for four substrates
3 讨论
亲贝的性腺质量是苗种培育能否顺利进行的关键,因此亲贝促熟环节变得尤为重要。本试验所用亲贝从国外引进,经长时间运输,需要暂养恢复[5]。邓陈茂等[6]在珠母贝(Pinctada margaritifera)亲贝人工促熟培育中,将从国外引进的亲贝暂养 2 d,保证了较高的亲贝存活率。本试验亲贝入池后先稳定5~7 d,不进行升温,可避免因环境巨变导致亲贝大量死亡。饵料是亲贝性腺发育的物质基础,营养成分均衡是性腺发育良好的必要保障。吴进锋等[7]在紫石房蛤(Saxidomus purpuratus)的亲贝促熟中混合投喂亚心形扁藻、牟氏角毛藻和湛江等边金藻,使亲贝出现3次较大的自然排放; 梁飞龙等[8]在大珠母贝(Pinctada maxima)亲贝人工促熟培育中混合投喂亚心形扁藻和螺旋藻粉、蛋黄等自配人工饵料也取得满意的结果。本研究中混合投喂金藻、小球藻、扁藻等新鲜单胞藻的同时,辅以螺旋藻粉、活酵母等人工配合饵料,可调节营养平衡,达到了较好的促熟效果。
库页岛厚蛤蜊为雌雄异体,体外受精,卵裂方式为螺旋卵裂。胚胎发育观察发现,第一、二次卵裂为纵裂,两次卵裂形成的4个细胞大小均等,受精卵从第三次卵裂开始进行螺旋卵裂。这与李霞[9]描述的除头足类外的软体动物卵裂方式相一致。库页岛厚蛤蜊的个体发育时间与近缘种大致相同,中国蛤蜊(Mactra chinensis)在水温 25℃条件下,受精后45 min进行首次卵裂,6.3 h达原肠期,22 h发育至D形幼体,4 d出现壳顶,8~9 d发育至壳顶后期[10]; 紫石房蛤在水温 23~24℃条件下,受精后 50 min进行首次卵裂,10~12 h达原肠期,24~26 h发育至D形幼体,4 d出现壳顶,10~12 d发育至壳顶后期[11]。在温度大致相同的条件下,库页岛厚蛤蜊与中国蛤蜊和紫石房蛤的首次卵裂、发育至D形幼体和壳顶幼体的时间基本一致; 而到达原肠胚的时间存在差异,库页岛厚蛤蜊发育至原肠胚的时间为 5.5 h,与中国蛤蜊相近,与紫石房蛤差异较大。库页岛厚蛤蜊幼虫发育依次经过担轮幼体、D形幼体、壳顶期幼体,幼虫发育阶段无眼点出现,足和水管原基的出现是幼虫附着变态的标志。该发育方式与蛤蜊科贝类相一致,与以眼点出现为幼虫变态标志的牡蛎科差异较大[12]。库页岛厚蛤蜊自受精卵至原肠胚期间,细胞数目增多,细胞体积减小,整个胚体无显著增长。幼体变态前壳高、壳长增长较平缓,摄食量较小; 变态后生长速度明显加快,壳高、壳长日增长率与变态前相比分别提高34%和31%。
在本研究中,不同附着基的采苗率依次为:无附着基采苗 > 细砂 > 波纹板 > 网衣,各组之间差异显著(P< 0.05)。这与闫喜武[13]对菲律宾蛤仔(Ruditapes philippinarum)的研究结果基本相同,表明库页岛厚蛤蜊的生活方式虽为埋栖型,但细砂的存在不是其附着变态的必要条件; 在无砂条件下,库页岛厚蛤蜊完全能够正常变态、生长。细砂采苗较无附着基采苗效果差的原因可能是由于随着幼虫的生长,水中悬浮物、残饵、幼虫粪便等代谢产物在细砂表面逐渐积累,砂层逐渐变黑发臭,伴随而来的是原生动物的大量孳生,最终导致变态期幼体死亡率增高,采苗量降低; 而无附着基采苗克服了细砂采苗的缺点,定期倒池可以有效清除池底残留物,保持水体清洁,为幼体的变态提供了稳定良好的水环境。自然条件下的库页岛厚蛤蜊多栖息于细砂底质的海区,鉴于其生活习性,在今后生产育苗中可采用无附着基采苗技术进行苗种的采集,然后将采集到的苗种转移至厚度为1~2 cm的细砂中进行培育,培育期间务必定时换洗细砂,适时适量投饵、换水,防除病害,从而达到良好的生产效果。
[1]Sasaki K.Growth of the Sakhalin surf clam,Spisula sachalinensis(Schrenck),in Sendai Bay [J].Tohoku Journal of Agricultural Research,1981,32:168-180.
[2]Horii T,Murakami O,Sakurai I.Effect of density on growth in Sakhalin surf clamPseudocardium sachalinense[J].Nippon Suisan Gakkaishi,2002,68:666-673.
[3]高悦勉,孙洋,孙培海,等.北寄贝的生物学和增养殖 [J].大连水产学院学报,2006,25 (7):371-375.
[4]高悦勉,孙洋,孙培海,等.北寄贝精子的超微结构[J].大连水产学院学报,2006,21 (4):316-320.
[5]杜涛,罗杰,梁飞龙.华贵栉孔扇贝的人工育苗 [J].湛江海洋大学学报,2004,24 (4):69-71.
[6]邓陈茂,尹国荣,符韶,等.珠母贝亲贝人工促熟培育与催产的研究 [J].湛江海洋大学学报,2005,25 (1):14-16.
[7]吴进锋,陈素文,陈利雄,等.中国紫蛤的人工育苗[J].南方水产,2009,5 (4):22-25.
[8]梁飞龙,许国领,邓陈茂.大珠母贝亲贝人工促熟培育与诱导排放精卵的研究 [J].海洋湖沼通报,1998,2:34-37.
[9]李霞.水产动物组织胚胎学 [M].北京:中国农业出版社,2006.
[10]刘向全,方建光,包振民,等.中国蛤蜊繁殖生物学的初步研究 [J].中国海洋大学学报,2007,37 (1):89-92.
[11]魏利平,束蕴芳,关福田,等.紫石房蛤生物学的初步研究 [J].水产学报,1982,6 (1):1-8.
[12]王如才,王昭萍,张建中.海水贝类养殖学 [M].青岛:青岛海洋大学出版社,1993.
[13]闫喜武.菲律宾蛤仔养殖生物学、养殖技术与品种选育 [D].青岛:中国科学院海洋研究所,2005.
