三聚氰胺和三聚氰酸对蛋鸡毒性效应的研究
2011-03-14张定华白世平张克英丁雪梅吴彩梅
张定华 白世平 张克英 丁雪梅 吴彩梅
(四川农业大学动物营养研究所,教育部抗病营养重点实验室,雅安 625014)
2007年 3月,美国发生了“宠物毒粮”事件[1],2008年中国发生了“三鹿奶粉”事件,随后在鸡蛋中检测出了三聚氰胺(MEL)。农业部随即组织开展了饲料中 MEL限量制定工作,中华人民共和国农业部公告第 1218号规定饲料原料和饲料产品中 MEL的限量值为 2.5m g/kg。MEL可被某些微生物在体内降解为三聚氰酸(CYA),加剧 MEL的毒性[2]。MEL或 CYA单独使用对动物的毒性较小[1,3-4]。本实验室前期研究表明,大剂量 MEL(125~2 000mg/kg)会对蛋鸡的肝脏和肾脏产生一定损伤。MEL和 CYA合用会在猫和狗肾脏中形成不溶于水的大分子复合物,并形成晶体甚至结石,存在于肾小管中不易被排出,阻塞肾小管,最终导致肾衰竭[1,3-4]。有研究发现,在动物肾小管中,MEL和 CYA会以 3∶1的比例形成晶体复合物[5],但 MEL与 CYA合用对蛋鸡的毒性作用迄今未见报道。有关 M EL和 CYA以 3∶1的比例添加的毒性效应以及饲粮 CYA的存在是否会加剧 MEL毒性,目前在家禽上未见报道。本研究以蛋鸡为试验动物,旨在考察低剂量 MEL和CYA对蛋鸡的毒性效应,为相关风险评估提供试验依据。
1 材料与方法
1.1 试验材料
MEL(分析纯,纯度≥99.5%)购自北京化学试剂公司,CYA(分析纯,纯度 >99%)购自上海楷洋生物技术有限公司。
1.2 试验设计及饲粮
本试验共设 7个组,每组 9个重复,每个重复2只鸡。组 1为对照组,饲喂基础饲粮,组 2~4分别饲喂在基础饲粮中添加 MEL 5、15和 30mg/kg的饲粮,组5~7分别饲喂在组 2~4的饲粮中添加CYA 1.667、5和 10 mg/kg的饲粮,以保持 MEL和 CYA比例为 3∶1(表 1)。试验期 35 d,1~21 d,所有组饲喂相应的试验饲粮;22~35 d,每组中的6个重复换喂不含 MEL和 CYA的基础饲粮,进行消除试验,其余 3个重复仍饲喂试验饲粮,继续进行残留试验。

表 1 不同组饲粮中 MEL和 CYA的添加水平Table 1 Supp lemental levels ofmelam ine and cyanuric acid in the diets for different groups mg/kg
试验基础饲粮为玉米 -豆粕型饲粮,粉料,参考中国鸡饲养标准(NY/T 33—2004)配制。饲粮组成及营养水平见表 2。

表 2 基础饲粮组成及营养水平(风干基础)Table 2 Composition and nutrient levels of the basal diet(air-dry basis) %
1.3 试验动物及饲养管理
试验选用 126只 78周龄体重相近、产蛋率相近[(88.72±4.29)%]的罗曼粉壳蛋鸡,在四川农业大学动物营养研究所试验场进行。采用笼养、舍饲。预试 1周后进入正试期。采用自然加人工光照(15 h/d),自由采食、饮水,定时清扫卫生、喷雾消毒。
1.4 测定指标及方法
1.4.1 血清生化指标
于试验第 21天各组分别选取接近平均体重的 4只试鸡,第 28天(消除试验第 7天)从每组做消除试验的重复中选 4只鸡,以及第 35天继续做残留试验的重复中的 6只鸡进行翅下静脉采血10m L,3 500 r/min离心 15 m in,分离血清,-20℃保存。采用日立 7020全自动生化分析仪测定血清肌酐(CRE,苦味酸法)和尿酸(UA,尿酸酶法)含量及谷丙转氨酶(ALT,酶法)和谷草转氨酶(AST,酶法)活性。
1.4.2 肾脏组织抗氧化酶活性和丙二醛含量
将试验第 21天、第 28天和第 35天(继续做残留试验的重复)采血后的试鸡颈部脱臼处死,放血。采集肾脏组织(约 0.2 g),用试剂盒(南京建成生物工程研究所)测定超氧化物歧化酶(SOD)活性、总抗氧化能力(T-AOC)和丙二醛(MDA)含量。
1.4.3 肝脏、肾脏组织切片
将试验第 21天、第 28天和第 35天(继续做残留试验的重复)的试鸡屠宰后,取部分肝脏、肾脏,用中性的 4%多聚甲醛固定。将固定的标本经水洗、透明、浸蜡、包埋等处理后,制成 5μm的切片,HE染色,在光学显微镜下观察病变情况。
1.5 统计分析
数据采用 SAS 8.0软件 GLM程序进行单因素方差分析,当方差分析显著时,用 Duncan氏法进行多重比较。以 P<0.05为显著性检验标准。
2 结 果
2.1 M EL和 CYA对蛋鸡血清生化指标的影响
由表 3可知,各组 21、35 d血清 AST、ALT活性和 CRE含量无显著差异(P>0.05)。但 21 d时,血清 UA含量差异达到显著水平(P<0.05),其中 15 mg/kg MEL和 5 mg/kg CYA组、30 mg/kg MEL和 10mg/kg CYA组显著高于 0、5和15mg/kg MEL组,而 35 d UA含量接近显著水平(P=0.059)。
消除 7 d后,各组血清 AST和 ALT活性、UA和CRE含量无显著影响(P>0.05)。
2.2 MEL和 CYA对蛋鸡肾脏抗氧化酶活性和丙二醛含量的影响
由表 4可知,各组 21、35 d肾脏 T-AOC、SOD活性和 MDA含量差异不显著(P>0.05)。28 d,各组肾脏 T-AOC、SOD的活性和 MDA含量均与对照组接近。
消除 7 d后,21和 35 d肾脏 T-AOC、SOD的活性和 MDA的含量得到了改善(P>0.05),均接近对照组水平。
2.3 MEL和 CYA对蛋鸡肝脏和肾脏组织结构的影响
21 d时,各组肝肾病变规律与 35 d相似,但35 d病变更为严重,因此,本文只列出 35 d病变结果。
MEL和 CYA对蛋鸡肝脏组织结构的影响见图 1。与对照组相比,单独添加 5 mg/kg MEL组的病变不明显(图略),15和 30 mg/kg MEL组的肝脏轻度脂变,部分肝细胞胞浆内有少量圆形空泡(图 1-B、图 1-C)。同时添加 5 mg/kg MEL和1.667mg/kg CYA组、15mg/kg MEL和 5mg/kg CYA组的病变相似,均出现肝细胞轻度肿胀、水泡变性和脂肪变性的症状(图 1-D、图 1-E)。添加30 mg/kg MEL和 10 mg/kg CYA组的病变最为严重,肝细胞排列紊乱,肝索结构不清,肝细胞浆中有较多的不规则或近圆形空泡(图 1-F)。
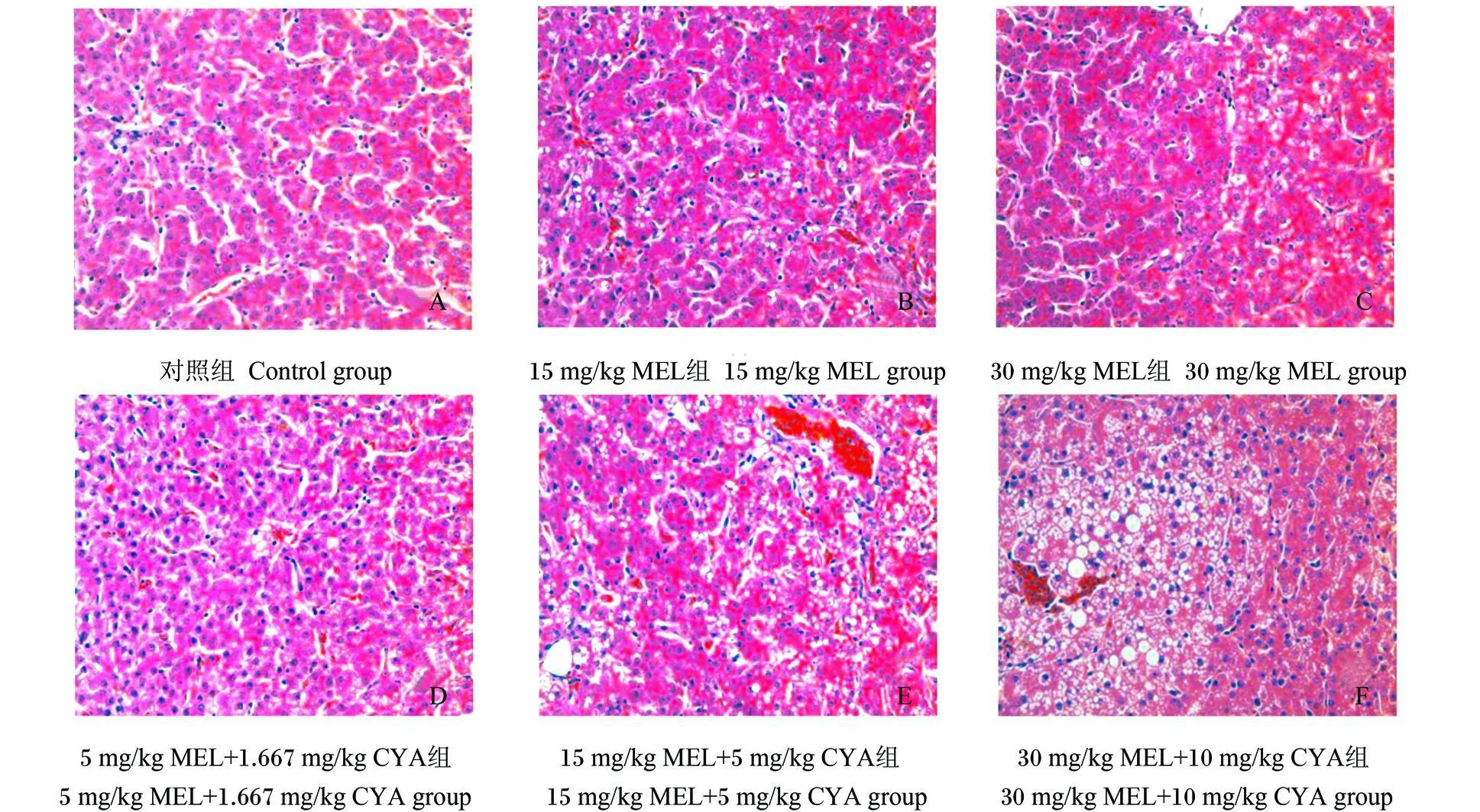
图 1 饲粮添加M EL和CYA对蛋鸡肝脏组织结构的影响Fig.1 Effects of dietarymelam ine and cyanuric acid on liver structure of laying hens(400×)
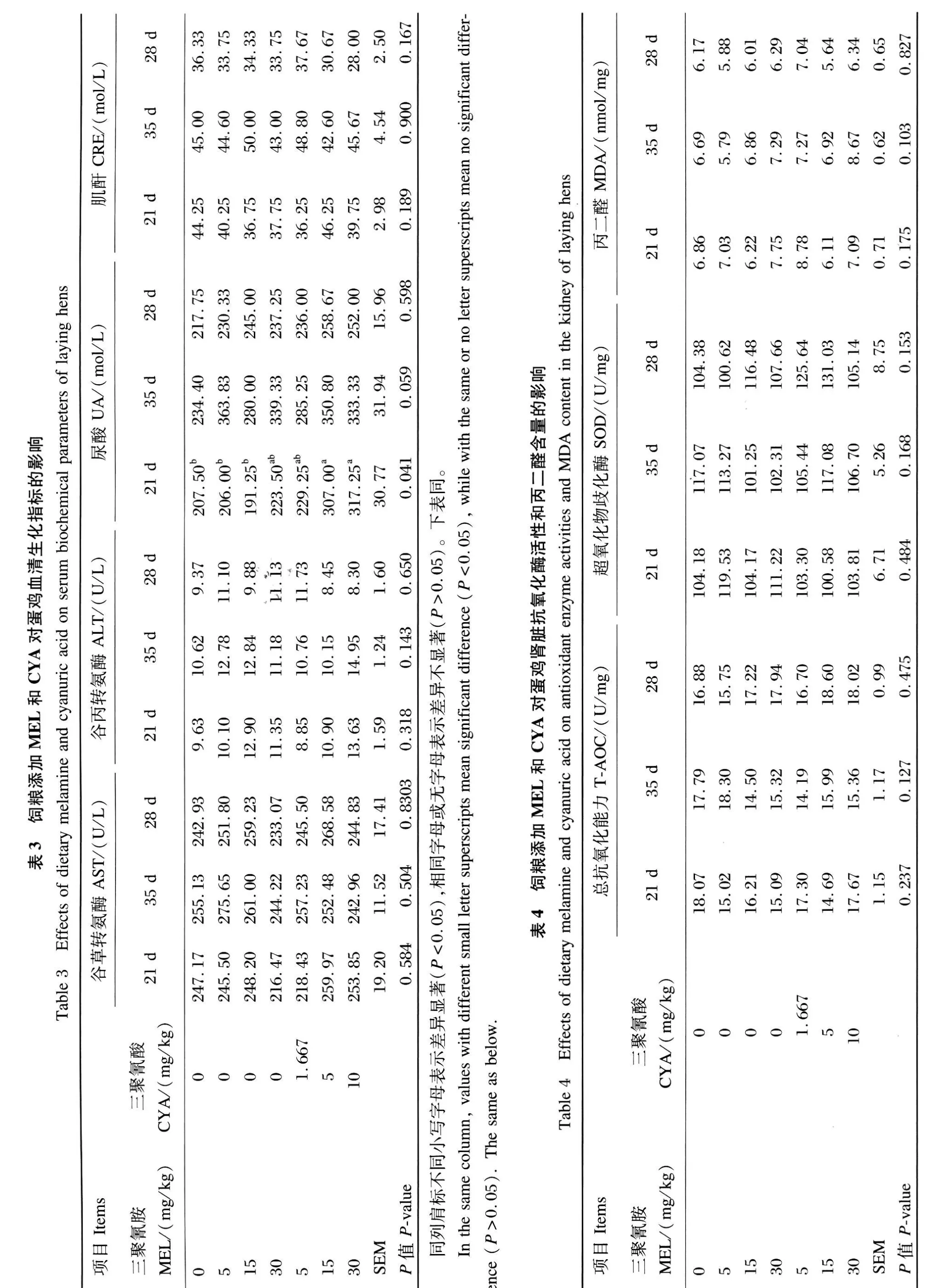
MEL和 CYA对蛋鸡肾脏组织结构的影响见图 2。与对照组相比,单独添加 5 m g/kg MEL组肾脏未见明显病变(图略)。15和 30mg/kg MEL组肾小管上皮细胞轻度空泡变性,后者肾小管间质还有轻度淤血(图 2-H和图 2-I)。同时添加5mg/kg MEL和 1.667mg/kg CYA组、15mg/kg MEL和 5 mg/kg CYA组病变相似,均表现为肾小管上皮细胞肿胀、水泡变性(图 2-J、图 2-K)。30mg/kg MEL和 10 mg/kg CYA组病最严重,肾小管上皮细胞肿胀,肾小球轻度充血(图 2-L)。
?
消除 7 d后,各组肝脏和肾脏组织病变情况见图 3。本文仅列出在 35 d时受损较严重的30 mg/kg MEL组、30 mg/kg MEL和 10 mg/kg CYA组经消除试验后的结果。由图 3可知,这 2个组的肝脏(图 3-B和图 3-C)、肾脏(图 3-E和图 3-F)与对照组相比,均无明显病变。

图 2 饲粮添加M EL和CYA对蛋鸡肾脏组织结构的影响Fig.2 Effects o f dietary melam ine and cyanuric acid on kidney structure of laying hens(400×)
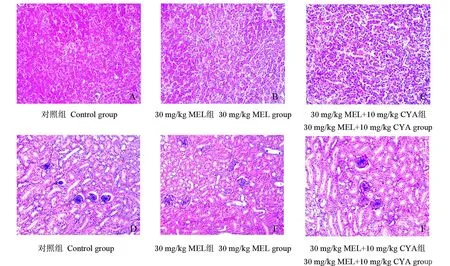
图 3 消除 7 d后蛋鸡肝脏和肾脏的组织结构Fig.3 Structures of liver and kidney of laying hens after elim ination for 7 days(200×)
3 讨 论
3.1 M EL和 CYA对蛋鸡肝脏功能的影响
血清 AST、ALT活性可反映肝脏功能。本试验结果表明,单独添加 MEL对血清 AST、ALT活性无显著影响,与高春起等[6]的研究结果一致。但 Neerman等[7]给小鼠注射 40 mg/kg BW MEL 48 h后,血清 AST活性升高。其原因可能与本试验 MEL给予方式与其不同或添加剂量低有关。有研究发现,单独灌胃 MEL对小鼠肝脏组织结构没有明显损伤[8]。本试验中 35 d肝脏切片结果显示 MEL只造成轻度脂肪变性和空泡变性等轻微损伤,可能是由于肝脏并非 MEL的靶器官,因此低剂量的 MEL更不会对肝脏造成严重损害。
谢志辉等[8]研究表明,给小鼠同时灌胃等量的 MEL、CYA(250、50、10 mg/kg BW)显著提高了血清 AST和 ALT活性。本试验中 MEL和CYA合用对血清 AST和 ALT活性无显著影响,但从 35 d的肝脏组织切片结果可知,MEL和 CYA合用对肝脏损伤程度大于分别单独添加的效应。
3.2 M EL和 CYA对蛋鸡肾脏功能的影响
血清 CRE和 UA水平可反映肾脏功能。据林祥梅等[9]、李倜等[10]报道,猫和肉鸡采食含有M EL的饲粮后,血清尿素氮(SUN)和 CRE含量超过正常水平。而 Puschner等[3]研究表明,单独给予猫0.5%、1%的 MEL或 0.2%、0.5%、1%的CYA持续 10 d,对 SUN、CRE无显著影响(P>0.05)。本试验中单独添加 MEL对血清 UA、CRE没有显著影响(P>0.05),可能因动物种属差异等不同所致。
肾脏 T-AOC、SOD活性可反映肾脏清除自由基的能力,而 MDA含量可反应肾脏细胞受损的严重程度。本试验中单独添加 MEL对 21、35 d肾脏T-AOC、SOD活性和 MDA含量无显著影响(P>0.05),这与高春起等[11]的报道不一致,说明 MEL并未对蛋鸡肾脏产生明显氧化损伤。陈茜等[12]同时给小鼠灌胃 MEL和 CYA 250、50和 10mg/kg BW后,发现血清 CRE和肾脏 MDA含量升高,SOD活性降低,且呈剂量相关性。本试验发现,MEL与 CYA合用对血清 CRE和肾脏 MDA含量、SOD活性无显著影响(P>0.05),但提高了21 d血清 UA含量;35 d肾脏组织切片说明 M EL和 CYA会造成肾脏损伤。另有研究发现,猫在饲喂含 2.4%MEL的饲粮 30 d后,肾小管管腔中出现晶体[9]。给狗灌服含有 30 mg/kg BW MEL和10mg/kg BW CYA的药物胶囊后,肾脏中有结晶形成,出现间质性肾炎和脂肪细胞变性等病理变化[13]。本试验研究表明,MEL与 CYA合用对肾脏的毒害加剧,但未发现晶体。这可能是由动物种属差异、染毒方式不同,或 MEL和 CYA的添加剂量低于蛋鸡肾脏晶体形成的阈值[14]所致。另外,生理生化指标的变化和积累导致组织器官的病变,使机体产生病理症状[13]。本试验中,肾脏T-AOC、SOD活性和 MDA含量以及血清 CRE含量无明显异常,却观察到肾脏组织病变,这可能是肾脏代偿作用的结果。肾脏是机体内代谢最旺盛的器官之一,在组织发生病变的同时,肾脏可能正在或者已将不正常的指标代谢至正常范围内[15]。
3.3 蛋鸡换喂基础饲粮后对 MEL和 CYA毒性效应的消除作用
MEL和 CYA在单胃动物体内进行惰性代谢,大部以原体或同系物形式排出,二者在动物体内的半衰期分别为4.04[16]和2.5 h[17]。本试验研究发现,换喂基础饲粮 7 d后,二者对蛋鸡血清 UA及肝肾组织结构的不利影响均可消除,并恢复到对照组水平,证实停止饲喂含 MEL和 CYA饲粮后,蛋鸡可将体内的 MEL、CYA排出体外,缓解或消除对机体的损伤。
4 结 论
①蛋鸡饲粮添加 M EL和 CYA显著影响 21 d血清 UA含量,同时添加 MEL和 CYA组血清 UA含量高于单独添加 MEL组;肝脏和肾脏组织结构发生不同程度病变,且合用的毒性大于单独添加的毒性。
②停止饲喂含 MEL和 CYA饲粮 7 d后,可以消除 MEL和 CYA的不利影响。
[1] BROWN C A,JEONG K S,POPPENGA R H,etal.Outbreaks of renal failure associated w ith melam ine and cyanuric acid in dogs and cats in 2004 and 2007[J].Journal of Veterinary D iagnostic Investigation,2007,19(6):525-531.
[2] JUTZIK,COOK A M,HUTTER R.The degradative pathway of the s-triazine melam ine.The steps to ring cleavage[J].Biochem ical Journal,1982,208(3):679-684.
[3] PUSCHNER B,POPPENGA R H,LOWENSTINE L J,et al.Assessment of melam ine and cyanuric acid toxicity in cats[J].Journal of Veterinary D iagnostic Investigation,2007,19(6):616-624.
[4] REIMSCHUESSEL R,GIESEKERC M,M ILLER R A,etal.Evaluation of the renal effects of experimental feeding of melam ine and cyanuric acid to fish and pigs[J].American Journal o f Veterinary Research,2008,69(9):1217-1228.
[5] WEI X,M INGDONG D,HENKJAN G,etal.Cyanuric acid and melam ine on Au(111):structure and energetics of hyd rogen-bonded netw orks[J].Small,2007,3(5):854-858.
[6] 高春起,武书庚,齐广海,等.三聚氰胺对蛋鸭产蛋性能、血清指标和肝肾组织结构的影响[J].中国农业科学,2010,43(5):1050-1056.
[7] NEERMAN M F,ZHANG W,PARRISH A R,et al.In vitro and in vivo evaluation of amelam ine dendrimer as a vehicle for drug delivery[J].International Journal of Pharmaceutics,2004,281(1/2):129-132.
[8] 谢志辉,袁慧.三聚氰胺及三聚氰胺与三聚氰酸混合物对小鼠肝脏损伤的研究[EB/OL].[2011-04-01].http://cpfd.cnki.com.cn/Article/CPFDTOTALZGXJ200908005130.htm.
[9] 林祥梅,王建峰,贾广乐,等.三聚氰胺的毒性研究[J].毒理学杂志,2008,22(3):216-218.
[10] 李倜,丁雪梅,张克英,等.饲粮中添加三聚氰胺对肉鸡生长性能和健康的影响[J].动物营养学报,2010,22(6):14-22.
[11] 高春起,武书庚,岳洪源,等.日粮三聚氰胺对产蛋鸭组织氧化损伤的影响[J].中国畜牧杂志,2010,46(13):64-67.
[12] 陈茜,袁慧.三聚氰胺及其同系物三聚氰酸对小鼠肾脏组织细胞的损伤研究[EB/OL].[2011-04-01].http://cpfd.cnki.com.cn/Article/CPFDTOTALZGXJ200910001055.htm.
[13] 李建红,刘永杰,魏学良.三聚氰胺及其衍生物对比格犬肾脏和睾丸的毒性评价[J].中国农学报,2010,26(11):7-12.
[14] 邵静君,温家琪,徐世文.三聚氰胺毒理学研究进展[J].现代畜牧兽医,2007,12:52-54.
[15] Anderson R A.A complementary approach to urolithiasis p revention[J].W orld Journal o f Uro logy,2002,20(5):294-301.
[16] DOBSON R L M,MOTLAGH S,QUIJANO M,et al.Identification and characterization o f toxicity of contam inants in pet food leading to an outbreak o f renal toxicity in cats and dogs[J].Toxicological Sciences,2008,106(1):251-262.
[17] CANELLIE.Chem ical,bacteriological,and toxicological p roperties of cyanuric acid and ch lorinated isocyanurates as applied to swimm ing pool disin fection:a review[J].American Journal of Public Health,1974,64(2):155.
