一氧化氮及其对营养物质代谢的调节
2011-03-14毛湘冰张克英陈代文
郑 萍 田 刚 毛湘冰 余 冰 张克英 陈代文
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安 625014)
一氧化氮(NO)是由一氧化氮合成酶(NOS)以精氨酸为底物合成的内皮细胞衍生舒张因子[1-3]。NO在各种生理过程中均起着重要的作用,包括调节上皮细胞正常功能,维持血管舒张状态,削弱血小板激活和血栓的形成,阻止平滑肌增殖,抑制白细胞黏附及白细胞渗出,维持血细胞和血浆蛋白的渗透压屏障[4-6]以及营养物质的代谢[7]等。作为 NOS的底物,精氨酸可以调节 NOS的活性,进而调节 NO的合成,从而影响营养物质的代谢。依赖于精氨酸的 NO代谢途径的发现引起了人们对 NO的生物化学、生理学和营养学等方面的研究的极大兴趣。关于 NO对营养物质代谢的影响,目前的研究主要集中在人的糖尿病、肥胖症、高血脂症或动物模型中NO对葡萄糖、脂肪、氨基酸代谢的影响等方面。本文拟就 NO及其与养分代谢调节的研究进展做一综述。
1 NO的合成
NO是由 NOS在辅助因子烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、黄素腺嘌呤二核苷酸(FAD)、黄素单核苷酸(FMN)、四氢生物喋呤(BH4)、Ca2+和钙调蛋白的作用下将精氨酸氧化分解而产生的[4,7]。如图 1所示,NOS的黄素蛋白将 NADPH的电子转运给血红素,血红素活化并结合分子氧,BH4与 NOS紧紧结合,紧挨着血红素,将底物精氨酸氧化分解为瓜氨酸和 NO[8]。BH4在 NOS的反应中起结构和氧化还原的作用。
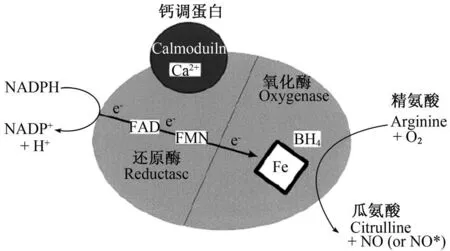
图 1 NOS催化反应Fig.1 Catalytic reaction by NOS[9]
NOS有 3种亚型,神经型(nNOS)——最早在神经组织中发现;诱导型(iNOS)——最早在巨噬细胞和肝细胞中由体外诱导发现;内皮型(eNOS)——最早在内皮细胞中发现[9]。nNOS和eNOS在各种类型的细胞中低水平地表达,iNOS正常情况下在大多数细胞中不表达,而受细菌毒素和炎症因子的诱导高度表达[10]。它们广泛存在于细胞的细胞膜、细胞质、细胞核、粗面内质网和线粒体中。
NOS的亚型分别由 3种不同的基因编码,其核苷酸序列有 51%~57%的同源性。NOS有 N端氧化酶和 C端还原酶 2个结构域。N端氧化酶结构域包含了精氨酸、血红素、BH4的结合位点和将 L-精氨酸连接到 C端还原酶结构域的钙调蛋白识别位点,C端还原酶结构域包含了 FAD、FMN、NADPH的结合位点,如图 2所示。
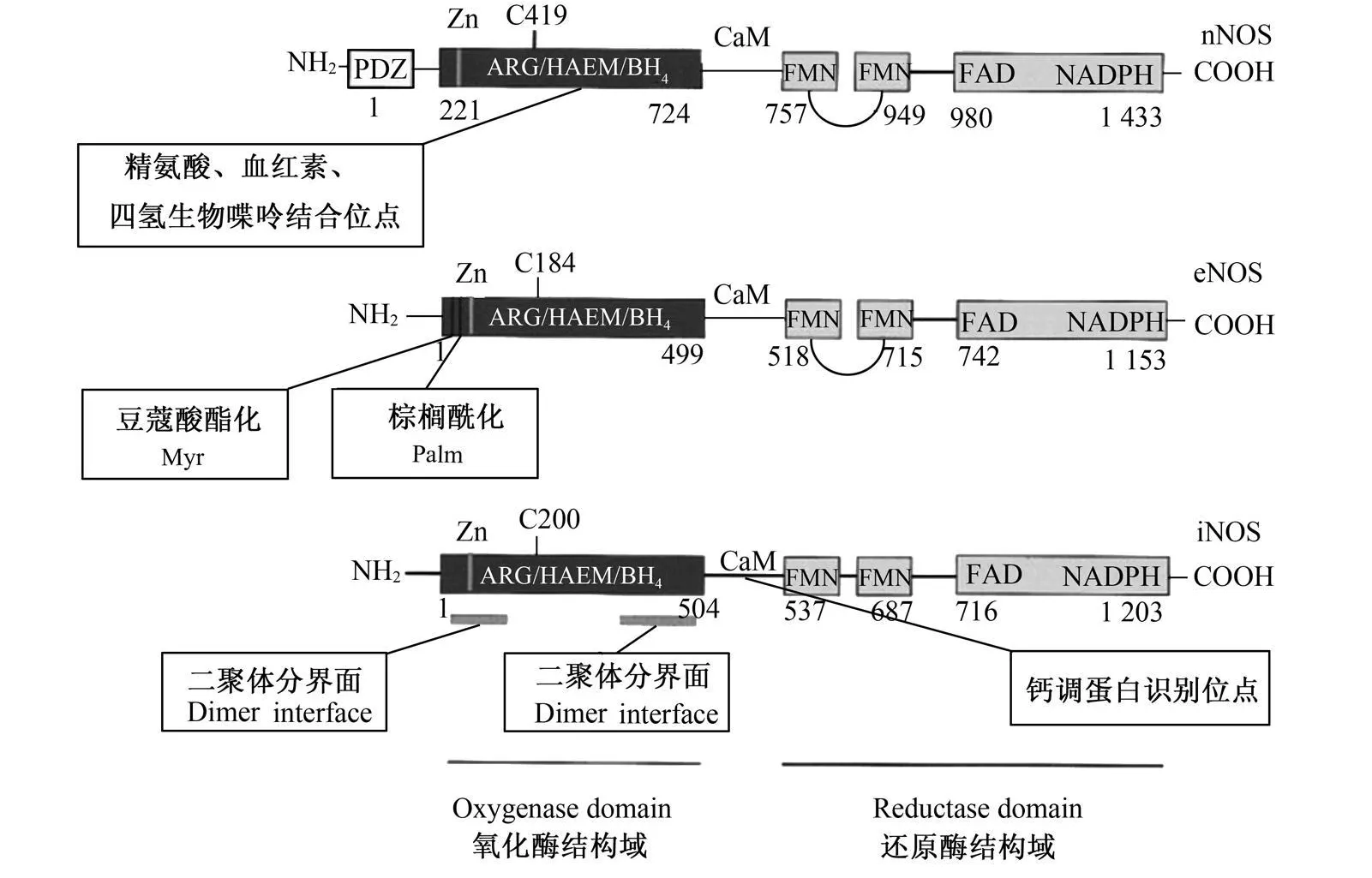
图 2 NOS的区域结构图Fig.2 The structural domain of NOS[11]
2 NO与营养物质代谢
NO不仅是脉管系统中重要的内皮衍生因子,而且在营养物质代谢调控上有着重要的作用。目前研究较多的是在人的糖尿病、肥胖症、高血脂症患者或动物模型中 NO对葡萄糖、脂肪、氨基酸代谢的影响方面。
2.1 NO与葡萄糖代谢
在糖尿病人或是实验动物模型上的研究表明,给予 NO合成底物后,能使患者或是糖尿病鼠的血糖浓度归于正常。在用链唑霉素诱导的糖尿病鼠模型上的研究表明,添加 NO的合成底物精氨酸后,显著增加了 NO的产量,并使糖尿病鼠的血糖浓度归于正常[12]。给人和大鼠注射 NG-硝基 -L-精氨酸甲基酯(L-NAME,NOS竞争性抑制剂)可以降低胰岛素分泌,降低葡萄糖耐量[13-16]。给四氧嘧啶诱导的糖尿病大鼠饲喂富含精氨酸的椰子核蛋白 45 d后发现,椰子核蛋白能显著降低糖尿病大鼠血清中葡萄糖和胰岛素的水平,肝脏糖原水平和血清碳水化合物代谢酶的活性回复到正常的水平,降低了糖尿病相关的胰腺损伤[17]。
Horton等[18]研究表明,在体外培养的大鼠肝细胞中,添加 NO的供体增加 NO的产量后,能抑制乳酸盐和丙酮酸盐转化成葡萄糖,并且葡萄糖的合成量随着 NO产量的增加呈剂量依赖的方式减少。Sprangers等[19]用分离大鼠肝细胞进行培养,发现 NO能够降低糖原合成酶的活性,从而抑制葡萄糖转化为糖原。这些体外试验说明 NO能抑制肝脏葡萄糖和糖原的合成。在分离的大鼠骨骼肌细胞培养液中添加硝普钠(SNP,一氧化氮供体)后发现,葡萄糖转运增加[20-21],骨骼肌细胞表面葡萄糖转运载体 4(GLUT4)的浓度随着 NO产量的增加而增加[22]。而在培养液中加入 NG-甲基 -L-精氨酸(L-NMMA,NOS竞争抑制剂)后,NOS的表达受到抑制,进而抑制 NO的合成,而此时发现因肌肉锻炼刺激引起的葡萄糖转运减少[20]。在培养的 3T3-L1脂肪细胞中,添加 SNP促进葡萄糖的吸收,而用 NO清除剂或腺苷环化酶抑制剂处理后,葡萄糖的吸收降低到基础水平[23],说明 NO刺激葡萄糖吸收是通过 cGMP的途径。给大鼠灌注 L-NMMA后,显著降低了脂肪组织中葡萄糖的转运[24]。说明在骨骼肌和脂肪组织中,增加 NO的产量能增加葡萄糖的转运和吸收,抑制NO的生成则降低葡萄糖的转运和吸收。
关于 NO调节葡萄糖转运和吸收的信号途径,总结目前的研究,归纳起来可能有 2条途径。第一,依赖胰岛素的途径。在骨骼肌中,胰岛素能促进葡萄糖的吸收。胰岛素是通过磷酸化磷脂酰肌醇 -3激酶(PI3K)来促进葡萄糖吸收的,抑制了PI3K的活性(采用其抑制剂渥曼青霉素 wortmannin)后,就极显著抑制了胰岛素刺激的葡萄糖的吸收,显著抑制了 NO刺激的葡萄糖吸收[22],说明NO刺激的葡萄糖吸收是部分依赖胰岛素途径的。第二,不依赖胰岛素的途径。锻炼能增加大鼠肌纤维膜 GLUT4的含量及脉管 NO的产量[25-26],增加大鼠骨骼肌 eNOS和 iNOS的基因表达、蛋白质含量和活力[20,27-28],注射 L-NAM E后会钝化这种作用[29]。L-NMMA处理后,可以抑制 NOS的表达,减少因肌肉锻炼刺激引起的葡萄糖转运[20]。但锻炼时对 PI3K活性无影响,说明锻炼时 NO对肌肉葡萄糖的转运作用不受胰岛素的影响。另外有研究表明,活化 AMPK可促进骨骼肌葡萄糖的转运,增加 NOS的表达,而添加 L-NAME后抑制了 AMPK的促葡萄糖转运[30],说明 AMPK调节的骨骼肌葡萄糖转运是依赖 NO的。
关于NO对葡萄糖氧化分解的作用研究结果不一致。用 SNP处理培养的大鼠比目鱼肌细胞,发现乳酸盐分泌量和葡萄糖氧化以剂量依赖的方式增加[31-33]。而在培养的大鼠肝细胞上,NO通过减少葡萄糖激酶和甘油醛 -3-磷酸脱氢酶的活性也能减少肝细胞糖酵解[34-35]。
高浓度的葡萄糖也会影响 NOS的活性和 NO的产量。在人脐静脉上皮细胞的研究表明,高葡萄糖浓度(33 mm ol/L)的培养基中,NO的合成量显著降低;进一步研究表明,高葡萄糖抑制 eNOS的活性,补充精氨酸(800 mol/L)则抑制 eNOS活性的降低[36]。
2.2 NO与脂质代谢
NO参与脂肪组织的生物学反应,影响脂肪的合成和分解。脂肪细胞中的 NO由 eNOS和 iNOS合成,在脂肪细胞中不表达 nNOS基因或表达量很弱[37]。肥胖症病人脂肪组织中 iNOS基因表达和NO产量较正常人高[38]。肥胖症病人的 eNOS基因的表达也增加,但高产量的 NO主要是因为iNOS。NO对脂肪代谢的作用根据 NO的来源、供体、组织位点和细胞内的氧化 -还原状态不同而异[39-41]。体外试验的研究结果表明,在同一细胞中,不同的细胞状态,NO对脂肪代谢的调节作用不同。大鼠脂肪细胞在低浓度的喘息平(isoprenaline)处理时,添加吗多明(molsidomine)或 SNP可促进脂解;高浓度的喘息平处理时,添加吗多明或SNP则抑制脂解[42]。1~5μmol/L的 SNP促进肥胖症人脂肪组织的脂肪分解,但 25~500μmol/L的 SNP抑制脂肪分解[43]。体内试验研究表明,NO在不同组织中对脂肪代谢调节的作用不同。在 110日龄的公猪饲粮中补充 1%的精氨酸,可显著增加肌肉中脂肪酸合成酶的基因表达,而降低脂肪组织中脂蛋白脂酶、GLUT4和ACC-α的基因表达;此外,补充精氨酸还会降低脂肪组织中激素敏感脂酶的基因表达[44],这个试验说明补充精氨酸可以促进猪肌肉组织中脂肪沉积,而在脂肪组织中则促进脂肪分解。给成年ZDF大鼠补充 1.51%精氨酸盐酸盐,可以增加NO的产量(71%~85%),增加脂肪组织中脂肪分解(22%~24%),腹部和附睾体脂沉积分别降低了 45%和 25%[45]。给大鼠饲喂 0.02%的 L-Nω-硝基精氨酸(L-NNA,NOS抑制剂)8周后,发现大鼠体脂肪含量和血清甘油三酯含量显著增加,而血清硝酸盐的浓度显著下降,并且,肝脏肉碱棕榈酸转移酶(脂肪氧化的限速酶)的活性受到抑制,但补充了 4%的精氨酸后,L-NNA的作用被消除[46]。大鼠上的研究表明,NO能够调节脂肪组织中瘦素对脂肪分解的刺激作用[47]。
NO可抑制低密度脂蛋白的合成。给兔子饲喂含 0.03%SNP的饲粮,有降低兔子血浆低密度脂蛋白的趋势;且在孵化的肝细胞中,添加 0.5%SNP可显著降低 apoB的含量[48]。饲喂大鼠 NOS的抑制剂(L-NNA)后,血浆甘油三酯、胆固醇、极低密度脂蛋白水平显著增加[46]。大鼠饲粮中添加0.02%NOS抑制剂(L-NNA)造成血浆脂肪酸、低密度脂蛋白、极低密度脂蛋白浓度显著升高,饲粮中补充 4%的精氨酸后,由于 NOS抑制剂造成的高水平的血浆脂肪酸、低密度脂蛋白、极低密度脂蛋白浓度显著下降[49]。NO调节肝细胞脂质代谢主要是通过抑制脂肪酸的从头合成和乙酰辅酶 A羧化酶的活性,降低丙酰辅酶 A的水平,促进脂肪酸氧化的[50]。
2.3 NO与氨基酸代谢
关于 NO对氨基酸代谢影响的研究比较少。目前关于 NO对氨基酸氧化的报道结果不一致。有报道认为补充外源 NO(灌注 0.2 mmol/L的SNP)增加大鼠肝细胞尿素的生成,促进其氨基酸的氧化[51]。但是,与炎症条件下高水平的 NO相比,生理水平的 NO通过活化过氧化物酶体增生物激活受体 -α(PPAR-α)降低尿素循环的酶的表达,抑制肝脏细胞尿素的合成,说明生理水平的NO有抑制肝脏氨基酸氧化的作用[52]。PPAR-α是肝脏尿素循环的负调节子,可下调氨甲酰磷酸合成酶 1、鸟氨酸氨甲酰转移酶(OCT)、精氨基琥珀酸合成酶(ASS)和精氨基琥珀酸裂解酶(ASL)的表达[52]。
在 TNF-α诱导的大鼠骨骼肌肌肉萎缩的模型上,NOS的抑制剂能促进肌球蛋白肌酸磷酸激酶(myosin creatinine phosphokinase,MCK)的活化,抑制肌肉萎缩。在骨骼肌中,iNOS来源的 NO调节 TNF-α对蛋白质合成的抑制作用和刺激蛋白质降解[53]。在血管平滑肌细胞中,外源 NO供体(30~300μmol/L)抑制鸟氨酸脱羧酶,从而抑制多胺合成和细胞增殖[54],但在内皮细胞中,10μmol/L的 NO供体则增加多胺的合成和细胞增殖[55]。
3 NO合成的调控
NO影响营养物质的代谢调控,因此调节 NO的产量就能调节营养物质的代谢。NO在生物体内由 NOS合成,细胞中 NO的合成速率可通过各种途径控制精氨酸的有效性及NOS的辅助因子来调节[56]。
钙调蛋白是 3种亚型的 NOS活化所必需的[57-58]。iNOS不依赖于 Ca2+,因为其结构与钙调蛋白紧密相连;eNOS和 nNOS的活化需要高浓度的 Ca2+,它们与 iNOS的不同在于它们的 C端还原酶区域有一个含 40~50个氨基酸的基序,阻止其与钙调蛋白结合。磷酸化作用可影响 eNOS和 nNOS的活性[59],但 iNOS的活性不受磷酸化调节,而受炎症刺激的调节[60]。精氨酸在催化 NOS二聚体的形成中起到结构性的作用[8,61]。精氨酸作为 NOS的底物,它还能通过底物调节相关联酶活性的机制来调节 NOS活性[62]。由于 NO的合成受细胞类型、Ca2+-钙调蛋白、亚细胞位点、磷酸化作用以及底物精氨酸浓度等多种因素的影响和调节,而目前对具体的信号传导途径与最终的作用区域之间的关系还不清楚,因此,对于体内NO的活性调节的研究仍然是巨大的挑战。
4 小 结
精氨酸 -NO途径在体内有着重要的生理功能。NO不仅参与体内营养物质代谢,而且是上皮衍生的作用于血管的一种调节介质。NO具有扩张血管、调节血流量、改善微循环及抗坏血小板聚集黏附及免疫调节功能,但 NO合成量过多会产生细胞毒性,所以,体内适量水平的 NO对于人和动物的健康是非常重要的[63-66]。
NO在生物体内有着重要的生理作用,NO的产量、来源、作用的位点等因素均影响其生物学功能,而 NO的合成量受到 NOS活性的直接调节。NOS的活性又受到多种因素的影响。人和动物模型研究表明,NO对人类高胆固醇血症、动脉粥样硬化、高血压、慢性肾衰竭、慢性心脏衰竭及癌症等疾病进程有着重要的调控作用。在养殖业生产上,动物常常遭受免疫应激或各种环境应激,在应激条件下,可能会诱导 iNOS的表达,合成大量的NO,产生细胞毒性,同时会造成精氨酸被耗竭,产生营养缺乏症等疾病。所以,进一步研究 NO的作用机理、NOS的表达调控以及它与其他精氨酸代谢酶类和产物之间的交互关系有着重要的现实意义。
[1] HIBBS JB,TAINTOR R R,VAVRIN Z.Macrophage cy totoxicity:role for L-arginine deim inase and im ino nitrogen oxidation to nitrite[J].Science,1987,235:473-476.
[2] PALMER R M,FERRIGE A G,MONCADA S.Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor[J].Nature,1987,327:524-526.
[3] IGNARROL J,BUGA G M,WOOD K S,etal.Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide[J].Proceedings of the National Academy of Sciences of the United States o f America,1987,84:9265-9269.
[4] WU G,MORRIS S M Jr.A rgininemetabolism:nitric oxide and beyond[J].The Journal of Biochem istry,1998,336:1-17.
[5] LOSCALZO J.L-arginine and atherothrombosis[J].The Journal of Nutrition,2004,134:2798S-2800S.
[6] MORIM,GOTOH T.Arginine metabolic enzym es,nitric oxide and infection[J].The Journal o f Nutrition,2004,134:2820S-2825S.
[7] JOBGEN W S,FRIED SK,FUW J,etal.Regulatory role for the arginine-nitric oxide pathway in metabolism of energy substrates[J].The Journal of Nutritional Biochem istry,2006,17:571-588.
[8] STUEHR D J.Enzymes o f the L-arginine to nitric oxide pathway[J].The Journal of Nutrition,2004,134:2748S-2751S.
[9] ALDERTON W K,COOPER C E,KNOWLES R G.Nitric oxide synthases:structure,function and inhibition[J].The Journal of Biochem istry,2001,357:593-615.
[10] MORRIS S M Jr.Enzymes of arginine metabolism[J].The Journal of Nutrition,2004,134:2743S-2747S.
[11] BATES T E,LOESCH A,BURNSTOCK G,et al.Mitochondrial nitric oxide synthase:a ubiquitous regulator of oxidative phosphorylation?[J].Biochem ical and Biophysical Research Communications,1996,218:40-44.
[12] KOHLIR,MEININGER C J,HAYNES T E,et al.Dietary L-arginine supplementation enhances endothelial nitric oxide synthesis in strep tozotocin-induced diabetic rats[J].The Journal of Nutrition,2004,134:600-608.
[13] ROY D,PERREAULT M,MARETTE A.Insulin stimulation of glucose uptake in skeletal muscles and adipose tissues in vivo is no dependent[J].American Journal of Physiology,1998,274:E692-E699.
[14] BALON TW,JASMAN A P,YOUNG JC.Effects of chronic N(omega)-nitro-L-arginine methy l ester adm inistration on glucose tolerance and skeletalm uscle glucose transport in the rat[J].N itric Oxide,1999,3:312-320.
[15] BARON A D,ZHU JS,MARSHALL S,et al.Insulin resistance afterhypertension induced by the nitric oxide synthesis inhibitor L-NMMA in rats[J].American Journal o f Physiology,1995,269:E 709-E715.
[16] LAAKSO M,EDELMAN S V,BRECHTEL G,et al.Impaired insulinmediated skeletal muscle blood flow in patients w ith INDDM[J].Diabetes,1992,41:1076-1083.
[17]SALILG,NEV IN K G,RAJAMOHAN T.Arginine rich coconut kernel p rotein modulates diabetes in alloxan treated rats[J].Chem ico-Biological Interactions,2010,189(1/2):107-111.
[18] HORTON R A,CEPPIED,KNOW LESR G,etal.Inhibition of hepatic gluconeogenesis by nitric oxide:a comparison with endotoxic shock[J].The Journal of Biochem istry,1994,299:735-739.
[19] SPRANGERS F,SAUERWEIN H P,ROM IJN JA,et al.Nitric oxide inhibits glycogen synthesis in isolated rathepatocytes[J].The Journalof Biochem istry,1998,330:1045-1049.
[20] BALON T W,NADLER J L.Evidence that nitric oxide increases g lucose transport in skeletal muscle[J].Journal of App lied Physiology,1997,82:359-363.
[21] YOUNG M E,RADDA G K,LEIGHTON B.Nitric oxide stimulates glucose transport and metabolism in rat skeletalmuscle in vitro[J].The Journal of Biochem istry,1997,322:223-228.
[22] JESSEN N,GOODYEAR L J.Contraction signaling to g lucose transport in skeletalmuscle[J].Journal of Applied Physiology,2005,99:330-337.
[23] TANAKA T,NAKATANIK,MORIOKA K,et al.N itric oxide stimu lates g lucose transport through insulin-independent GLUT 4 translocation in 3T 3-L1 adipocytes[J].European Journal o f Endocrino logy,2003,149:61-67.
[24] ROY D,PERREAULT M,MARETTE A.Insulin stimu lation o f glucose uptake in skeletalmuscles and adipose tissues in vivo is no dependent[J].American Journalo f Physiology,1998,274:E692-E699.
[25] MATSUMOTO A,H IRATA Y,MOMOMURA S,et al.Increased nitric oxide production during exercise[J].Lancet,1994,343:849-850.
[26] PATIL R D,DICARLO S E,COLLINSH L.Acute exercise enhances nitric oxidem odulation o f vascular response to phenylephrine[J].American Journal of Physio logy,1993,265:H 1184-H 1188.
[27] SESSA W C,PRITCHARD K,SEYEDIN,et al.Chronic exercise in dogs increases coronary vascular nitric oxide production and endothelial cell nitric oxide synthase gene expression[J].Circulation Research,1994,74:349-353.
[28] ROBERTSC K,BARNARD R J,JASMAN A,et al.A cute exercise increases nitric oxide synthase activity in skeletal muscle[J].American Journal o f Physiology,1999,277:E390-E394.
[29] ROBERTSC K,BARNARD R J,SCHECK S H,et al.Exercise-stimulated glucose transport in skeletal muscle is nitric oxide dependent[J].American Journal o f Physiology,1997,273:E 220-E225.
[30] SHEARER J,FUEGER P T,VORNDICK B,et al.AMP kinase-induced skeletalm uscle g lucose but not long-chain fatty acid uptake is dependenton nitric oxide[J].Diabetes,2004,53:1429-1435.
[31] YOUNG M,RADDA G,LEIGHTON B.N itric oxide stimulates glucose transport and metabolism in rat skeletalmuscle in vitro[J].The Journalo f Biochemistry,1997,322:223-228.
[32] YOUNG M E,LEIGHTON B.Fuel oxidation in skeletalmuscle is increased by nitric oxide/cGMP-evidence for involvement of cGMP-dependent protein kinase[J].FEBS Letters,1998,424:79-83.
[33] YOUNG M E,LEIGHTON B.Evidence for altered sensitivity of the nitric oxide/cGMP signalling cascade in insu lin-resistant skeletalmuscle[J].The Journal o f Biochem istry,1998,329:73-79.
[34] MONTI L D,VALSECCHI G,COSTA S,et al.Effects of endothelin-1and nitric oxide on glucokinase activity in iso lated rat hepatocy tes[J].M etabolism-Clinical and Experimental,2000,49:73-80.
[35] STADLER J,BARTON D,BEIL-MOELLER H,et al.Hepatocy te nitric oxide biosynthesis inhibits glucose outputand competes with urea synthesis for L-arginine[J].Am erican Journal o f Physiology,1995,268:G 183-G 188.
[36] ZHONG W,ZOU G,GU J,etal.L-arginine attenuates high glucose-accelerated senescence in human umbilical vein endothelial cells[J].Diabetes Research and Clinical Practice,2010,89(1):38-45.
[37] GIORDANOA,TONELLO C,BULBARELLI A,et al.Evidence for a functionalnitric oxide synthase system in brow n adipocy te nucleus[J].FEBS Letters,2002,514:135-140.
[38] ENGELI S,JANKE J,GORZELN IAK K,et al.Regulation of the nitric oxide system in human adipose tissue[J].The Journal of Lipid Research,2004,45:1640-1648.
[39] GAUDIOT N,JAUBERT A M,CHARBONN IER E,et al.Modulation o f w hite adipose tissue lipo lysis by nitric oxide[J].The Journal of Biochem istry,1998,273:13475-13481.
[40] GAUDIOT N,RIBIERE C,JAUBERT A M,et al.Endogenous nitric oxide is imp licated in the regulation of lipo lysis through antioxidantrelated effect[J].A-merican Journal of Physiology-Cell Physiology,2000,279:C 1603-C 1610.
[41] FRUHBECK G,GOMEZ-AMBROSI J.Modulation of the leptin-induced w hite adipose tissue lipolysis by nitric oxide[J].Cellular Signaling,2001,13:827-833.
[42] LINCOVA D,ISEKOVA D,KMON ICKOVA E,et al.Effect of nitric oxide donors on isoprenaline-induced lipolysis in ratepididymal adipose tissue:studies in iso lated adipose tissues and immobilized perfused adipocytes[J].Physiological Research,2002,51:387-394.
[43] FA IN JN,KANU A,BAHOUTH SW,et al.Inhibition of leptin release by atrial natriuretic peptide(ANP)in human adipocy tes[J].Biochem ical Pharmacology,2003,65:1883-1888.
[44] TAN B,YIN Y,LIU Z,et al.D ietary L-arginine supp lementation differentially regu lates exp ression of lipid-m etabolic genes in porcine adipose tissue and skeletalmuscle[J].Journal o f Nutritional Biochem istry,2010,1(2):118-130.
[45] FU W J,HAYNES T E,KOHLIR,etal.Dietary L-arginine supplem entation reduces fat mass in zucker diabetic fatty rats[J].The Journal of Nutrition,2005,135:714-721.
[46] KHEDARA A,GOTO T,MORISHIMA M,et al.Elevated body fat in rats by the dietary nitric oxide synthase inhibitor,L-N om ega nitroarginine[J].Bioscience Biotechnology and Biochem istry,1999,63:698-702.
[47] FRUHBECK G,GOMEZ-AMBROSIG.Modulation of the lep tin-induced w hite adipose tissue lipolysis by nitric oxide[J].Cellular Signaling,2001,13:827-833.
[48] KUROWSKA EM,CARROLL K K.Hypocho lesterolem ic properties of nitric oxide.In vivo and in vitro studies using nitric oxide donors[J].Biochim ica et Biophysica Acta,1998,1392:41-50.
[49] KHEDARA A,KAWA IY,KAYASH ITA J,et al.Feeding rats the nitric oxide synthase inhibitor,l-nnnitroarginine,elevates serum triglycerides and cholesterol and lowers hepatic fatty acid oxidation[J].The Journal of Nutrition,1996,126:2563-2567.
[50] GARCIA-V ILLAFRANCA J,GUILLEN A,CASTRO J.Involvement of nitric oxide/cyclic GMP signaling pathw ay in the regulation of fatty acid metabolism in rat hepatocy tes[J].Biochem ical Pharmacology,2003,65:807-812.
[51] FARGHALIH,HYNIE S,VOHNIKOVA Z,et al.Possib le dual role of nitric oxide in oxidative stress injury:a study in perfused hepatocytes[J].International Journal o f Immunopharmaco logy,1997,19:599-605.
[52] DESVERGNE B,M ICHALIK L,WAHLIW.Be fit or sick:peroxisomal p ro liferations-activated receptors are down the road[J].International Journal of Immunopharmacology,2004,18:1321-1332.
[53] BUCK M,CHOJK IER M.Muscle w asting and dedifferentiation induced by oxidative stress in a murine model o f cachexia is p revented by inhibitors of nitric oxide synthesis and antioxidants[J].EMBO Journal,1996,15:1753-1765.
[54] IGNARRO L J,BUGA G M,W EIL H,et al.Role of the arginine-nitric oxide pathw ay in the regulation of vascularsmooth muscle cell proliferation[J].Proceedings of the National Academy o f Sciences of the United States of America,2001,98:4202-4208.
[55] MARINOSR S,ZHANG W,WU G,et al.Tetrahyd robiopterin levels regulate endothelial cell pro liferation[J].American Journal of Physiology,2001,281:H 482-H 489.
[56] WU G,MORRIS SM,Jr.Argininemetabo lism:nitric oxide and beyond[J].The Journal of Biochem istry,1998,336:1-17.
[57] BREDT D S,SNYDER SH.Isolation of nitric oxide synthetase,acalmodulin-requiring enzyme[J].Proceedings o f the National A cademy of Sciences o f the United States of America,1990,87:682-685.
[58] CARDOUNEL A J,XIA Y,ZWEIER J L.Endogenousmethy larginines modulate superoxide as w ell as nitric oxide generation from neuronal nitric-oxide synthase[J].The Journal o f Bio logical Chem istry,2005,280:7540-7549.
[59] ALDERTON W K,COOPER C E,KNOW LES R G.N itric oxide synthases:structure,function and inhibition[J].The Journal o f Biochem istry,2001,357:593-615.
[60] GOOKIN J L,CHIANG S,ALLEN J,etal.N f-κbmediated expression of iNOS promotes epithelial defense against infection by cryp tosporidium parvum in neonatal pig lets[J].American Journal of Physiology-Gastrointestinal and Liver Physiology,2006,290:G 164-G 174.
[61] GOKCE N.L-arginine and hypertension[J].The Journalof Nutrition,2004,134:2807S-2811S.
[62] LEE J,RYU H,FERRANTE R J,etal.Translational control of inducible nitric oxide synthase expression by arginine can exp lain the arginine paradox[J].Proceedings o f the National A cademy of Sciences o f the United States of America,2003,100:4843-4848.
[63] BROSHAN M E,BROSNAN J T.Renal arginine metabolism[J].The Journal o f Nutrition,2004,134:2791S-2795S.
[64] GRAN IK V G.Metabolism of L-arginine[J].Pharmaceutical Chem istry Journal,2003,37(3):3-20.
[65] W ILMORE D.Enteral and parenteral arginine supp lementation to imp rovem edical outcomes in hospitalized patients[J].The Journal of Nutrition,2004,134:2863S-2867S.
[66] 叶帅,瞿明仁,游金明,等.精氨酸对左旋硝基精氨酸甲酯诱导猪宫内生长受限的缓解作用[J].动物营养学报,2010,22(4):879-885.
