山羊瘤胃内产乳酸菌的分离鉴定及其产 D-、L-乳酸特性的研究
2011-03-14魏德泳朱伟云毛胜勇
魏德泳 朱伟云 毛胜勇
(南京农业大学消化道微生物研究室,南京 210095)
乳酸是瘤胃内一类重要的中间产物,大多瘤胃微生物如牛链球菌和乳酸杆菌均可发酵谷物类饲料并产生乳酸,而乳酸利用菌如埃氏巨球型菌等则可利用乳酸生成丙酸,因此,维持较低水平的乳酸对维持乳酸利用菌的数量和瘤胃正常生理功能具有积极的意义。同时,适当浓度的乳酸还有利于减轻瘤胃内硝酸盐的毒理效应[1]。但当动物饲粮突然从青粗饲料转变成高谷物饲料时,瘤胃内乳酸浓度会显著升高,瘤胃 pH持续下降,导致乳酸利用菌的生长被抑制,乳酸产生菌群和利用菌群之间正常的平衡受破坏,大量乳酸会在瘤胃中累积,导致 pH进一步降低,从而引发瘤胃急性酸中毒。在瘤胃中,微生物产生的乳酸有 D-和L-乳酸之分,动物机体组织中含有大量能氧化L-乳酸的酶,而 D-乳酸必须经过体组织内线粒体膜才能被氧化,因此,D-乳酸降解慢,其毒性更大。推测D-乳酸可能是造成瘤胃急性酸中毒和宿主代谢性酸中毒的根本原因[2-3]。但瘤胃中到底哪些微生物是主要的 D-、L-乳酸产生菌,目前相关报道极少。在我国,随着近年来牛羊养殖业的快速发展,发生瘤胃酸中毒的报道也不断增多。为了解我国本土动物瘤胃内产乳酸菌的种类,阐明其产 D-、L-乳酸的特性,本试验利用本地山羊,从瘤胃中分离获取主要的乳酸菌,在此基础上研究其产 D-、L-乳酸的能力,为进一步认识这些微生物在瘤胃消化中的作用奠定基础。
1 材料与方法
1.1 试验动物
试验动物选择 3头装有永久性瘤胃瘘管的体况良好的雄性长江三角洲白山羊。饲粮精粗比例为 6∶4,预试期 2周。第 1周将山羊的饲粮精料添加量从 200 g/d逐渐增加到 400 g/d,饲粮精料由70%玉米和 30%豆粕组成,自由采食羊草;第 2周精料添加量保持为 400 g/d,自由采食羊草。
1.2 培养基成分及其配制
乳酸菌琼脂培养基(MRS)组成:蛋白胨 10 g,牛肉浸膏 10 g,酵母浸膏 5 g,葡萄糖 20 g,柠檬酸三铵2 g,CH3COONa 5 g,K2HPO45 g,M gSO4◦7H2O 0.5 g,MnSO4◦ 4H2O 0.2 g,吐温 -80 1 g,琼脂粉 15 g,加蒸馏水至 1 L,调节pH至 5.5~6.2,115℃高温灭菌 15 min,待培养基的温度降至 60℃后制备平板备用。
1.3 产乳酸菌的富集与分离纯化
在预饲 2周后,采集 3头山羊的混合瘤胃内容物,并保存于保温瓶内。瘤胃液经过 4层纱布过滤去除固相,取 1m L瘤胃液接种至10m LMRS液体厌氧培养基内,39℃富集培养。间隔 24 h以1%(V/V)的接种量传代 1次,连续传代 5次。取第 5代培养物 0.1 m L进行 10倍梯度稀释,取 3个梯度的样品 0.1 m L涂布于 MRS平板培养基上,置于厌氧工作站培养 48 h后,在菌落密度合适的平板上挑取形态、颜色等不同的菌落,继续划线培养至菌落形态单一。
1.4 菌株鉴定
1.4.1 形态特征观察
菌体经稀释后涂布于平板上,于厌氧工作站中 39℃培养,48 h后观察菌落形态。
1.4.2 生理生化特性鉴定
生理生化特性鉴定方法参考东秀珠等[4]的方法进行,所用微量发酵管购自浙江杭州天和微生物试剂有限公司。
1.4.3 分离菌株 DNA提取、PCR扩增及16S rRNA基因序列测定及系统发育分析
各菌株体外培养 24 h后,收集菌体,用于DNA的提取,DNA提取和 16S rRNA序列扩增方法分别参照 Murray等[5]和 Zoetendal等[6]的方法进行。所用细菌 16S rRNA全长通用引物序列如下:上游引物 8f[5′CACGGATCCAGAGTTTGAT(C/T)(A/C)TGGCTCAG 3′],下游引物 1510r(5′GTGAAGCTTACGGCTACCTTGTTACGACTT 3′)。PCR反应程序为:94℃ 3 min,而后 94℃30 s,52℃30 s,68℃ 1.5 m in,30个循环,68℃最终延伸 7 min。PCR产物经 1.2%琼脂糖凝胶电泳检测,片段长度正确的 PCR产物送至南京丁贝生物技术有限公司测序。本试验所测菌株 16S rRNA基因序列在 GenBank的登录号分别为HQ452822、 HQ452821、 HQ452823、 HQ452824、HQ452825、HQ452826。从 GenBank中获取与之有较高同源性的模式菌株的 16S rRNA基因序列。采用 Clustalx(1.81)和 MEGA(4.0)软件进行系统发育分析,利用邻接(neighbor-joining)法建立系统进化树。
1.5 生长曲线与 D-、L-乳酸的测定
取 1m L复壮的分离菌株置于 9m L的 MRS液体厌氧培养基中,以不接种培养基为对照,每间隔 2 h测定接种试管中培养液的吸光度(OD)值,测定波长为 600 nm,绘制各产乳酸菌生长曲线。采用试剂盒(购自上海必优公司)测定培养 24 h后各菌株发酵液中 D-、L-乳酸浓度。
1.6 数据统计
采用 SPSS 18.0软件包中的 One-way ANOVA进行单因素分析,均值的多重比较采用 Duncan氏法进行,以P<0.05作为差异显著性判断标准。
2 结 果
2.1 菌株分离与形态学特征
利用涂板划线分离技术,尽可能挑取菌落形态、颜色不相同的细菌,经连续分离纯化,最终获得 6株乳酸产生菌,分别命名为 L2、L3、L5、L8、L10和 L12。革兰氏染色鉴定表明,L2、L5、L8和L10为革兰氏阴性菌;L3和 L12为革兰氏阳性菌。形态学观察表明,L2、L5、L8和 L10的形态相近,单个细菌呈球状或椭圆状,多聚集在一起,成链状;L3和 L12的形态相近,呈短杆状或椭圆形,皆比较湿润,有光泽,光滑,边缘整齐。
2.2 分离菌株的生化特征
各菌株的生化特征如表 1所示。L8和 L10菌株可利用木糖、纤维二糖、七叶灵、果糖、半乳糖、葡萄糖和乳糖,但不能利用葡萄酸盐和山梨醇;L3和 L12菌株能利用纤维二糖、果糖、葡萄糖、乳糖、葡萄酸盐、麦芽糖、松三糖、蜜二糖、鼠李糖、水杨苷、蔗糖、阿拉伯糖和山梨醇,但不能利用木糖、七叶灵、半乳糖和核糖;L2菌株可利用木糖、纤维二糖 、七叶灵 、半乳糖 、葡萄糖、乳糖、麦芽糖 、松三糖、蜜二糖、鼠李糖、水杨苷、蔗糖和阿拉伯糖,但不能利用葡萄酸盐、山梨醇和核糖;L5菌株可利用木糖、纤维二糖、果糖、半乳糖、葡萄糖、乳糖、麦芽糖、松三糖、蜜二糖、鼠李糖、水杨苷、蔗糖和阿拉伯糖,但不能利用七叶灵、葡萄酸盐和山梨醇。

表 1 生化鉴定结果Table 1 The results of biochem ical identification
2.2.3 菌株 16S rRNA基因系统发育分析
由表 2可见,L2、L8、L10与牛链球菌(Streptococcus bovis)的 16S rRNA的相似性达 99%,L5与马链球菌(Streptococcus equinus)相似性高达99%,L3、L12与食窦魏斯氏菌(Weissella cibaria)相似性达 99%。系统发育分析结果表明,L2、L8、L10和 L 5位于同一簇群内,属链球菌属;而 L3与L12位于另一簇群内,属魏斯氏菌属。
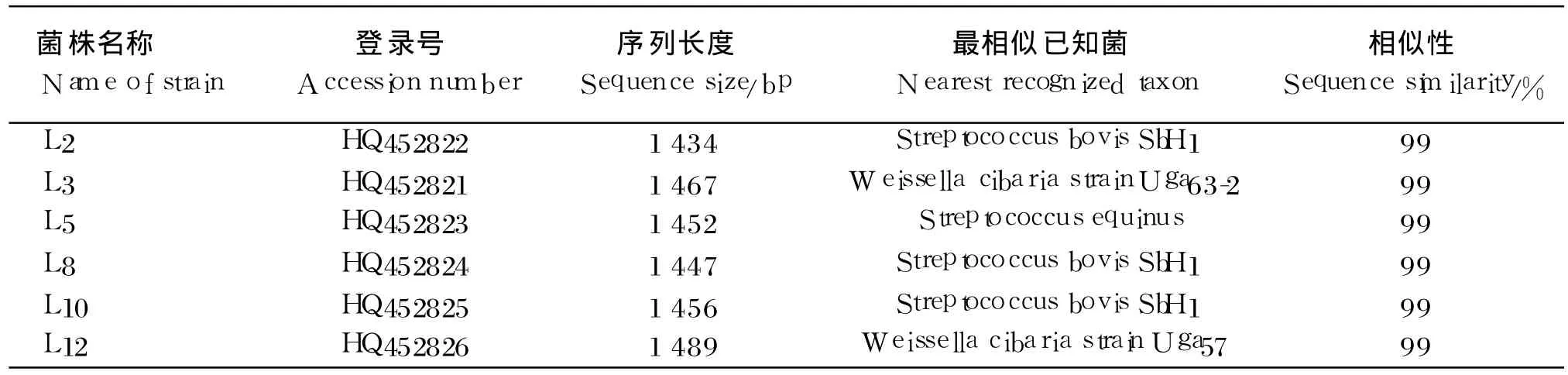
表 2 分离菌株 16S rRNA基因序列与 Genbank已知菌序列的相似性比较Table 2 Comparison of sim ilarity o f 16S rRNA gene sequence in iso lated strains with know n species in GenBank
2.3 生长曲线
各分离菌株生长曲线结果显示,除 L2与L12,其余 4株乳酸产生菌均在接种后 2 h左右进入对数生长期,L5和 L10菌株在接种后 8 h左右进入平台期,其余菌株在接种后 10 h左右入平台期。
2.4 菌株产 D-、L-乳酸的测定
由表 3可见,6株产乳酸菌中,L2产 L-乳酸量最高,显著高于其他各组(P<0.01),其他菌株产 L-乳酸量均达到 14 mmol/L以上。L3、L5和L12产 D-乳酸产量较高,达 14mmol/L以上,而L2、L8和 L10菌株产 D-乳酸量较低,其中 L8产D-乳酸量最低,仅 0.083mmol/L。

图 1 分离菌株的 16S rRNA基因系统发育进化树Fig.1 Phylogenetic tree based on the 16S rRNA gene sequence of isolates

图 2 各菌株生长曲线Fig.2 The grow th curves o f the isolated strains
3 讨 论
反刍动物瘤胃微生物在饲粮降解过程中起着重要作用,当饲粮中精料比例较高时,瘤胃中主要产乳酸菌包括牛链球菌、马链球菌、乳杆菌、栖瘤胃拟杆菌和双岐杆菌,其中牛链球菌最为常见。据报道,在全牧草饲粮条件下,瘤胃中牛链球菌数量在 104~107CFU/g,但在以谷物类饲粮为主时,其数量可达到 1011CFU/g,而这主要归因于链球菌具有较其他瘤胃微生物更快的生长速度[7]。本研究分离到的6株产乳酸菌中,3株为牛链球菌属,从生长曲线结果可见,3株链球菌的生长速度很快,在 10 h内全部进入平台期,说明在以葡萄糖等单糖为底物的条件下,这些菌具有较快的生长速度,是山羊瘤胃中的优势产乳酸菌。马链球菌也是一类常见于动物消化道内的重要肠道菌,该菌可发酵淀粉类多糖生成乳酸,本研究从山羊瘤胃中分离获得 1株马链球菌,结果也进一步证实牛链球菌与马链球菌是瘤胃中 2类主要的乳酸产生菌。魏斯氏菌属(Weissella)是一类广泛分布于发酵食物(如腊肠、泡菜)、土壤等环境中的微生物,属乳酸菌群(lactic acid bacteria),与乳酸杆菌(Lactobacillus)十分相似,通过形态及生化鉴定很难将其完全区分。据报道,目前该属中仅见分离于人类或其他动物的融合魏斯菌、食物魏斯菌,尚无在反刍动物瘤胃中分离获得食窦魏斯氏菌的报道[8]。本试验首次从瘤胃中分离到 2株食窦魏斯氏菌,生长曲线结果显示这 2株菌也具有较高的生长速度,在接种后 10 h内进入平台期。此外,其产 L-与 D-乳酸的都量很高,此结果也说明该菌株可能是山羊瘤胃中另一类主要的产乳酸菌。

表 3 分离菌株产 D-、L-乳酸浓度Tab le 3 Concentrations o f D-and L-lactate p roduced by iso lated strains mmol/L
乳酸杆菌是一类常见于单胃动物胃肠道中的产乳酸菌,但其在反刍动物瘤胃中数量不高,在本研究中我们未分离到乳酸杆菌。据报道,乳酸杆菌仅在瘤胃 pH低于 4.5时才成为主要的优势菌,而在亚临床酸中毒时,瘤胃中主要的产乳酸菌为牛链球菌[9-10]。在本研究中,所用试验动物未达到瘤胃酸中毒状态。结果说明,在常规补饲精料情况下,瘤胃中主要的可培养产乳酸菌可能为牛链球菌、马链球菌和食窦魏斯氏菌。
如前言所述,瘤胃微生物发酵所产乳酸主要包括 L-与 D-乳酸,其中 L-乳酸可被埃氏巨球菌、栖瘤胃拟杆菌等利用生成挥发性脂肪酸,而D-乳酸难以被直接代谢,因此 D-乳酸可能是导致瘤胃 pH下降的主要原因之一。本研究发现,所分离 6株细菌中,食窦魏斯氏菌产D-乳酸的量最高,而所分离的链球菌中,仅 L5所产 D-乳酸量达到 14 mmol/L,结果说明,食窦魏斯氏菌可能是瘤胃中主要的产 D-乳酸的微生物,但由于该菌是首次在瘤胃中分离获得,有关该菌在瘤胃中具体分布及功能情况尚不清楚,待进一步研究。
4 结 论
综上可知,本试验从山羊瘤胃中分离获得 6株产乳酸菌,生化与分子鉴定结果均表明山羊瘤胃中主要的产乳酸菌是牛链球菌、马链球菌与食窦魏斯氏菌,且以产混合型乳酸为主。
[1] IWAMOTO M,ASANUMA N,HINO T.Effects o f energy substrates on nitrate reduction and nitrate reductase activity in a rum inal bacterium,Selenomonas rum inantium[J].Anaerobe,2001,7(6):315-321.
[2] MARCILLAUD S,SCHELCHER F,BRAUN J P.D-lactic acid and D-lactic acidosis in humans and domestic animals:a review[J].Revue de Médecine Vétérinaire,1999,150(3):233-240.
[3] LORENZ I.D-lactic acidosis in calves[J].The Veterinary Journal,2009,197(2):197-203.
[4] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:399-412.
[5] MURRAY A E,PRESTON C M,MASSAWA R,et al.Seasonal and spatial variability of bacterial and archaeal assemblages in the coastal waters near Anvers Island,Antarctica[J].App lied and Environmental M icrobiology,1998,64:2585-2595.
[6] ZOETENDAL E G,AKKERMANS A D L,DE VOSW M.Temperature gradient gel electrophoresis analysis from human fecal sam ples reveals stable and host-specific comm unities of active bacteria[J].Applied and Environmental M icrobiology,1998,64:3854-3859.
[7] NAGARAJA TG,TITGEMEYER E C.Rum inalacidosis in beef cattle:the current m icrobio logical and nutritional outlook[J].Journal of Dairy Science.2007,90(1):17-38.
[8] 李中华,段雄波,李金钟.魏斯菌属细菌的分类与鉴定新进展[J].国际检验医学杂志,2006,27(8):721-723.
[9] OWENS F N,SECRIST D S,HILL W J,etal.A cidosis in cattle:a review[J].Journal of Animal Science,1998,76:275-286.
[10] 王丽娟,刘大程,卢德勋,等.日粮同时添加酵母培养物与延胡索酸二钠与对慢性酸中毒奶山羊瘤胃发酵和细菌数量的影响[J].动物营养学报,2009,21(1):67-71.
