牛轮状病毒双抗体夹心ELISA检测方法的建立
2011-03-13侯美如侯喜林高俊峰刘振格王杰杨明发
侯美如,侯喜林,高俊峰,刘振格,王杰,杨明发
(黑龙江八一农垦大学动物科技学院,大庆163319)
牛轮状病毒是引起犊牛腹泻的重要病原之一[1]。本病主要感染1~7日龄的犊牛,可引起犊牛消化道机能紊乱,临床上以呕吐、腹泻、脱水和酸碱平衡紊乱为特征。感染牛常发生死亡,病死率可达50%。
目前检疫、诊断BRV常用的方法为中和试验、病毒分离、琼扩试验、RT-PCR等。但这些方法都存在着检测时间长或敏感性低等缺点,尤其对处于免疫耐受和持续性感染的牛容易出现漏检。研究以实验室分离并保存的BRV-DQ株建立了双抗体夹心ELISA检测方法,旨在为牛轮状病毒的快速诊断和病原学调查提供一种更好的方法。
1 材料与方法
1.1 细胞、毒株与实验动物
MA104细胞黑龙江八一农垦大学传染病实验室保存。牛轮状病毒(BRV-DQ株),牛呼吸道合胞体病毒(BRSV)、牛冠状病毒(BCV)和牛传染性鼻气管炎病毒(IBRV)均由黑龙江八一农垦大学传染病实验室分离保存;待检40份牛腹泻样品收集于大庆某牧场;2.0-2.5 kg的健康雄性家兔,购买于当地养殖户;体重18-22 g昆明小鼠,购买于长春生物制品研究所。
1.2 主要试剂
DMEM培养基、新生牛血清、胰蛋白酶(1∶250)均购自GIBCO公司;弗氏完全佐剂、弗氏不完全佐剂和HRP标记的羊抗鼠抗体购自 Sigma公司;Q sepharoseTMFast Flow购自HiPrep公司。
TrizolReagent购自Invitrogen公司;M-MuLV反转录酶(200U·μL-1)、HPR IRNA酶抑制剂(40U·μL-1)、dNTP(10mmoL·L-1)、LA Taq DNA聚合酶(5 U·μL-1)、dNTPs(2.5 mmoL·L-1)、DNA Marker DL2 000均购自TaKaRa公司;DEPC水、琼脂糖均购自Sigma公司;引物由上海生工生物工程技术服务有限公司合成。
1.3 病毒的培养及纯化
将轮状病毒与终浓度为20μg·mL-1的胰蛋白酶37℃作用1 h,接种于已长成单层处于对数生长期的MA104细胞,0.5 mL·瓶-1,37 ℃吸附 1 h,间隔15min轻摇1次,使滤液与细胞充分接触。吸附后倒净残液,加入4.5 mL含5μg·mL-1胰酶的维持液(不含血清),于37℃5%CO2培养箱内培养。当出现80%细胞病变(CPE)时收毒,-80℃反复冻融3次后,12 000 r·min-14℃离心1 h,40 000 rpm 4℃离心240min,弃上清,收集病毒,用PBS重新悬浮病毒,用基因定量仪测定其浓度。然后将其分装保存于-80℃备用。
1.4 鼠、兔抗BRV IgG的制备与纯化
1.4.1 鼠抗BRV超免疫血清的制备
以纯化的BRV加弗氏完全佐剂背部皮下多点注射首免小鼠,100μg·只-1;间隔7 d用灭活的BRV加弗氏不完全佐剂加强免疫,100μg·只-1,连续2次,每次间隔7 d,最后1次免疫后7 d当血清琼扩效价达1∶16以上时,即采血分离血清。
1.4.2 兔抗BRV超免疫血清的制备
以纯化的BRV加弗氏完全佐剂兔两侧掌(拓)内皮下注射首免家兔,200μg·只-1;第15 d用BRV加弗氏不完全佐剂皮下多点注射加强免疫,500μg·只-1;第30 d肌肉注射混有双抗的牛IgG抗原200μg,三免1周后,当血清琼扩效价达1∶16以上时,即采血分离血清。
1.4.3 兔、鼠抗BRV IgG的纯化
用饱和硫酸铵沉淀法[3]粗提兔、鼠抗BRV IgG,再以阴离子交换层析(Q sepharoseTMFast Flow)纯化[3,4],用ELISA检测活性蛋白,收集含量最多的活性蛋白峰。并用SDS-PAGE测定其纯度,基因定量仪测定其浓度。
1.5 间接夹心ELISA方法的建立
1.5.1 操作程序
按文献[3]进行操作。
1.5.2 最佳反应条件的选择
在不同的反应条件下,对兔抗BRV IgG包被量(20、10、5、2.5μg·mL-1),鼠抗BRV IgG工作浓度(20、10、5、2.5、1.25μg·mL-1),HRP标记的羊抗鼠IgG稀释度(1∶2 500、1∶5 000、1∶10 000),封闭液的选择(1%明胶、5%脱脂乳、1%BSA、10%胎牛血清),封闭时间(37℃反应30、60、90、120 min)进行ELISA方阵试验,检测同一阳性样品和阴性样品,测定OD450nm值,并计算P/N值,确定兔抗BRV IgG最佳包被浓度、鼠抗BRV IgG最佳浓度、最佳封闭液、封闭时间及酶标抗体工作浓度。
1.5.3 ELISA判定标准
用建立的ELISA方法测定30份BRV阴性样品,计算OD450nm平均值和标准差,阳性临界值=阴性OD450nm平均值+3×标准差,当样品OD450nm值大于阳性临界值时即判为阳性,小于此值则判为阴性。
1.6 重复性试验
1.6.1 板内重复性试验
在同一块酶标板内检测5份不同抗原水平的样品,每份样品重复4孔,按最佳条件进行ELISA。计算同一份样品OD450nm值的变异系数(CV),以检验板内检测样品的重复性。
1.6.2 板间重复性试验
取4块酶标板,以同一批制备的抗体包被,在相同条件下5份不同抗原水平的样品,按最佳条件进行ELISA,计算同一份样品在不同板间OD450nm值的变异系数(CV),以检验板间检测样品的重复性。
1.7 特异性试验
将本实验室保存的牛呼吸道合胞体病毒(BRSV)、牛冠状病毒(BCV)和牛传染性鼻气管炎病毒(IBRV)进行稀释,同时设BRV标准阴、阳性作为对照,每种样品做2个重复,按照双抗体夹心ELISA方法进行检测,以评价该方法的特异性。
1.8 灵敏性试验
将纯化的BRV细胞毒测定含量后,按1∶80、1∶160、1∶320、1∶640、1∶1 280、1∶2 560、1∶5 120倍比稀释,各取100μL进行ELISA检测,计算最低病毒检出量。
1.9 以RT-PCR试验为参照评估本ELISA检测方法
40份牛粪便样品采自大庆地区养殖场,粪便用pH7.0的PBS稀释成200mg·mL-1悬液,微型旋涡振荡2 min,3 000 r·min-1冷冻离心10 min,取上清液,利用本试验建立的ELISA检测方法与RT-PCR[5]同时检测,并将这2种方法的检测结果进行比较,确定本方法的特异性、敏感性和符合率。RT-PCR检测的阴性样品用ELISA检测为阴性的检出率即为特异性;RT-PCR检测的阳性样品用ELISA检测为阳性的检出率即为敏感性;两种方法检测结果一致的血清样本总数占总体样本的比例即为两者的符合率[6]。
2 结果
2.1 病毒的纯化
牛轮状病毒经差速离心(12 000 r·min-14℃离心60 min,40 000 rpm 4℃离心240min)纯化,测定的含量为3.60mg·mL-1。
2.2 鼠、兔抗BRV IgG的纯化
鼠、抗BRV超免疫血清经阴离子交换层析后,共收集到4个蛋白峰,经检测,第2~4峰为活性峰,收集产量最大的第3峰蛋白用于ELISA,测定其含量为2.44mg·mL-1。兔抗BRV超免疫血清经阴离子交换层析后共收集到4个蛋白峰,经检测,第2~4峰为活性峰,收集产量最大的第2峰蛋白用于ELISA,测定其含量为2.56mg·mL-1。
2.3 双抗体夹心ELISA方法的建立
2.3.1 最佳反应条件的确定
通过ELISA方阵试验确定了主要的工作条件:兔抗BRV IgG最佳包被浓度为10μg·mL-1;鼠抗BRV IgG最佳浓度为5μg·mL-1;酶标羊抗鼠IgG最佳工作浓度为1∶5 000;最佳封闭液为5%脱脂乳;最佳封闭时间为1 h。结果见表1。

表1 兔抗BRV IgG和鼠抗BRV IgG最适工作浓度的确定Table 1 Determination of the optimal concentration of coating antibody and mouse-anti-BRV-IgG
2.3.2 ELISA判定标准
用双抗体夹心ELISA检测30份阴性样品的OD450nm值,根据公式计算阳性临界值=阴性OD450nm平均值+3×标准差=0.225 5+0.068 8×3=0.432。因此,以OD450nm值=0.432作为ELISA结果判定的临界值。在阴性和阳性对照成立的情况下,确定OD450nm值≥0.432时,则判为 BRV抗体阳性;OD450nm值<0.432时,则判为BRV抗体阴性。
2.4 重复性试验
用建立的ELISA检测5份不同抗原水平的样品,每份样品重复4次,重复性分析结果可见其板内变异系数在3.64%~5.87%之间,板间变异系数在4.60%~8.75%之间,板间、板内变异系数匀小于10%,说明此方法具有较好的重复性。
在新一代技术融合图书馆服务的实践中,手机技术是应用广泛而投入较小的。我团队于2016年与本地一家公司合作,围绕纸质图书服务设计了10多种功能,实施效果良好。基于此,该项目在2018年6月获得了全国高校应用案例二等奖。
2.5 特异性试验
建立的双抗体夹心ELISA只与BRV阳性样品反应,与其他3种牛病的阳性样品的OD450nm值均小于0.432,无交叉反应性,表明本试验所建立的双抗体夹心ELISA方法有较好的特异性。
2.6 灵敏性试验
随着病毒含量的降低,其OD450nm值呈线性下降,当纯化病毒1∶2 560稀释(病毒含量为1.41μg·mL-1)时,结果为阳性(OD450nm值为0.491),而稀释度为1∶5 120时,结果为阴性(OD450nm值为0.403),则该方法可检测的最低病毒浓度为1.41μg·mL-1,具有较高的敏感性。
2.7 以RT-PCR试验为参照评估本ELISA检测方法
利用本试验建立的双抗体夹心ELISA检测方法与RT-PCR试验同时检测40份牛粪便样品,检测结果见表 2,利用制备的兔抗 BRV IgG和鼠抗BRV IgG蛋白建立的双抗体夹心ELISA与RT-PCR试验的符合率达95%。
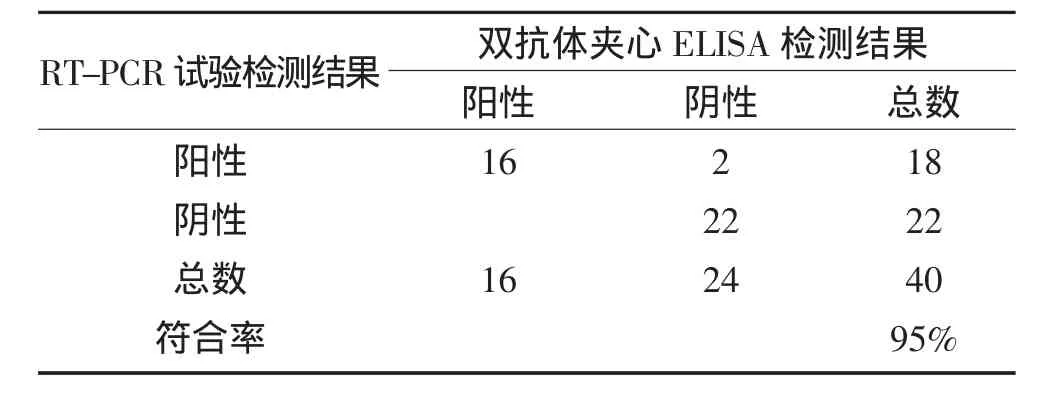
表2 双抗体夹心ELISA方法与RT-PCR试验的比较结果Table 2 Comparison between Sandwich ELISA and RT-PCR test for detecting field samples
3 讨论
建立双抗体夹心ELISA方法检测牛轮状病毒,其中使用的兔、鼠抗BRV IgG纯度是试验成功的关键,其纯度越高(非特异性抗体和杂蛋白越低),非特异性反应越低。本试验通过硫酸铵沉淀后用阴离子交换层析的方法,对自制的兔、鼠抗BRV IgG进行纯化,以达到降低非特异性反应的目的。
离子交换层析与硫酸铵沉淀法联合使用可以有效地纯化抗体。初步分离纯化时,采用饱和硫酸铵(SAS),依次以50%、40%、33%饱和度的硫酸铵溶液纯化一次,即可得到较纯的抗体粗制品[7]。本试验根据lgG的特性,和其等电点为5.5~8.3的性质,选用Q sepharoseTMFast Flow阴离子交换柱对其进行纯化。Q sepharoseTMFast Flow阴离子交换柱是目前国际上趋向于使用的一种强离子交换剂,其具有流速高,交换容量大等特点,适用于IgG的纯化。使用Q sepharoseTMFast Flow阴离子交换柱在pH8.5条件下对鼠、兔抗BRV IgG粗提产物进行纯化,能够将目的蛋白分离出来。较高pH值的Buffer A对免疫球蛋白的活性并没有产生影响。并以牛轮状病毒为包被抗原建立间接ELISA方法,测定不同蛋白峰活性,结果表明同时有多个蛋白峰都具有免疫活性,取不同活性峰蛋白以SDS-PAGE来鉴定其纯度,并筛选试验使用所需的蛋白峰。该方法可获得浓度大、纯度高的目的蛋白。
试验通过方阵滴定试验对双抗体浓度和酶标羊抗鼠IgG浓度条件进行筛选,确定鼠抗BRV IgG、兔抗BRV IgG和酶标羊抗鼠IgG稀释度为5μg·mL-1、10μg·mL-1、1∶5 000时,效果最好。并对最佳封闭液,最佳封闭时间,最佳二抗工作浓度进行优化试验,尽最大可能低了非特异性反应的发生,从而提高了其敏感性。试验证明只在检测牛轮状病毒阳性抗原时,ELISA反应呈阳性,而与牛呼吸道合胞体病毒(BRSV)、牛冠状病毒(BCV)和牛传染性鼻气管炎病毒(IBRV)抗原呈阴性反应,说明所建立的双抗体夹心ELISA方法具有特异性。
本试验建立的双抗体夹心ELISA,可应用于快速检测牛轮状病毒抗原,其敏感性较高,最低能检测到含量为1.41μg·mL-1的轮状病毒抗原。并与其中检测抗原的RT-PCR方法进行比较,符合率为95%。由此可见,双抗体夹心ELISA方法与RT-PCR的检测结果具有较高的符合率。
在细胞培养物和粪便样品标本中均存在三种形式的病毒粒子,即具有双层衣壳的完整病毒粒子(由VP1,2,3,4,6,7组成),具有单层衣壳的病毒粒子(由VP1,2,3,6组成),不成熟的只有空衣壳的病毒颗粒(由VP1,2,3组成)[8],其中单层衣壳的病毒粒子以VP6蛋白为外衣壳,并且在A群轮状病毒中,VP6蛋白的基因在序列上具有高度的保守性,且蛋白具有良好的抗原性和免疫原性[9],从理论上使本试验建立的双抗体ELISA可检测不同血清型的A群轮状病毒成为可能。
目前,牛轮状病毒在世界范围内分布较广,感染率也较高,对养牛业危害极大[10]。本研究以纯化的兔、鼠抗BRV IgG为原料建立双抗体夹心ELISA方法,其特异性强、重复性好、省时省力、操作简便,易于推广应用,适合大批量地检测,为BRV检测试剂盒的研制奠定了基础。
[1]R de la Fuente,A Garcia,JA Ruiz-Santa-Quiteria,etal.Proportional morbidity rates of enteropathogens among diarrheic dairy calves in central Spain[J].Preventive Veterinary Medicine,1998,36;145-152.
[2]王重庆.分子免疫学基础[M].北京:北京大学出版社,2003.
[3]黄小波,徐璐,曹三杰,等.猪轮状病毒双抗体夹心ELISA诊断方法的建立[J].中国兽医科学.2009,39(08);723-727.
[4]CORTHIER G,BOSCHETTIEJ.Improved method for IgG purification from various animal species by ion exchange chromatography[J].Immunol Meth,1984,66;75-79.
[5]柳强,侯喜林,车车,等.牛冠状病毒和轮状病毒的双重RT-PCR检测方法的建立及应用[J].中国预防兽医学报.2009,31(9);701-704.
[6]王红,余丽芸,侯喜林,等.牛呼吸道合胞体病毒重组N蛋白间接ELISA方法的建立及应用[J].中国农业科学.2010,43(20);4303-4309.
[7]王延华,抗体理论与技术[M].北京:科学出版社,2009.
[8]崔晓辰,A群轮状病毒单克隆抗体及免疫胶体金试纸条制备[D].黑龙江:东北农业大学,2008.
[9]Kejian Yang,ShixiaWang,Kyeong-Ok Chang etal.Immune responses and protection obtained with rotavirus VP6 DNA vaccines given by intramuscular injection[J].Vaccine,2001,19;3285-3291.
[10]王洁清,牛轮状病毒RT-PCR检测和基于VP6重组抗原检测血清抗体ELISA方法初步建立[D].黑龙江:东北农业大学,2009.
