木瓜愈伤组织中齐墩果酸的含量测定
2011-03-13黄玉兰岳才军张福振
黄玉兰,岳才军,张福振
(黑龙江八一农垦大学生命科学技术学院,大庆163319)
木瓜别名皱皮木瓜、宣木瓜,为我国特有的野生果木之一。木瓜为蔷薇科木瓜属植物,用途广泛,集观赏、食用、药用于一体[1]。传统中医认为木瓜有舒筋活络、健脾开胃、舒肝止痛的功效[2,3]。现代研究表明,木瓜富含多种氨基酸及营养元素,并含有齐墩果酸、黄酮、SOD等活性物质,其中齐墩果酸(Oleanolic acid,简称OA)为木瓜的主要药效成分,具有消炎抑菌、降低转氨酶,促进肝细胞再生、防止肝硬化、降血脂、降血糖、提高机体免疫功能等作用,是当前治疗肝炎的有效药物之一[4]。
木瓜中齐墩果酸可由种子或果实中提取,多采用有机酸、醇、碱等方法,但存在提取率低、资源浪费、污染严重的弊端。研究表明,在培养的植物细胞、组织中,大部分次生代谢产物的含量超过了野生植物的含量,这也是植物细胞工程在中药现代化过程中具有巨大发展前景的重要原因之一[5]。本试验从木瓜芽孢中诱导出木瓜愈伤组织,并确立了愈伤组织中齐墩果酸的比色测定方法,为木瓜细胞的悬浮培养及齐墩果酸的工业化生产奠定基础。
1 材料和方法
1.1 材料
实验材料为超市购买的木瓜,木瓜籽先用自来水、再用蒸馏水冲洗干净后待用;齐墩果酸标准品,批号为110709-200304,中国药品生物制品检定所;香草醛、高氯酸、冰醋酸、蔗糖等,均为分析纯;NAA(萘乙酸),2,4-D(2,4-二氯苯氧乙酸),6-BA(6-苄氨基嘌呤)为常规生化试剂。
1.2 愈伤组织诱导
用40mg·L-1的赤霉素处理24 h,再用质量浓度为1 g·L-1的HgCL2将木瓜种子表面消毒8~10min,用灭菌水冲洗3~4次用于接种到MS培养基上,长出芽孢状后,再将芽孢切成0.2 cm×0.3 cm的小块,接种在MS附加2,4-D、6-BA、NAA的不同激素组合的固体培养基中,其中蔗糖30 g·L-1,琼脂7 g·L-1,pH5.8~6.0,培养基分装于100mL的三角烧瓶中,每瓶40mL,温度(25±1)℃,进行暗培养,测其愈伤组织诱导情况。
1.3 愈伤组织中齐墩果酸含量的测定
1.3.1 齐墩果酸的提取
取适量木瓜愈伤组织培养细胞烘干,粉碎,分成3份,每份1.000 g,精密秤定,加20 mL 95%乙醇浸泡10 h,然后将泡好材料装入自制的渗漉筒(针管)中,开始渗漉,控制流速(3~5滴·min-1),至滤液几乎无色。再用水浴锅对渗漉液进行干燥,得干浸膏,并加入0.5mL 95%乙醇溶解,并定容,待测定用。
1.3.2 齐墩果酸含量的测定方法
1.3.2.1 齐墩果酸标准品的配制
以齐墩果酸为标准品,精密称取干燥至恒重的齐墩果酸标准品0.003 7 g,以甲醇溶解,定容至10mL。
1.3.2.2 齐墩果酸标准曲线的制备
精密吸取齐墩果酸标准品10、50、100、200、250μL,分别置于10mL具塞试管中,水浴挥干溶剂加入新配制的5%香草醛冰醋酸溶液0.2 mL、高氯酸0.8mL,于60℃水浴中保温15min,立即置于冰水中冷却5 min,加冰醋酸5 mL,摇匀后放置10 min,以空白试剂作参比,在547 nm波长处立即测量吸光度。以蒸馏水做空白对照,得齐墩果酸标准曲线[6]。
1.3.2.3 齐墩果酸的含量测定
分别取样品液20μL,标准液20μL,分别点于同一硅胶G板上,以氯仿-丙酮(4∶1)为展开剂展开,待展开至硅胶板上端边缘还有1厘米处取出,挥去溶剂,喷以5%磷钼酸,于105℃烘5 min,刮取与对照品相同位置上的蓝色斑点,置具塞试管中[7]。先精密加入新制的5%香草醛冰醋酸液0.2 mL及高氯酸0.8mL,在70℃恒温水浴加热15min,流水冷却至室温,再精密加入乙酸乙酯4 mL,摇匀,离心取上清液在547 nm处测定,并根据标准曲线换算出样品齐墩果酸的含量[8]。
2 结果与讨论
2.1 不同植物激素对诱导愈伤组织的影响
不同激素种类、浓度诱导木瓜芽孢形成愈伤组织的能力,结果见表1。

表1 NAA、2,4-D和6-BA的组合对木瓜芽孢愈伤组织诱导的影响Table 1 The effectof NAA,2,4-D,and 6-BA combination on Chaenomeles lagenaria spore callus
从表1看出:2,4-D对诱导芽孢愈伤组织具有很好的效果,诱导率也很高,附加的NAA对愈伤组织产生无明显促进作用,这与文献报道相符[8]。诱导愈伤组织的最适培养基为MS+2,4-D2.5 mg·L-1+6-BA0.5mg·L-1。在最适培养基中,接种15 d后开始有黄绿色和淡黄色絮状愈伤组织出现在切面表面,初期愈伤组织生长缓慢,芽胞内部组织未愈伤化。40 d左右,将愈伤组织及内部切成小块进行继代培养,以后每30 d继代1次,当继代2次后,其内部组织全部愈伤化,愈伤组织生长量大,大多为淡黄色,致密和疏松兼有,颗粒状。可见木瓜芽胞的愈伤组织先从表面发生,以后逐渐向内生长,这与张美萍等(1999)报道的相似[9]。
2.2 齐墩果酸的含量测定
2.2.1 标准曲线的制备
以吸光度(A)对标准品量(C)作图,用最小二乘法得其线性回归方程为A=0.004 5x+0.013,相关系数r=0.999 3,表明齐墩果酸在3.70~92.50μg·mL-1范围内很好地符合朗伯-比尔定律。
2.2.2 分离结果及含量测定结果
由层析结果看出各种培养基上的愈伤组织提取液都有与标准品对应的层析点(图1)。紫外扫描分析得出与标准品完全相同的吸收光谱,证明提取物为齐墩果酸。然后用分光光度法进行定量测定,结果见表2。

图1 齐墩果酸样品分离图谱Fig.1 Oleanolic acid separationmap
根据齐墩果酸的标准曲线换算出样品齐墩果酸 的含量,结果见表2。
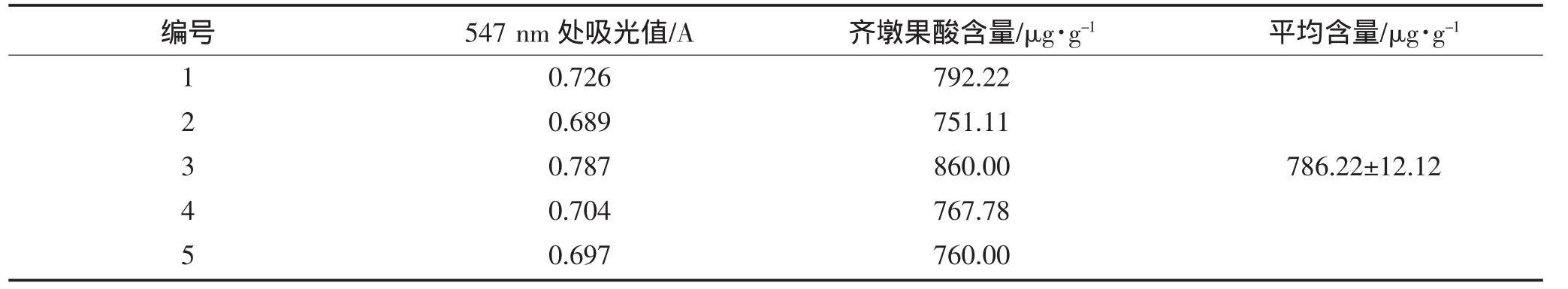
表2 样品中齐墩果酸的含量测定结果Table 2 Content determination of oleanolic acid
从表2可以看出所测木瓜愈伤组织中齐墩果酸含量比较可观,达0.078%,高于姚秀玲等(2005)测定的鲜木瓜中齐墩果酸含量[10]。
3 结论
在木瓜愈伤组织继代培养过程中,愈伤组织在激素组合MS+2,4-D2.5 mg·L-1+6-BA 0.5 mg·L-1的MS培养基中生长速度快,状态良好。采用薄层色谱-分光光度法测定木瓜愈伤组织中齐墩果酸的含量,方法简便、可靠,实际可行,为木瓜细胞的悬浮培养及齐墩果酸的工业化生产奠定基础。
[1]黄锁义,刘海花,黎海妮,等.超声波提取木瓜叶总黄酮及其鉴别[J].时珍国医国药,2006,17(10):167-168.
[2]吴虹,魏伟,吴成义.木瓜化学成分及药理活性的研究[J].安徽中医学院学报,2004,23(2):62-64.
[3]孙连娜,洪永福.简述中药木瓜的化学、药理与临床应用研究[J].药学实践杂志,1999,17(5):281-283.
[4]王丹丹,葛文中.齐墩果酸衍生物合成及抗肿瘤活性的研究[J].黑龙江八一农垦大学学报,2010,22(3)84-88.
[5]唐春红,项昭保,叶志义,石轶松,等.木瓜中齐墩果酸的提取工艺研究[J].食品工业科技,2000,21(4):10-12.
[6]阮洪生,陈志宝,朱丹,等.豆粕中大豆皂苷提取工艺的研究[J].粮食与食品工业,2008,1(15):15-17.
[7]陈明珠.齐墩果酸片的比色测定[J].中草药,1981,12(9)13-14.
[8]张治国,韩献忠,蔡志光,等.条叶龙胆愈伤组织培养及龙胆苦甙形成[J].植物学报,1992,34(2):96-100.
[9]张美萍,王义,罗维莹,等.西洋参愈伤组织培养及皂甙含量分析[J].吉林农业大学学报1999,21(1):46-48.
[10]姚秀玲,吕晓玲,李肇奖.木瓜中齐墩果酸的测定方法研究[J].现代食品科技,2005,21(3)126-128.
