丙丁酚对高糖环境下人视网膜血管内皮细胞增殖及VEGF表达的影响
2011-03-12彭辉灿
李 梅 彭辉灿
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病晚期的严重并发症之一。视网膜新生血管(retinal neovascularization,RNV)的形成是其主要致盲因素,预防RNV的形成至关重要。已有研究发现,血管内皮生长因子(vascular endothelial growth factor,VEGF)在新生血管生成中是必不可少的重要诱导因子[1]。丙丁酚(普罗布考,Probucol)在20世纪70年代作为一种降脂药物应用于临床[2],具有抗氧化、抗炎、抑制内膜增生和血管重构及改善内皮细胞功能的作用。本研究观察丙丁酚对于体外培养的高糖环境下人视网膜微血管内皮细胞(human retinal capillary endothelial cells,HRCEC)增殖抑制及VEGF表达的影响。
1 材料与方法
1.1 材料 丙丁酚(美国Sigma公司);胰蛋白酶(美国Sigma公司);胎牛血清(杭州四季青公司);DMEM培养液(武汉博士德公司);噻唑蓝(MTT)和二甲基亚砜(DMSO;AMRESCO公司);兔抗人Ⅷ因子IgG、兔抗人VEGF-IgG、免疫细胞化学试剂盒、DAB试剂盒(武汉博士德公司);培养瓶、培养皿、眼科器械。
1.2 实验方法
1.2.1 HRCEC培养 取材于手术室角膜移植术后新鲜人眼球,参考文献[3-4]的培养方法进行HRCEC原代培养。将培养瓶置于37℃、含体积分数5%CO2培养箱内,每2 d换液1/3~1/2,待细胞长满瓶底约80%,按1∶2传代。
1.2.2 HRCEC鉴定 相差显微镜观察细胞的生物学形态特征,将盖玻片放入6孔板内,细胞爬片后,运用免疫细胞化学方法检测第Ⅷ因子相关抗原抗体,显微镜下观察其表达。
1.2.3 实验分组 实验分为以下7组:0组:不加细胞只加培养基的调零组;GL组:低糖对照组;G0组:高糖对照组;G1组:高糖+5 μmol·L-1丙丁酚组; G2组:高糖+10 μmol·L-1丙丁酚组;G3组:高糖+ 20 μmol·L-1丙丁酚组;G4组:高糖+40 μmol·L-1丙丁酚组;G5高糖+80 μmol·L-1丙丁酚组。丙丁酚作用时间均为24 h。高糖的葡萄糖浓度为25 mmol·L-1,低糖的葡萄糖浓度为5.5 mmol·L-1。
1.2.4 MTT检测HRCEC的增殖 取生长良好的第3-4代HRCEC用于实验。弃培养基,PBS洗2次,2.5 g·L-1胰酶消化,加含体积分数20%胎牛血清高糖或低糖DMEM培养液,分别制成高糖和低糖细胞悬液,调整细胞浓度为60×106L-1,加入96孔板中,高糖共6组,低糖1组,以及调零组1组,每组6个复孔,每孔180 μL。将96孔板置于37℃、含体积分数5% CO2培养箱内,24 h待细胞贴壁后G1~G5组分别加20 μL不同浓度丙丁酚,使丙丁酚终浓度分别为5 μmol·L-1、10 μmol·L-1、20 μmol·L-1、40 μmol· L-1、80 μmol·L-1。培养20 h后,每孔加5 g·L-1MTT液20 μL,培养4 h后终止培养,弃培养基,用滤纸吸干水分,每孔加150 μL DMSO原液,振荡10 min,待蓝紫色结晶完全溶解后,用自动酶标仪570 nm波长测吸光度A值。上述条件下重复实验3次。计算细胞增殖抑制率=[1-(实验组A值-空白组A值)/ (对照组A值-空白组A值)]×100%。
1.2.5 免疫细胞化学方法检测VEGF的表达 将消毒灭菌并标记好的医用盖玻片放入无菌的6孔板中,制作密度为60×106L-1的HRCEC悬液,每孔2 mL,培养24 h待细胞贴壁后分为5组。分别为低糖对照组GL:含体积分数10%胎牛血清低糖DMEM培养;高糖对照组G0:含体积分数10%胎牛血清高糖DMEM培养;高糖加药组G1、G4、G5:含体积分数10%胎牛血清高糖DMEM培养+终浓度分别为5 μmol·L-1、40 μmol·L-1、80 μmol·L-1丙丁酚组,每组2个复孔。继续培养24 h后,取出盖玻片,PBS液洗涤,40 g·L-1多聚甲醛室温固定20 min,体积分数3%H2O2-甲醇封闭内源性过氧化物酶,PBS液洗涤后加入兔抗人VEGF-IgG一抗(1∶100),另一复孔加入PBS液,4℃过夜,PBS液洗涤,SABC法染色,DAB显色,苏木素复染。梯度酒精脱水,中性树脂封片。以PBS液代替一抗为阴性对照。阳性染色为细胞内棕黄色颗粒。对各组进行灰度值测定,以背景灰度值与阳性灰度值之差作为每组灰度值。
2 结果
2.1 HRCEC的培养与鉴定 在倒置相差显微镜下观察细胞形态:HRCEC呈现铺路石样单层贴壁生长(图1)。运用免疫细胞化学方法鉴定:经第Ⅷ因子相关抗原抗体染色,HRCEC胞浆中有棕黄色着色(图2),阴性对照组无着色,均证实体外成功培养出HRCEC。
2.2 MTT检测丙丁酚对HRCEC增殖的影响MTT比色法检测显示不同浓度丙丁酚处理对数生长期的HRCEC培养24 h,在相同培养时间条件下,低糖对照组与高糖对照组相比,差异无统计学意义(表1,P=0.067>0.05)。不同浓度丙丁酚对HRCEC增殖有明显抑制作用,随着丙丁酚浓度的逐渐提高,细胞存活率逐渐下降,而细胞抑制率逐渐升高。含不同浓度丙丁酚组吸光度A值明显降低,与高糖对照组相比,差异均有统计学意义(均为P<0.05),并且含不同浓度丙丁酚组中各组之间两两比较差异亦均有统计学意义(均为P<0.05)。

Figure 1 HRCEC fused into cobblestone-like single layer HRCEC融合成单层,犹如铺路石

Figure 2 Primary cultured HRCEC showed positive staining forⅧmonoclonal antiboby 原代培养的HRCECⅧ因子抗体染色阳性
表1 丙丁酚对HRCEC增殖的影响Table 1 Effect of probucal on proliferation of HRCEC (s,n=6)

表1 丙丁酚对HRCEC增殖的影响Table 1 Effect of probucal on proliferation of HRCEC (s,n=6)
Group A570Inhibiting rate/% 0 0.101 5±0.009 4 / GL 0.917 2±0.011 6 / G0 0.931 7±0.012 3 / G1 0.862 8±0.011 1 8.40 G2 0.760 8±0.010 3 20.84 G3 0.645 5±0.022 1 34.90 G4 0.560 0±0.010 9 45.32 G50.477 5±0.010 6 55.38
2.3 丙丁酚对HRCEC中VEGF表达的影响
2.3.1 免疫细胞化学检测结果 VEGF定位于胞膜和胞浆,阳性部分为棕黄色颗粒,低糖对照组、高糖对照组与高糖+丙丁酚浓度分别为5 μmol·L-1、40 μmol·L-1、80 μmol·L-1作用于HRCEC 24 h,免疫细胞化学背景灰度值与阳性灰度值之差分别为28.75±3.77、71.93±8.37、54.67±4.33、41.43± 3.45、29.18±3.37。与高糖对照组相比,加药组作用24 h VEGF表达明显下降,差异均有统计学意义(图3-图5,均为P<0.05),且呈质量浓度依赖性,胞浆内阳性颗粒随着药物作用浓度的增加而减少,颜色逐渐变淡。与低糖对照组相比,高糖对照组VEGF的表达明显增加(P<0.05),胞膜及胞浆内阳性颗粒较密集,颜色较深。
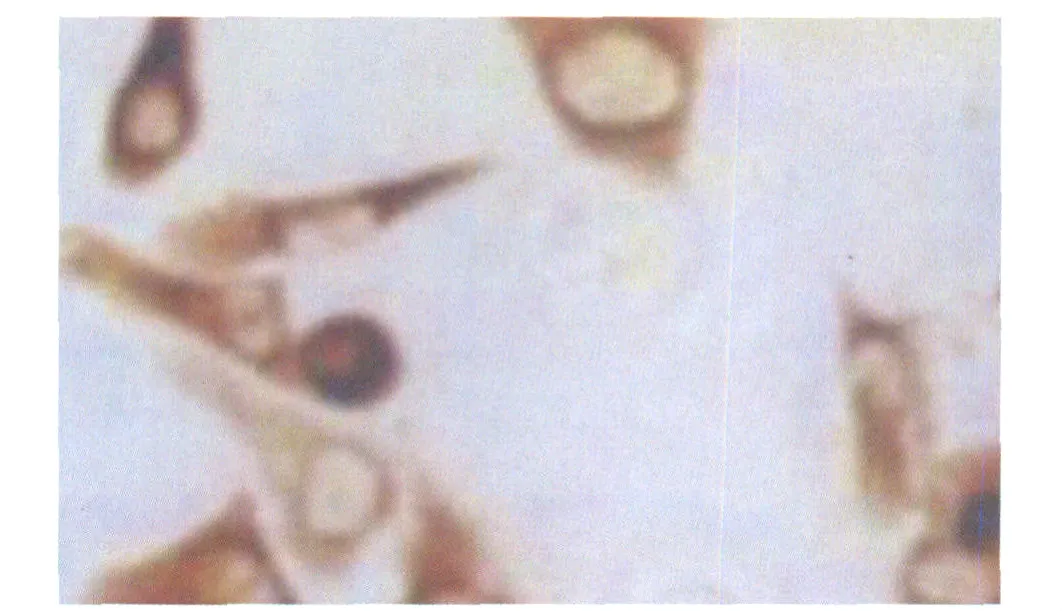
Figure 3 Expression of VEGF in HRCEC in high glucose group高糖对照组HRCEC中VEGF的表达

Figure 4 Expression of VEGF in HRCEC in 40 μmol·L-1probucal+high glucose group 高糖+40 μmol·L-1丙丁酚组HRCEC中VEGF的表达
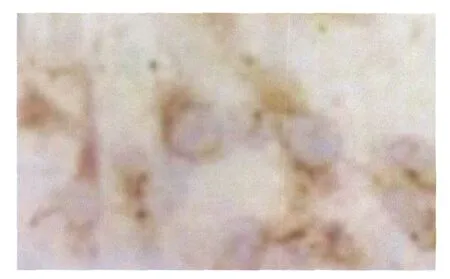
Figure 5 Expression of VEGF in HRCEC in high glucose+80 μmol·L-1probucal group 高糖 +80 μmol·L-1PBC组HRCEC中VEGF的表达
3 讨论
DR是糖尿病微血管病变的重要并发症之一,发病机制目前并不完全清楚。目前认为,高血糖除通过经典的多元醇途径、糖基化终末产物(AGE)途径、蛋白激酶C(PKC)途径和己糖胺途径促进DR的进展外,多种细胞因子如VEGF、HIF-1、肿瘤坏死因子等在糖尿病新生血管形成中起作用[5]。增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)是DR致盲的主要原因,新生血管是其标志性的病理改变。在PDR患者房水或玻璃体液中,促血管新生因子水平如VEGF、细胞因子、生长因子等显著升高[6-8],其中VEGF可能起着最关键的作用[8]。研究表明,VEGF具有促进血管通透性增加、导致细胞外基质变性、诱导血管内皮细胞迁移增殖和血管形成等作用[9],而血管内皮细胞的活动是新生血管形成的中心环节,任何体内体外的因素作用于血管内皮细胞都可以影响血管新生的过程。相应的治疗如激光光凝、经瞳孔光动力学治疗及玻璃体手术等,虽有一定的疗效,但同时存在许多不良反应和局限性[10-12]。研究表明,单独灭活VEGF即可广泛抑制生理性和病理性新生血管形成[13]。因此,抗血管新生因子尤其是抗VEGF及其受体的研究具有很大意义[8]。
丙丁酚是临床常用的降脂药,其药理学作用: (1)具有显著降低血浆胆固醇并促进胆固醇逆转运; (2)抗氧化作用:丙丁酚除能有效抑制低密度脂蛋白和高密度脂蛋白的氧化外,Iqbal等[14]发现丙丁酚能有效抑制微粒体膜脂质过氧化DNA损伤;(3)改善内皮功能,选择性抑制黏附因子表达、减少细胞间黏附[15];(4)抗炎作用:丙丁酚能够通过减少巨噬细胞分泌白介素-1(interleukin-1,IL-1)和肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)的表达,抑制黏附分子的表达[16];(5)抑制内膜增生和血管重构,Tanous等[17]实验发现,丙丁酚通过促进内膜重建,能够有效地抑制支架内的血栓形成;(6)丙丁酚和胰岛素联合应用,可显著提高胰岛素的治疗效果和降低并发症的发生[18]。本实验将丙丁酚作用于体外培养的高糖下HRCEC,观察其对HRCEC细胞增殖和VEGF表达的影响。通过MTT比色法检测不同浓度的丙丁酚作用24 h对原代培养的HRCEC的增殖抑制,结果表明丙丁酚对高糖下HRCEC增生抑制率呈明显的质量浓度依赖趋势。免疫细胞化学方法检测正常低糖及不同浓度的丙丁酚作用下的高糖下的HRCEC中 VEGF的表达,结果发现高糖条件下HRCEC中VEGF的表达明显增加,丙丁酚能下调高糖下HRCEC中VEGF表达,浓度为5 μmol·L-1时起作用,到达80 μmol·L-1时下调作用明显。我们推测丙丁酚抑制高糖下HRCEC的增殖可能是通过下调 VEGF的表达而发生作用。但丙丁酚下调VEGF表达的信号通路及具体作用调控点尚待进一步研究。
综上所述,丙丁酚能抑制高糖下HRCEC的增殖并下调其VEGF的表达,丙丁酚对预防RNV的形成、发展具有重要的积极意义。
1 Ferrara N,Davis-Smyth T.The biology of vascular endothelial factor[J].Endocr Rev,1997,18(1):4-25.
2 Michihara A,Sawamura M,Yamori Y,Akasaki K,Tsuji H.Probucol decreases mevalonate pyrophosphate decarboxylase in the rat liver[J].Biol Pharm Bull,2003,26(10):1484-1486.
3 李 斌,唐仕波,张 革,陈剑虹,李宝金.人类视网膜血管内皮细胞的培养与鉴定[J].眼科研究,2005,23(1):20-22.
4 Capetandes A,Gerritsen ME.Simplified methods for consistent and selective culture of bovine retinal endothelial cells and percytes[J].Invest Ophthalmol Vis Sci,1990,31(9):1738-1744.
5 Jenchitr W,Sothhornwit N,Srisuwanporn S,Wutthiphan S,Pathamasingna-Ayutaya S,Ratanasirintrawut S.Diabetic retinopathy in Priest Hospital[J].J Med Assoc Thai,2008,91(Suppl 1):119-129.
6 Watanabe D,Suzuma K,Suzuma I,Ohashi H,Ojima T,Kurimoto M,et al.Vitreous levels of angiopoietin 2 and vascular endothelial growth factor in patients with proliferative diabetic retinopathy[J].Am J Ophthalmol,2005,139(3):476-481.
7 Petrovic MG,Korosec P,Kosnik M,Osredkar J,Hawlina M,Peterlin B,et al.Local and genetic determinants of vascular endothelial growth factor expression in advanced proliferative diabetic retinopathy[J].Mol Vis,2008,14(8):1382-1387.
8 Arevalo JF,Garcia-Amaris RA.Intravitreal bevacizumab for diabetic retinopathy[J].Curr Diabetes Rev,2009,5(1):39-46.
9 Kim SH,Choi HY,Lee J,Son DS,Lee HS,Song IS,et al.Elevated activities of MMP-2 in the non-tumorous lung tissues of curatively resected stage I NSCLC patients are associated with tumor recurrence and a poor survival[J].J Surg Oncol,2007,95 (4):337-346.
10 Grant MB,Afzal A,Spoerri P,Pan H,Shaw LC,Mames RN.The role of growth factors in the pathogenesis of diabetic retinopathy[J].Exp Opin Invest Drugs,2004,13(10):1275-1293.
11 Ho AC.Laser treatment in eyes with drusen[J].Curr Opin Ophthalmol,1999,10(3):204-208.
12 Miller H,Miller B.Photodynamic therapy of subretinal neovascularization in the monkey eye[J].Arch Ophthalmol,1993,111 (6):855-860.
13 Lee MJ,Roy NK,Mogford JE,Schiemanna WP,Mustoe TA.Fibulin-5 promotes wound healing in vivo[J].J Am Coll Surg,2004,199(3):403-410.
14 Iqbal M,Sharma SD,Okada S.Probucol as a potent inhibitor of oxygen radical-induced lipid peroxidation and DNA damage:in vitro studies[J].Redox Rep,2004,9(3):167-172.
15 Zapolska-Downar D,Zapolski-Downar A,Markiewski M,Ciechanowicz A,Kaczmarczyk M,Naruszewicz M.Selective inhibition by probucol of vascular cell adhesion molecule-1(VCAM-1)expression in human vascular endothelial cells[J].Atherosclerosis,2001,155(1):123-130.
16 Niemann-Jonsson A,Dimayuga P,Jovinge S.Accumulation of LDL in rat arteries is associated with activation of tumor necrosis factor-α expression[J].Arterioscler Thromb Vasc Biol,2000,20(10):2205-2211.
17 Tanous D,Brasen JH,Choy K,Wu BJ,Kathir K,Lau A,et al.Probucol inhibits instent thrombosis and neointimal hyperplasia by promoting reendothelialization[J].Atherosclerosis,2006,189 (2):342-349.
18 Yoshida M,Kimura H,Kyuki K,Ito M.Combined effect of probucol and insulin on renal damage in diabetic rats fed a high cholesterol diet[J].Eur J Pharmacol,2005,513(1-2):159-168.
