携带泛素-HBc Ag融合基因的慢病毒表达载体构建及其体外诱导小鼠髓源性树突状细胞成熟
2011-03-09陈建华余永胜臧国庆汤正好
陈建华,余永胜,奚 敏,江 红,臧国庆,汤正好
1.苏州大学医学部,江苏苏州 215213;2.上海交通大学附属第六人民医院感染病科
较弱的CTL反应可能是导致HBV感染慢性化的主要原因[1-5]。
泛素-蛋白酶体系统是细胞内重要的蛋白质降解途径,抗原泛素化是MHC-Ⅰ类分子提呈所必需的环节[6]。
HBV慢性感染者中树突状细胞(dendritic cells, DC)抗原提呈能力低下,造成细胞免疫低下[7]。因此,本研究主要通过构建携带强制泛素化HBcAg基因的慢病毒表达载体,并包装成重组慢病毒,研究其对体外培养的小鼠树突状细胞成熟的诱导能力,期望能得到成熟DC以用于抗HBV感染。
1 材料与方法
1.1 材料 携带有泛素-HBcAg基因质粒pcDNA3.1 (-)-Ub-HBcAg和携带有完整HBcAg基因质粒pcDNA3.1(-)-HBcAg由本实验室构建保存[8];慢病毒骨架质粒pWPXLd、包装质粒psPAX2、包膜质粒PMD2.G和人胚肾上皮细胞系 293T细胞由南京医科大学李建民教授提供;感受态菌株DH 5α购自TIANGEN公司; RT-PCR试剂盒、DNA胶回收试剂盒、DNA分子量标记均为TaKaRa公司产品;限制性内切酶BamHⅠ、MluⅠ均购自New England Biolabs公司;无内毒素质粒小抽试剂盒为QIAGEN公司产品;DMEM细胞培养基及优质胎牛血清购自Gbico公司;Lipofectamine 2000转染试剂盒为Invitrogen公司产品;鼠抗人HBcAg单克隆抗体及羊抗鼠IgG-HRP为SANTA CRUZ公司产品;Western试剂购自碧云天公司;重组鼠GM-CSF和重组鼠IL-4为美国Peprotech公司产品;FITC标记的小鼠CD11c、CD86、CD 80和MHC-Ⅱ类分子单克隆抗体及小鼠IL-12 ELISA试剂盒为ebioscience公司产品;引物合成及测序分析由上海生工生物工程技术服务有限公司完成。
1.2 Ub-HBcAg基因片段的扩增 以pcDNA3.1 (-)-Ub-HBcAg为模板,设计引物P1、P2,上游引物P1中含BamHⅠ酶切位点,下游引物P2中含MluⅠ酶切位点。rTaq DNA聚合酶扩增Ub-HBcAg基因片段。50μL体系反应条件如下:94℃×5 min;94℃×1 min,58℃×40 s,72℃×45 s,30个循环;延伸72℃×10 min。琼脂糖凝胶电泳胶切回收PCR产物, -20℃保存备用。P1:5′-CGTGGGATCCATGCAGATCTTCGTGAAG-3′(下划线酶切位点BamHⅠ); P2:5′-CGCACGCGTCTAACATTGAGATTCCCGAG-3′(下划线酶切位点MluⅠ)。
1.3 携带Ub-HBcAg基因慢病毒表达载体构建 用BamHⅠ和MluⅠ限制性内切酶双酶切慢病毒载体pWPXLd和PCR产物,酶切后琼脂糖电泳分离纯化。将酶切回收载体pWPXLd 1μL;酶切回收的Ub-HB-cAg基因片段4μL、T4DNA连接酶1μL、T4连接酶buffer 2μL,灭菌双蒸水补足至20μL,于16℃过夜连接。将连接产物转化DH 5α感受态菌株,取200μL菌液涂布LB平板(含100μg/m L氨苄青霉素),37℃倒置培养过夜,挑取单克隆抽提质粒。筛选 BamHⅠ、MluⅠ双酶切条带正确的质粒送上海生工公司,以 P1、P2引物双向测序,序列正确,慢病毒表达质粒构建成功,命名为pW-Ub-HBcAg。同时构建无泛素化的慢病毒表达质粒作为对照组,命名为pW-HBcAg。
1.4 重组慢病毒的包装 将重组质粒pW-Ub-HBcAg和两种辅助包装元件psPAX2、PMD2.G分别进行高纯度无内毒素质粒抽提,按Invitrogen公司Lipofectamine 2000使用说明将pW-Ub-HBcAg(20μg)、psPAX2(15 μg)、PMD2.G(10μg)共转染包装细胞293T细胞。获得携带目的基因Ub-HBcAg和eGFP基因的重组慢病毒。转染后8 h更换为完全培养基,收集24 h、48 h、72 h细胞上清液,2 500 r/min离心5m in,去除细胞碎屑。再用孔径为 0.45μm的细胞滤过膜过滤去除所有的细胞及碎片,将滤液浓缩得到慢病毒浓缩液,命名为LV-Ub-HBcAg,于-80℃保存备用。
1.5 病毒滴度测定 取对数生长期的293T细胞,接种于 24孔板中,每孔加 1×105个细胞。轻微振荡使细胞分布均匀,常规培养 24 h,体积 500μL。取 7个无菌 EP管,每管加 90μL含 10%胎牛血清高糖DMEM,将收集的病毒液10μL加入第一个EP管中,从第一个管中取 10μL加入到第二个管中,如此按10∶1倍比稀释至最后一管。选取所需的细胞孔,每孔吸去100μL培养基,分别加入稀释好的病毒液,24 h后每孔加入100μL新鲜完全培养液,72 h后以病毒液浓度自高到低的方向,用荧光倒置显微镜观察绿色荧光细胞的数量,初步判定病毒滴度。病毒液的滴度 = (计量管相对于第一管的稀释倍数)/第一管加入病毒的体积,荧光细胞数随稀释倍数的增加而减少,在病毒液稀释到相对于第一管 105倍时仍有荧光表达(即第6个 EP管),而在稀释 106时未见绿色荧光表达,初步判定慢病毒滴度为1×107TU/m L。
1.6 重组慢病毒在293T细胞中的表达 将 293T细胞接种于 6孔板,每孔细胞数为 1×106,培养 24 h后,换无血清的培养液。加入感染复数(MOI值)为10的重组慢病毒LV-Ub-HBcAg、LV-HBcAg,于转染后4 d荧光显微镜观察,Western blot检测目的基因在人胚肾上皮细胞系293T细胞中的表达。
1.7 小鼠髓源性DC分离及培养 BALB/c小鼠,氯胺酮麻醉致死,75%乙醇浸泡10min,无菌条件下分离股骨及胫骨,剪开两端,分别用PBS反复冲洗直至发白,向细胞悬液中加入 5 mL红细胞裂解液去除红细胞,收集于离心管中低速离心,弃上清。将收集的骨髓细胞用RPMI 1640培养液重悬后进行细胞计数,调整细胞密度为 1×106/m L,加入 6孔培养板,37℃5% CO2培养箱中培养。5 h后去除未贴壁的细胞,加入新鲜的含10%FBS的RPMI 1640培养基,同时添加重组鼠GM-CSF终浓度为20μg/L及重组鼠IL-4终浓度为10μg/L。每隔2天半量换液,并补充细胞因子GM-CSF和IL-4。倒置显微镜下观察细胞形态和数量变化。
1.8 DC的诱导 培养5 d的DC大部分悬浮生长,收集细胞,调整细胞密度为 1×106/mL,并接种于 24孔板中,将细胞分为3组,分别为LV-Ub-HBcAg组、LV-HBcAg组和LV组,取MOI值为20,每组分别加入对应病毒溶液。每组设 3个复孔,同时加入终浓度为20μg/L的GM-CSF和10μg/L的IL-4,在细胞培养箱中共培养 4 d。分别收集病毒感染后的细胞及细胞上清液,细胞上清液-20℃保存以备用于 IL-12含量的测定。
1.9 DC表面分子的检测 将上述共培养的DC细胞以 5×105个细胞收集于试管中,按照试剂说明书分别加入FITC标记的小鼠CD11c、CD86、CD80和MHC-Ⅱ类分子单克隆抗体,并设置抗鼠 IgG2a为同型对照, 4℃避光标记30 min。PBS洗涤2次后,标本以1%多聚甲醛固定30min,然后用流式细胞仪检测,设 5 000个细胞为计数门,应用Beckman公司的Expo32-ADC软件分析结果。
1.10 RT-PCR检测基因在DC中表达 使用Trizol试剂提取慢病毒感染的DC细胞总RNA。以Oligo dT为引物逆转录得cDNA第一链。以LV-Ub-HBcAg感染DC细胞逆转录合成的cDNA第一链为模板,扩增融合基因片段,同时扩增内参β-actin基因;以LV-HBcAg感染DC细胞逆转录获得的cDNA为第一链,引物扩增HBcAg基因,同时扩增内参β-actin;以空载体pcDNA 3.1(-)转染的细胞经逆转录合成的cDNA第一链为模板,相同条件PCR扩增上述两个基因作对照。
1.11 病毒感染DC的上清液中IL-12水平检测 将上述收集的 -20℃保存的病毒感染DC的各组上清液,严格按照ELISA试剂盒说明书操作,酶标仪检测IL-12的水平。
2 结果
2.1 Ub-HBcAg及HBcAg基因的PCR扩增电泳结果 以pcDNA3.1(-)-Ub-HBcAg为模板,上游引物P1中含BamHⅠ酶切位点,下游引物P2中含MluⅠ酶切位点,采用Taq DNA聚合酶,扩增Ub-HBcAg基因片段,产物片段大小约780 bp;同时以pcDNA 3.1(-)-HBcAg为模板,扩增HBcAg对照基因片段,上游引物引入BamHⅠ酶切位点,下游引物引入MluⅠ酶切位点,扩增产物片段大小约552 bp,琼脂糖凝胶电泳结果如图1所示。
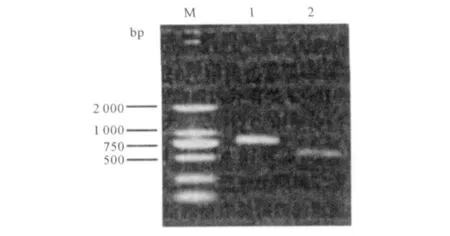
图1 Ub-HBcAg及HBcAg对照基因片段PCR扩增结果 1: Ub-HBcAg基因;2:HBcAg对照基因;M:DNA Marker 2 000Fig 1 Electrophoresis o f PCR for Ub-HBcAg and HBcAg genes 1:Ub-HBcAg gene;2:HBcAg gene;M:DNA Marker 2 000
2.2 重组慢病毒表达质粒pW-Ub-HBcAg的酶切鉴定 使用限制性内切酶BamHⅠ和MluⅠ双酶切鉴定重组质粒pW-Ub-HBcAg,质粒pW-Ub-HBcAg双酶切后释放出大小约780 bp的小片段,与预期一致(见图2)。将酶切结果正确的质粒送上海生工测序鉴定,测序结果显示Ub-HBcAg和HBcAg与Genebank中除预期突变外均相一致。
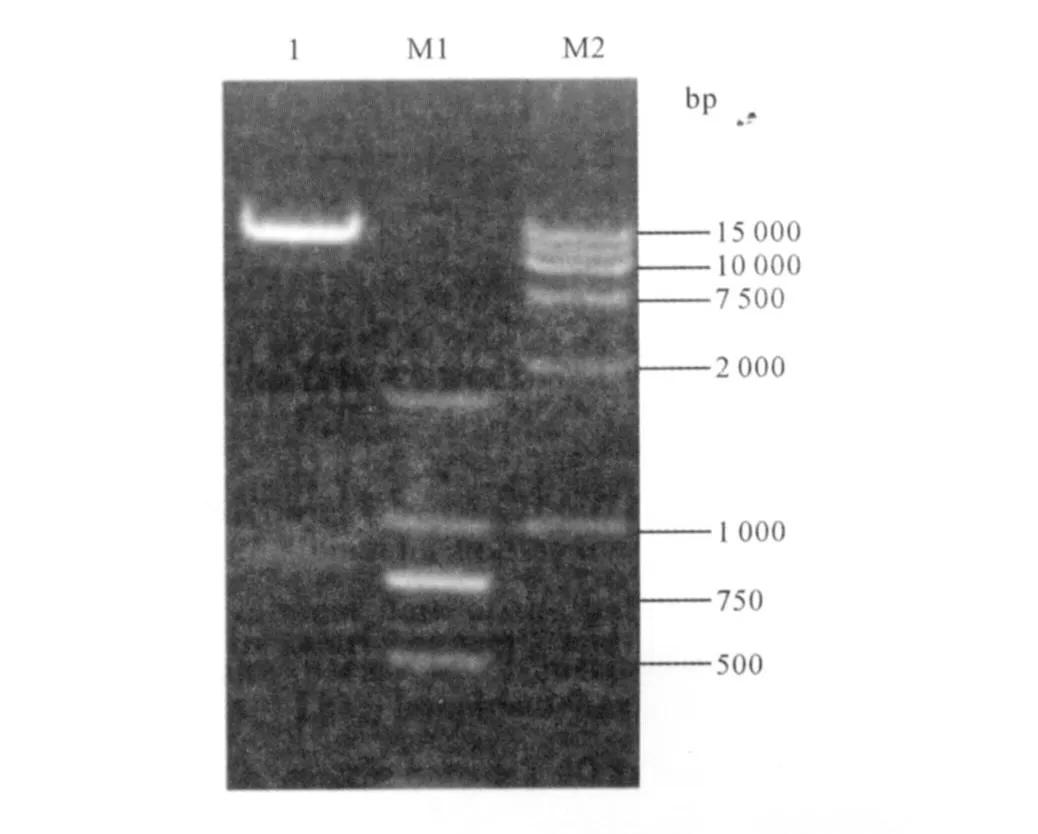
图2 重组慢病毒表达质粒pW-Ub-HBcAg的酶切电泳图 1: BamHⅠ、M luⅠ双酶切鉴定重组质粒pW-Ub-HBcAg;M 1:DNA Marker 2 000;M 2:DNA Marker 15 000Fig 2 Electrophoresis of pW-Ub-HBcAg digested by BamHⅠand M luⅠ 1:pW-Ub-HBcAg digested by BamHⅠand MluⅠ; M 1:DNA Marker 2 000;M 2:DNA Marker 15 000
2.3 GFP在293T细胞中的表达 将pW-Ub-HBcAg经脂质体转染入 293T细胞,24 h后在荧光倒置显微镜下可见到明亮的荧光蛋白表达(见图3A)。将重组慢病毒LV-Ub-HBcAg按MOI为10的比例感染293T细胞,在荧光显微镜下可以看到 GFP的表达呈阳性, 48 h后其绿色荧光的表达呈高峰 (见图3B)。
2.4 W estern blot分析重组慢病毒感染293T细胞表达目的蛋白 HBcAg由184个氨基酸组成,Ub-HBcAg融合蛋白为 260个氨基酸,其分子量理论值分别为 21 kD和29 kD。如图4所示,使用鼠抗人HBcAg单克隆抗体检测重组慢病毒LV-Ub-HBcAg及LV-HBcAg感染293T细胞后表达产物,出现特异性条带,其中LVUb-HBcAg感染293T细胞的HBcAg蛋白表达量低于LV-HBcAg感染细胞的蛋白表达量(图中1、2、3测得的灰度值分别为0、0.737、1.192)。未克隆目的基因慢病毒感染 293T细胞后表达产物呈阴性反应。
2.5 小鼠髓源性DC形态 培养第1 d(见图5A),为贴壁的单个核细胞,圆形,体积小,均匀分布;5 d后可见半悬浮的细胞集落形成,贴壁的单核巨噬细胞形态不规则,细胞体积变大,部分细胞脱壁即为树突状细胞(见图5B);加入LV-Ub-HBcAg后共培养4 d,可见集落明显增多,呈悬浮或半悬浮状态,树突状分支增加,形态更典型(见图5C)。
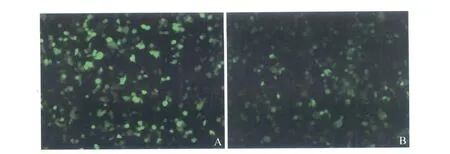
图3 重组慢病毒表达质粒pW-Ub-HBcAg转染293T细胞及重组慢病毒LV-Ub-HBcAg感染293T细胞的荧光表达情况(200×) A:重组慢病毒表达质粒pW-Ub-HBcAg转染293T细胞24h后的GFP;B:重组慢病毒LV-Ub-HBcAg感染293T细胞48h后的GFPFig 3 Fluorescence exp ression in 293T cells transfected by pW-Ub-HBcAg and LV-Ub-HBcAg(200×) A:Fluorescence expression in 293T cells transfected by recombinant lentiviral expression vector pW-Ub-HBcAg for 24 h;B:Fluorescence expression in 293T cells transfected by recombinant lentiviruses LV-Ub-HBcAg for 48 h
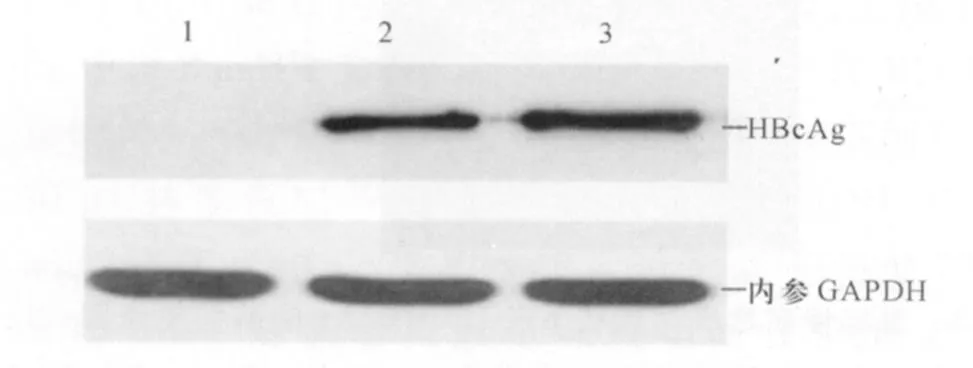
图4 重组慢病毒感染293T细胞后W estern blot检测 1:阴性对照;2:LV-Ub-HBcAg;3:LV-HBcAgFig 4 W estern b lot ana lysis of HBcAg experession in 293T cells transfected by the recombinant lentivirus 1:control; 2:LV-Ub-HBcAg;3:LV-HBcAg
2.6 DC表型检测结果 收集的各组DC细胞其表面分子CD11c均在70%~80%,LV组其DC表面分子CD86、CD80、MHC-Ⅱ表达量(见图6)明显低于LV -HBcAg组和LV-Ub-HBcAg组(P<0.01)。
2.7 RT-PCR检测Ub-HBcAg及HBcAg基因在DC中的表达 LV-Ub-HBcAg感染DC的基因组中可以扩增出约780 bp的特异性条带,与Ub-HBcAg融合基因相符;同时可以扩增出300 bp大小的内参β-actin条带。LV-Ub-HBcAg感染DC的基因组中可以扩增出特异性条带大小约552 bp,与目的基因HBcAg一致;亦扩增出内参β-actin。对照组中RT-PCR扩增出内参β-actin,未扩增出Ub-HBcAg及HBcAg基因(见图7)。说明构建的重组慢病毒感染DCs,其基因整合到小鼠DC的基因组中。
2.8 ELISA检测DC分泌IL-12的结果 培养DC中加入LV-Ub-HBcAg共培养4 d后上清中IL-12水平为(139.2±10.75)pg/mL,明显高于LV-HBcAg组分泌IL-12的量(63.6±7.37)pg/m L(P<0.01),也显著高于LV组(7.73±3.57)pg/mL(P<0.01。
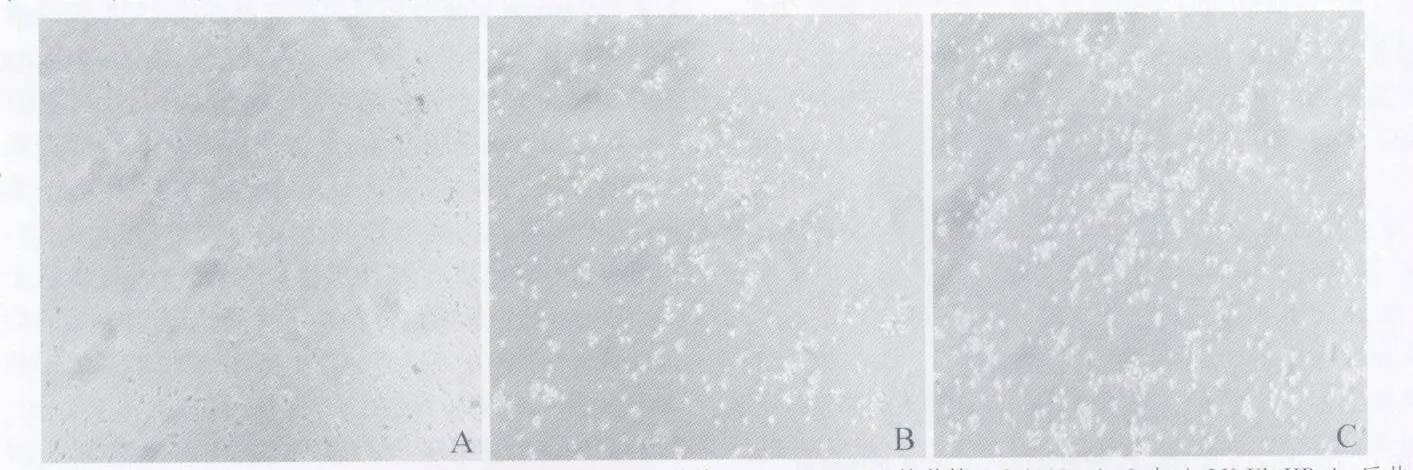
图5 体外分离纯化培养的小鼠骨髓源性树突状细胞 A:培养第1 d(100×);B:培养第5 d(100×);C:加入LV-Ub-HBcAg后共培养4 d(100×)Fig 5 DCsw ere isolated,purified and cultured in vitro
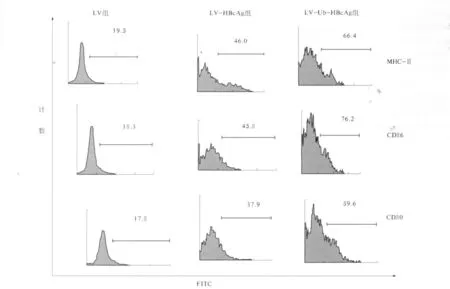
图6 流式细胞仪对树突状细胞表面共同刺激分子的检测(MHC-Ⅱ、CD 80、CD 86)Fig 6 Percentage of DCs surfacemolecules(CD 86,CD 80,MHC-Ⅱ)were detected by flow cytom eter
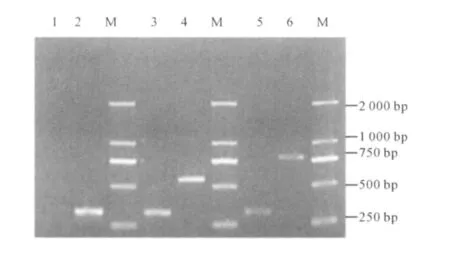
图7 慢病毒感染DC后基因组内基因检测结果 M:DNA Marker 2 000;1:LV感染DC后RT-PCR结果;2,3,5:扩增的内参基因β-actin;4:LV-HBcAg感染DC后RT-PCR扩增HBcAg结果;6:LV-Ub-HBcAg感染DC后RT-PCR扩增Ub-HBcAg结果Fig 7 The resu lt of Ub-HBcAg gene for genome in DC transduced w ith LV-Ub-HBcAg M:DNA Marker 2 000;1:DCs transduced with LV;2,3,5:β-actin;4:DC transduced with LVHBcAg;6:DC transduced with LV-Ub-HBcAg
3 讨论
泛素是真核细胞中普遍存在的且高度保守的小分子多肽,其分子量约8.5 kDa,由76个氨基酸残基组成。抗原的泛素化是 MHC-Ⅰ类分子提呈所必需的环节。已有研究表明泛素与抗原结合的基因治疗在诱导细胞免疫应答方面呈现出良好的应用前景[9-12]。
本实验构建和包装携带强制泛素化HBcAg表达基因的慢病毒,旨在通过慢病毒为载体使HBcAg在抗原提呈细胞内能更有效地被泛素-蛋白酶体系统降解,并通过MHC-Ⅰ类分子提呈途径提呈,诱导HBV特异性CTL。为了确保泛素化的抗原蛋白能够以稳定的结构进入蛋白酶体系统降解,本实验前期扩增泛素基因片段时将其羧基端第 76位氨基酸由甘氨酸突变为丙氨酸,同时为了增加抗原蛋白的不稳定性,根据 N端法则将HBcAg基因片段N末端第一位氨基酸由稳定的蛋氨酸残基突变为精氨酸[13],将抗原强制泛素化的目的在于使其不易被去泛素化酶的作用,使抗原迅速降解。
慢病毒载体的高效性和安全性,使其成为近年来基因转移载体的上佳选择[14,15]。本研究中慢病毒载体采用三质粒系统进行构建,包括骨架质粒、包装质粒和包膜质粒。骨架质粒中含有包装、逆转录及整合所需的顺式序列,保留多克隆位点,在目的基因克隆过程中,我们注意到引用两个酶切位点比较容易克隆成功,我们选择了常见的BamHⅠ和MluⅠ位点插入目的基因Ub-HBcAg。本课题构建的慢病毒表达载体本身携带有GFP报告基因,这有利于检测慢病毒的包装过程中质粒转染效率,也有利于后续实验中观察病毒的转染效率。Western blot结果显示LV-Ub-HBcAg感染293T细胞的HBcAg蛋白表达量低于LV-HbcAg感染细胞的蛋白表达量,考虑是由于将HBcAg强制泛素化使融合蛋白通过泛素-蛋白酶体系统发生降解所致,与实验预期相符。
DC是体内专职抗原递呈细胞,有实验证实[16-18],负载抗原的DC能有效诱导抗原特异性的CTL反应。成熟的DC具有很强的抗原递呈能力,能高表达共同刺激分子。DC成熟的一个重要标志是 IL-12的分泌, IL-12是促进 T淋巴细胞活化增殖的重要细胞因子之一,在介导细胞免疫方面可使Th0细胞分化为Th1细胞,并能促进 Th1细胞的增殖。本实验通过体外培养树突状细胞,通过重组慢病毒来诱导其成熟。流式细胞仪对DC表面分子的检测显示,LV-Ub-HBcAg能明显上调细胞表面标志物水平,收集DC上清检测IL-12水平,LV-Ub-HBcAg组的水平明显高于LV-HBcAg组,说明重组慢病毒具有促进DC成熟能力。
本实验成功构建了含有Ub-HBcAg基因的重组慢病毒。通过感染DCs能明显提高细胞表面分子,并促进IL-12的分泌,加强了细胞免疫并促进DCs的成熟,为下一步研究重组慢病毒在体内外实验中诱导 HBV特异性CTL免疫应答提供良好实验基础。
[1] Webster GJ,Bertoletti A.Control or persistence of hepatitis B virus: The critical role of initial host-virus interactions[J].Immunol Cell Biol,2002,80(1):101-105.
[2] Seeger C,MasonWS.Hepatitis B virus biology[J].Microbiol Mol Biol Rev,2000,64(1):51-68.
[3] Jung MC,Pape GR.Immunologyofhepatitis B infection[J].Lancet Infect Dis,2002,2(1):43-49.
[4] Bertoletti A,Ferrari C.Kineticsof the immune response during HBV and HCV infection[J].Hepatology,2003,38(1):4-13.
[5] Duan XZ,Wang M,Li HW,et al.Decreased frequency and function of circulating plasmocytoid dendritic cells(pDC)in hepatitis B virus infected humans[J].JClin Immunol,2004,24(6):637-646.
[6] Seifert U,Kruger E.Remodelling of the ubiquitin-proteasome system in response to interferons[J].Biochem Soc Trans,2008,36(5): 879-884.
[7] Van Der Molen RG,Sprengers D,Binda RS,et al.Functional impairment ofmyeloid and plasmacytoid dendritic cells of patients with chronic hepatitis B[J].Hepatology,2004,40(3):738-746.
[8] Shen N,Yu YS,Zang GQ,et al.Construction of eukaryotic expression plasm id encodingubiquitinated hepatitis B virus core protein[J].China Journal of Modern Medicine,2010,20(6):699-701,705.沈楠,余永胜,臧国庆,等.强制泛素化乙肝病毒核心抗原融合基因表达质粒的构建[J].中国现代医学杂志,2010,20(6): 699-701,705.
[9] Wang QM,Kang L,Wang XH,et al.Improved cellular immune response elicited by a ubiquitin-fused ESAT-6DNA vaccine against Mycobacterium tuberculosis[J].Microbiol Immunol,2009,53(7): 384-390.
[10] Brandsma JL,Shlyankevich M,Zelterman D,et al.Therapeutic vaccination of rabbits with a ubiquitin-fused papilloma virus E1, E2,E 6and E7DNA vaccine[J].Vaccine,2007,25(33):6158-6163.
[11] Sharma A,Madhubala R.Ubiquitin Conjugation of Open reading frame F DNA vaccine leads to enhanced cell-mediated immune response and induces protection against both antimony-susceptible and-resistantstrainsof leishmania donovani[J].J Immunol,2009, 183(12):7719-7731.
[12] Tellam J,Connolly G,Webb N,etal.Proteasomal targeting of a viral oncogene abrogates oncogenic phenotype and enhances immunogenicity[J].Blood,2003,102(13):4535-4540.
[13] Mogk A,Schmidt R,Bukau B,et al.The N-end rule pathway for regulated proteolysis:prokaryotic and eukaryotic strategies[J]. Trends Cell Biol,2007,17(4):165-172.
[14] Naldini L,BlomerU,Gallay P,etal.In vivogene deliveryand stable transduction of nondividing cellsby a lentiviral vector[J].Science,1999,272(5259):263-267.
[15] Yu ZY,McKay K,Van AP,etal.Lentivirusvector-mediated gene transfer to the developing bronehiolar airway epithelium in the fetal lamb[J].JOene Med,2007,9(6):429-439.
[16] Dyall J,Latouche JB,Schnell S,et al.Lentivirus-transduced human monocyte-derived dendritic cells efficiently stimulate antigenspecific cytotoxic T lymphocytes[J].Blood,2001,97(1): 114-121.
[17] Negri DR,BonaR,MicheliniZ,etal.Transduction ofhuman antigenpresenting cells with integrase-defective lentiviral vector enables functional expansion ofprimed antigen-specific CD8(+)T cells[J].Hum Gene Ther,2010,21(8):1029-1035.
[18] Jirmo AC,Koya RC,Sundarasetty BS,et al.Monocytes transduced with lentiviralvectorsexpressinghepatitis C virusnon-structural proteinsand differentiated into dendritic cells stimulate multi-antigenic CD8(+)T cell responses[J].Vaccine,2010,28(4):922-933.
