PD-1在胃癌患者CD8+T细胞表面的表达特点及临床意义
2011-03-09李超,汪宏,周勇
李 超,汪 宏,周 勇
安徽医科大学第三附属医院微创外科,安徽合肥 230061
胃癌在全世界很多国家发病率都很高;据估计,世界范围内最常见的恶性肿瘤中胃癌排名第四位[1]。2009年,美国胃癌的新发病率估计超过 21 130例[2]。椐最新统计(2002~2004年数据),中国的大城市如上海,胃癌的死亡率男性约为 52.24/10万人,仍居恶性肿瘤发病第二位,女性为 29.26/10万人,居恶性肿瘤第三位[3]。在胃的恶性肿瘤中,发病部位仍以胃窦部为主,腺癌占 95%。胃癌的发生发展主要与环境因素、遗传因素、免疫因素等有关。胃癌经常到晚期才得到诊断,这是因为世界上大多说国家没有开展胃癌的筛查。PD-1的表达与胃癌的发生发展的关系并不清楚,本研究目的在于通过检测胃癌患者及其不同病变程度的外周血CD8+T细胞PD-1的表达的水平与健康体检者之间的差异,探讨PD-1的表达与胃癌的发生发展的关系,为临床上胃癌的早期诊治提供理论依据。
1 材料与方法
1.1 病例收集 收集 2009年3月 ~2010年5月本院胃癌患者66例,男 48例,女 18例;平均年龄(61.0± 8.6)岁,诊断标准符合《胃癌临床实践指南》2010中国版,所有胃癌患者均排除转移性胃癌,且均经术后病理证实,典型的 HE组织染色如图1所示,临床病例分期根据美国癌症联合委员会(AJCC)胃癌TNM分期标准(2010年第七版),Ⅰ期 8例、Ⅱ期 12例、Ⅲ期 36例、Ⅳ期 10例,术前均未行化疗;对照组为健康体检者 34例,男25例,女9例;平均年龄(61.6±8.8)岁。所有入组患者及对照组均签署知情同意书,并且通过单位伦理委员会认可。
图1 胃癌的组织学典型图(HE 400×)Fig 1 The rep resentative imm unohistochem istry resu lt o f gastric cancer(HE 400×)
1.2 主要试剂和仪器 PE标记小鼠抗人PD-1单克隆抗体及同型对照抗体IgG1、PerCP标记的小鼠抗人CD8单克隆抗体购自美国B&D公司;流式细胞仪EPICS XL-MCL购自美国Beckman-coulter公司, PBS由本实验室配制,微量移液器购自Microtec公司。
1.3 PBMCs分离 取肝素钠抗凝的新鲜静脉血10 m L,PBS等量稀释,缓慢加入10 mL淋巴细胞分层液中,2 500 r/min室温离心20m in,小心取出离心管,吸取单个核细胞层,使用PBS洗涤3次后重悬,2 000 r/ min室温离心15 min,弃上清,使用PBS重悬后,再次1 500 r/min室温离心10min,最后所得沉淀悬于缓冲液中计数单个核细胞。
1.4 CD8+T细胞分选 CD8+T细胞的分选采用Miltenyi Biotech公司(Auburn,CA)CD8+阳性分选磁珠进行分选,分选过程严格按照产品说明书进行。
1.5 FCM分析CD8+T细胞PD-1的表达 准备两个试管,取新鲜外周血全血 200μL,每一个试管加入100μL。一支试管加入CD8-PerCp 20μL,PD-1-PE 20 μL;另一支试管加入CD8-PerCp 20μL,IgG1-PE 20 μL,4℃避光孵育30min。加入10倍稀释后红细胞裂解液1 mL裂解红细胞,室温静置5 min,加入1 mL PBS洗涤,振荡后离心1 500 r/min,弃上清,加入1%多聚甲醛固定,立即上流式细胞仪检测,用Flow Jo软件分析流式数据。
1.6 统计学处理 采用SPSS 13.0进行统计分析, Origin 7.5作统计图,数据用±s表示,两组计量资料均数比较用两独立样本非参数检验,P<0.05表示差异有统计学意义。
2 结果
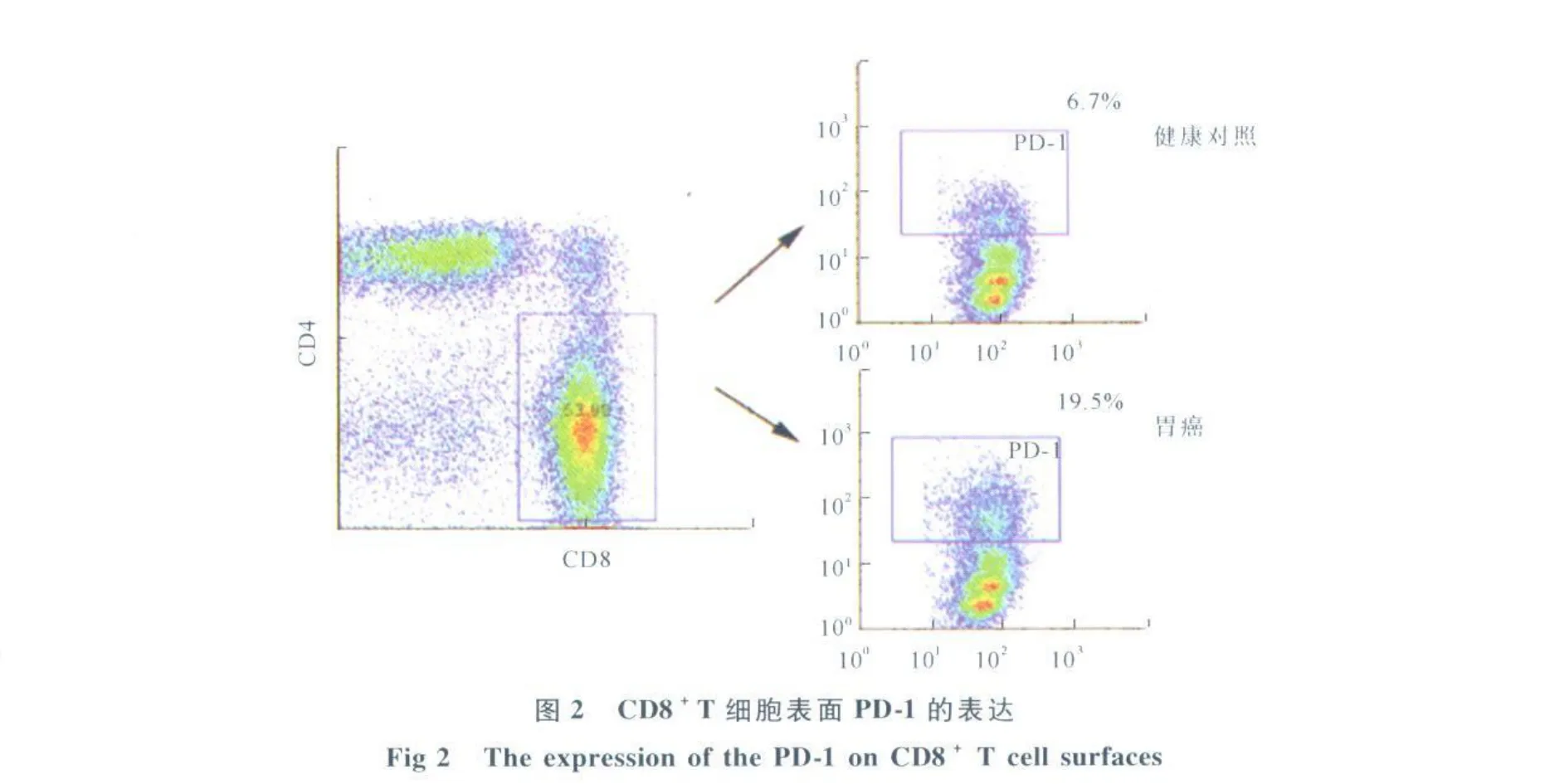
2.1 外周血CD8+T细胞表面PD-1的表达 胃癌患者PD-1在外周血CD8+T细胞表面的阳性表达水平明显高于健康对照,差异有统计学意义(见图 2)。
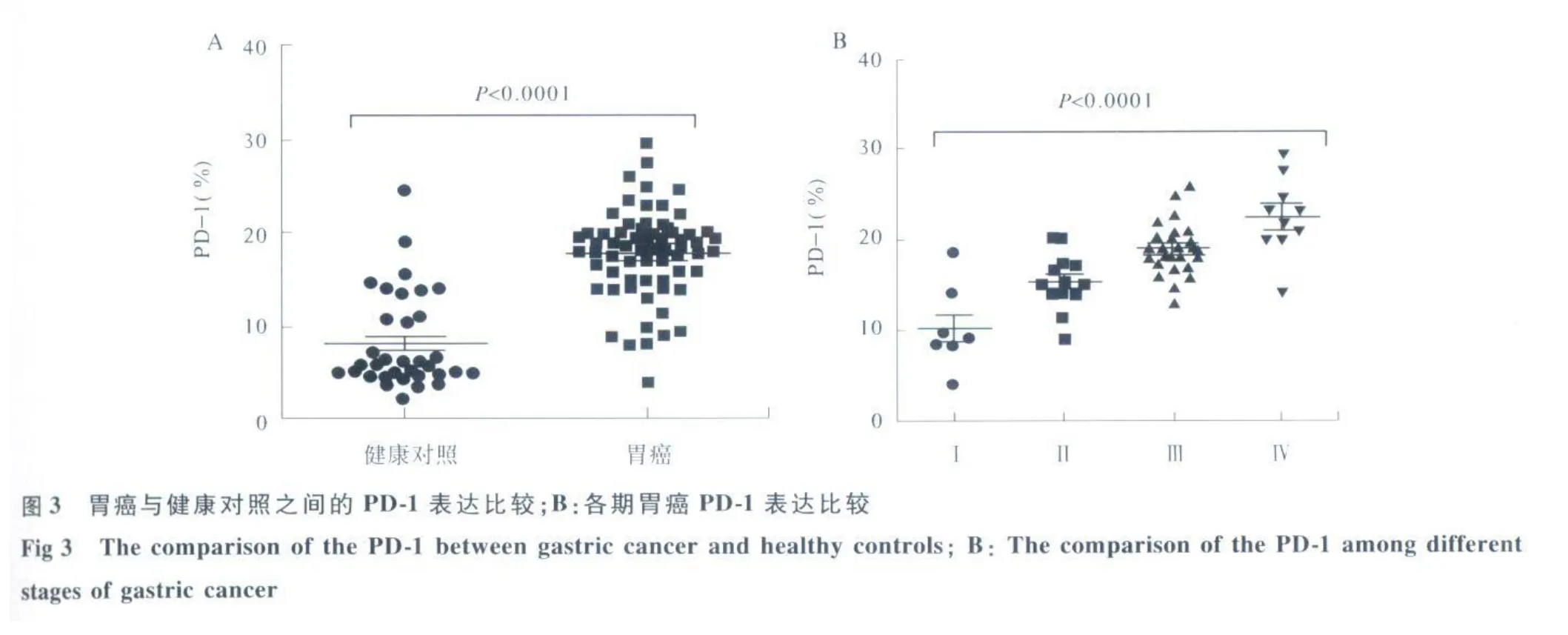
2.2 流式细胞仪分析胃癌患者及健康对照外周血CD8+T细胞表面PD-1的表达 对66例胃癌患者及34例健康对照外周血进行流式细胞仪分析,结果显示胃癌患者外周血CD8+T细胞表面PD-1阳性表达明显高于健康对照,差异有统计学意义(17.81%±4.74% vs8.22%±5.17%,P<0.0 001,见图3A)。
2.3 不同类型胃癌患者外周血 CD8+T细胞表面PD-1的表达的检测结果 在不同分期胃癌患者外周血CD8+T细胞表面PD-1表达不同,且与胃癌的不同分期呈正相关,差异有统计学意义(见图3B)。
3 讨论
在肿瘤免疫应答中,肿瘤抗原特异性T细胞的诱导凋亡和无反应性是肿瘤细胞免疫逃逸中的主要机制,而PD-1/PD-L1信号正是许多肿瘤细胞实现免疫逃逸的重要途径[4]。
PD-1又称CD 279,是具有单一胞外IgV样功能区的Ⅰ型穿膜蛋白,分子量约为 50~55 kD,有 288个氨基酸残基构成,属免疫球蛋白超家族成员。PD-1是近年来发现的负性共刺激信号之一,最初在凋亡的 T细胞杂交瘤中利用消减杂交的方法而得到,是在淋巴细胞活化过程中被诱导表达的一个免疫抑制性受体,其高度表达与T细胞免疫缺陷密切相关。T细胞表面的PD-1与其配体(PD-L1)结合后相互作用,可抑制肿瘤抗原特异性T细胞的活化,诱导并维持 T细胞对肿瘤细胞免疫耐受,从而导致肿瘤逃避免疫监视[5-7]。PD-1在静息的 T细胞表面无表达,但在 T细胞活化之后可以表达。T细胞表面的PD-1与其配体(PD-L1)结合后相互作用,可抑制肿瘤抗原特异性 T细胞的活化,诱导并维持 T细胞对肿瘤细胞免疫耐受,从而导致肿瘤逃避免疫监视[8]。综上所述,PD-1的高度表达与 T细胞免疫缺陷密切相关。在抗肿瘤免疫中,通常遵循肿瘤特异性T细胞活化、T细胞增殖、肿瘤浸润和T细胞记忆应答加强的步骤。研究表明[9],在肿瘤细胞及肿瘤微环境中均可通过PD-1/PD-L1信号通路抑制肿瘤抗原特异性T细胞的活化,下调 T细胞介导的肿瘤免疫应答;因此,阻断PD-1/PD-L1信号途径已成为抗肿瘤免疫的一个重要手段,它可通过激活 T细胞起到连接主动免疫和被动免疫的桥梁作用。
在许多人类肿瘤组织中均可检测到 PD-1蛋白的表达[10]。Nakanishi等[11]应用FCM法分析泌尿系统肿瘤手术标本中肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TIL)上的PD-1分子的表达,结果显示CD4+和CD8+TIL细胞上均高表达PD-1,而且PD-1的表达水平与CD4+/CD8+比值呈负相关。Hamanishi等[12]在卵巢癌中发现肿瘤细胞 PD-1的表达水平和CD8+T的浸润程度与患者预后呈负相关。Konishi等[13]则检测到 PD-1在非小细胞肺癌组织T淋巴细胞中高表达。Shi等[14]发现 PD-1在瘤体内及其周边的表达显著增高,并促进与肝癌细胞接触的CD8+T细胞的凋亡,从而参与肿瘤对 T细胞反应的调节作用。有研究表明[15],PD-1抑制抗肿瘤免疫是在CD8+T细胞效应相。多项研究均表明,肿瘤特异性 T细胞高表达PD-1。究其原因,推测与肿瘤环境内大量的肿瘤抗原对 T细胞的持续刺激有关。另一项研究证明,包括有γ链细胞因子,如IL-2、IL-7、IL-15、IL-21,也均可以上调PD-1在T细胞上的表达水平[16]。Shi等[14]同时也发现PD-1在肝癌患者外周血中有较高表达,这与对应组织中的表达相一致。PD-1的高表达也可能与胃癌的发生发展及其预后有关。本研究首先通过运用流式细胞仪检测胃癌外周血CD8+T细胞表面PD-1表达,推测PD-1在胃癌组织中的表达情况;结果显示胃癌患者外周血CD8+T细胞表面PD-1的表达,较正常人明显上调,且与胃癌的不同分期呈正相关;这暗示 PD-1在胃癌组织中也有较高表达,PD-1/PD-L1信号通路同样参与胃癌的发生发展。胃癌患者T细胞表面 PD-1的上调机制可能是T细胞抗原受体(TCR,T cell antigen receptor)被肿瘤相关抗原激活或受共同γ链细胞因子的刺激。胃癌CD8+T淋巴细胞中高表达的PD-1,与其配体PD-L1相互作用后,抑制了肿瘤抗原特异性T淋巴细胞的增殖和活化,使 T淋巴细胞处于无能状态,诱导并维持 T淋巴细胞对胃癌细胞免疫耐受,从而使胃癌细胞有效逃避机体的免疫监控和杀伤,使胃癌细胞增殖得不到有效控制,导致胃癌的进一步增长,甚至发生转移。通过对外周血CD8+T细胞表面PD-1表达分析,发现胃癌患者外周血CD8+T细胞表面PD-1的表达明显高于健康体检者;进一步我们分析了胃癌患者外周血CD 8+T细胞表面PD-1的表达,发现PD-1在CD8+T细胞表面的表达水平随着胃癌恶化而升高,说明 PD-1可以间接地反映胃癌的病变程度。究竟外周血中CD8+T细胞表面表达的PD-1能否用于胃癌患者的诊治,甚至是预后的判断,我们的试验结果初步表明,在一定程度上使用外周血检测CD8+T细胞表面PD-1分子的表达水平,可以代替瘤内的结果—这样的检测方法不仅简便,而且更加安全。但由于取材及试验方法的局限,PD-1/PD-L1信号途径介导胃癌细胞免疫的机制仍需进一步研究。
[1]Kamangar F,DoresGM,Anderson WF.Patterns of cancer incidence, mortality,and prevalence across fivecontinents:defining priorities to reduce cancer disparities in different geographic regions of the world[J]. JClin Oncol,2006,24(14):2137-2150.
[2]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer JClin,2009,59(4):225-249.
[3]Wu CX,Zheng Y,Bao PP.Pattern of changing incidence of gastric cancer and its time trend in shanghai[J].JSur Concepts Prat,2008, 13(1):24-29.
[4]Okazaki T,Honjo T.The PD-1-PD-L pathway in immunological tolerance[J].Trends Immunol,2006,27(4):195-201.
[5]Carter L,Fouser LA,Jussif J,et al.PD-1,PD-L inhibitory pathyway affects both CD4+and CD 8+T cell and itsovercome by IL-2[J].Eur JImmunol,2002,32(3):634-643.
[6]Dong H,Chen L.B7-H 1 path way and its role in the evasion of tumor immunity[J].JMol Mal,2003,81(5):281-287.
[7]Keir M E,Buttem J,Freeman G J,etal.PD-1and its ligands in tolerance and immunity[J].Annu Rev Immunol,2008,26:677-704.
[8]Keir ME,Buttem J,Freeman J,et al.PD-1 and its ligands in tolerance and immunity[J].Annu Rev Immunol,2008,26:677-704.
[9]Blank C,Kuball J,Voelkl S,etal.Blockade ofPD-L1(B7-H 1)augments human tumor-specific T cell responses in vitro[J].Int JCancer,2006,119(2):317-327.
[10]Brown JA,Dorfman DM,Ma FR,et al.Blockade of programmed death-1 ligand on dendritic cellsenhances T cell activation and cytokine production[J].J Immunol,2003,170(3):1257-1266.
[11]Nakanishi J,Wada Y,Matsumoto K,etal.Overexpression of B 7-H 1 (PD-L1)significantly associates with tumor grade and postoperative prognosis in human urothelial cancers[J].Cancer Immunol Immunother,2007,56(8):1173-1182.
[12]Hamanishi J,Mandai M,Iwasaki M,et al.programmed cell death 1 ligand 1 and tumor-infiltrating CD 8+T lymphocytesare prognostic factorsof human ovarian cancer[J].Proc Natl Aca Sci U S A,2007, 104(9):3360-3365.
[13]Konishi J,Yamazaki K,Azuma M,et al.B 7-H 1 expression on nonsmall cell lung cancer cells and its relationship with tumor-infiltrating lymphocytes and their PD-1 expression[J].Clin Cancer Res,2004, 10(15):5094-5100.
[14]Shi F,ShiM,Zeng Z,etal.PD-1 and PD-L1upregulation promotes CD 8+T-cell apoptosis and postoperative recurrence in hepatocellular carcinoma patients[J].Int JCancer,2010,128(4):877-896.
[15]Iwai Y,Terawaki S,Honjo T.PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells[J].Int Immunol,2005,17(2):133-44.
[16]Kinter AL,Godbout EJ,McNally JP,et al.The common gammachain cytokines IL-2,IL-7,IL-15,and IL-21 induce the expression of programmed death-1 and its ligands[J].J Immunol,2008,181 (10):6738-6746.
