Ⅳ型胶原酶门脉灌注对兔肝硬化组织中 α-平滑肌动蛋白的影响
2011-03-09于晓红邱慧彬付山峰
于晓红,金 博,邱慧彬,付山峰,路 平
1.军医进修学院,北京 100853;2.海军总医院消化内科;3.海军总医院病理科
肝硬化是各种慢性肝病长期发展的终末期,严重威胁患者的生命[1]。我们在前期实验中发现门脉灌注Ⅳ型胶原酶可减轻硬化肝脏的纤维化程度[2],推测可能是由于胶原酶可直接降解细胞外基质,减轻纤维化。但这种方法对于HSCs激活是否存在影响目前尚不清楚。本实验观察门脉灌注Ⅳ型胶原酶对 α-SMA表达的影响,初步探讨Ⅳ型胶原酶对 HSCs激活的影响。
1 材料与方法
1.1 肝硬化动物模型制备 选择月龄为 3个月雄性新西兰大白兔[由北京科宇动物养殖中心提供,实验动物许可证号:SCXK(京)-2006-0015],体质量1.54~2.23 kg。取CCl4和橄榄油(均购自北京化学试剂公司),按体积比为 1∶1配制,充分摇匀,制备成浓度为50%CCl4备用。根据预实验结果实验组于臀部皮下注射50%CCl4(0.23mL/kg),每周2次,8周后根据兔饮食、体质量及精神状态,调整为每周 1~2次。对照组单纯应用橄榄油(0.23 mL/kg),皮下注射方法同实验组。12周末取动物观察肝脏的外观、体积、质地等变化,并取材做组织病理学检查。10%中性甲醛溶液固定48 h,石蜡包埋,切片后行苏木精-伊红(HE)染色及Masson染色,光学显微镜下观察肝脏组织的病理学改变。
1.2 门静脉插管手术 各组动物经氯胺酮及速眠新Ⅱ等比混合液肌肉注射(0.5 mL/kg)麻醉成功后,常规脱毛、消毒并铺洞巾,取上腹部正中切口打开腹腔,暴露肝脏,以缝扎方法切取部分右肝组织,10%中性甲醛固定用于病理组织学检查。暴露空肠肠系膜静脉,分离其终末支,剪一小口并结扎远心端,将一次性硬膜外麻醉导管(BD Epidural Catheter)沿该切口向近心端插入3~4 cm后结扎固定。确认该导管位于血管内之后,保留适当长度(约12~15 cm)剪断导管,断端以硬膜外导管接头(BD Epidural Catheter)连接肝素帽,操作过程中导管、接头及肝素帽内均注满125 U/m L肝素。置管成功后关闭腹腔,肝素帽埋于动物右侧腹壁皮下。术后肌注5%头孢曲松钠2mL,连续5 d预防术后感染,并每日行肝素封管。
1.3 门静脉灌注给药 手术1周后,根据病理组织学检查结果,将已形成肝硬化并门静脉插管成功的 33只兔随机分为两组(组1,组2),组1有 16只、组2有17只,组 1通过经皮穿刺右侧腹壁皮下肝素帽,向导管内注射0.1%异丙嗪2mL预防过敏反应,继而注入0.1%Ⅳ型胶原酶1.5 mL,最后用125U/mL肝素5 mL封管。每天给药1次,每周连续给药5d后停药2 d,连续4周。组2以0.9%NaCl替代胶原酶,其余处理方法同组1。将造模对照组中门静脉插管成功的 30只兔同样随机分为两组(组 3,组 4),每组 15只。组 3注药方法同组 1,组 4注药方法同组 2。为防止停止造模给药后兔肝硬化有一定自然恢复趋势的缺点,在门静脉灌注给药过程中肝硬化组继续应用皮下注射用橄榄油稀释的50%CCl40.1m L/kg体质量,2次/周。
1.4 免疫组化检测 给药完成后采取耳缘静脉空气栓塞法处死各组动物,留取右肝相同部位标本,10%中性甲醛溶液固定48 h,石蜡包埋,切片后行α-SMA免疫组织化学染色。按SV-0001两步法免疫组化试验盒(购于武汉博士德公司)说明书操作,石蜡切片常规脱蜡至水,过氧化氢封闭,抗原修复,血清封闭,滴加小鼠抗兔α-SMA单克隆抗体(1∶100稀释,购于武汉博士德公司),滴加用过氧化物酶标记的山羊抗小鼠 IgG, DAB显色。PBS代替一抗作为空白对照。普通光学显微镜下观察到肌成纤维细胞胞浆内棕黄色颗粒为α-SMA阳性表达产物。采用CMIAS系列多功能真彩色病理图像分析系统体视学分析模块行积分光密度、面密度分析。每张切片选取5个视野(200×)进行图像分析,取其平均积分光密度(面密度)值。
2 结果
2.1 肝硬化动物模型制备情况 造模动物随着注药时间延长活动逐渐减少,毛发蓬乱无光泽,食欲不振,精神萎糜,体质量增长缓慢。12周末时组织病理学检查发现肝脏正常的肝小叶结构消失,有大量纤维间隔出现,并包绕肝细胞团,形成大小不等的假小叶;假小叶中肝细胞大小不等,排列不规则,正常的肝细胞板和肝血窦结构消失,呈显著的肝硬化的组织病理特点(见图1),Masson三色染色提示纤维间隔主要由胶原纤维构成(见图2)。
2.2 门静脉插管及注药情况 门静脉插管术及注药后,各组动物多无明显异常反应,部分动物出现手术切口裂开或感染,可经局部清创消毒重缝及换药后愈合。少数动物因腹腔感染、导管脱出或断裂致腹腔广泛出血死亡。注药结束时,各组动物存活数为:组1:12只;组2:14只;组3:12只;组4:13只。
2.3 免疫组化检测(见表1) 正常肝脏组织中α-SMA主要表达于血管平滑肌,其他部位几乎无阳性表达(见图3)。肝硬化动物肝组织中α-SMA阳性表达细胞数明显增多,胞浆呈棕黄色,主要分布于门静脉、汇管区、纤维间隔和邻近的肝窦,呈片状或条梭状分布(见图4)。门静脉插管注入0.1%Ⅳ型胶原酶处理后α-SMA表达较0.9%NaCl灌注组明显增强(见图5)。
表1 各组肝组织中α-SM A表达情况(±s)Tab 1 Exp ression o fα-SMA in liver tissue in each group

表1 各组肝组织中α-SM A表达情况(±s)Tab 1 Exp ression o fα-SMA in liver tissue in each group
与组1比较,*P<0.05,#P<0.01;与组2比较:△P<0.01
例数 积分光密度 面密度组1 12 8.460±4.238 0.152±0.089组2 14 4.090±2.506* 0.068±0.042*组3 12 0.793±0.34△# 0.016±0.063△#组4 13 0.770±0.412△# 0.016±0.048△#
3 讨论
肝硬化是一种常见的慢性肝病,可由一种或多种原因引起肝脏损害,肝脏呈进行性、弥漫性、纤维性病变[3]。目前在临床上,仍缺乏针对肝硬化的有效治疗手段。建立合适的肝硬化动物模型,是进行实验研究的基础[4]。
本实验采用兔进行造模。在实验中采用单纯皮下注射的方法,简便安全,造模 12周后,组织病理学检查发现肝脏正常肝小叶结构消失,有大量纤维间隔包绕肝细胞团,形成大小不等的假小叶结构,证明已形成肝硬化。
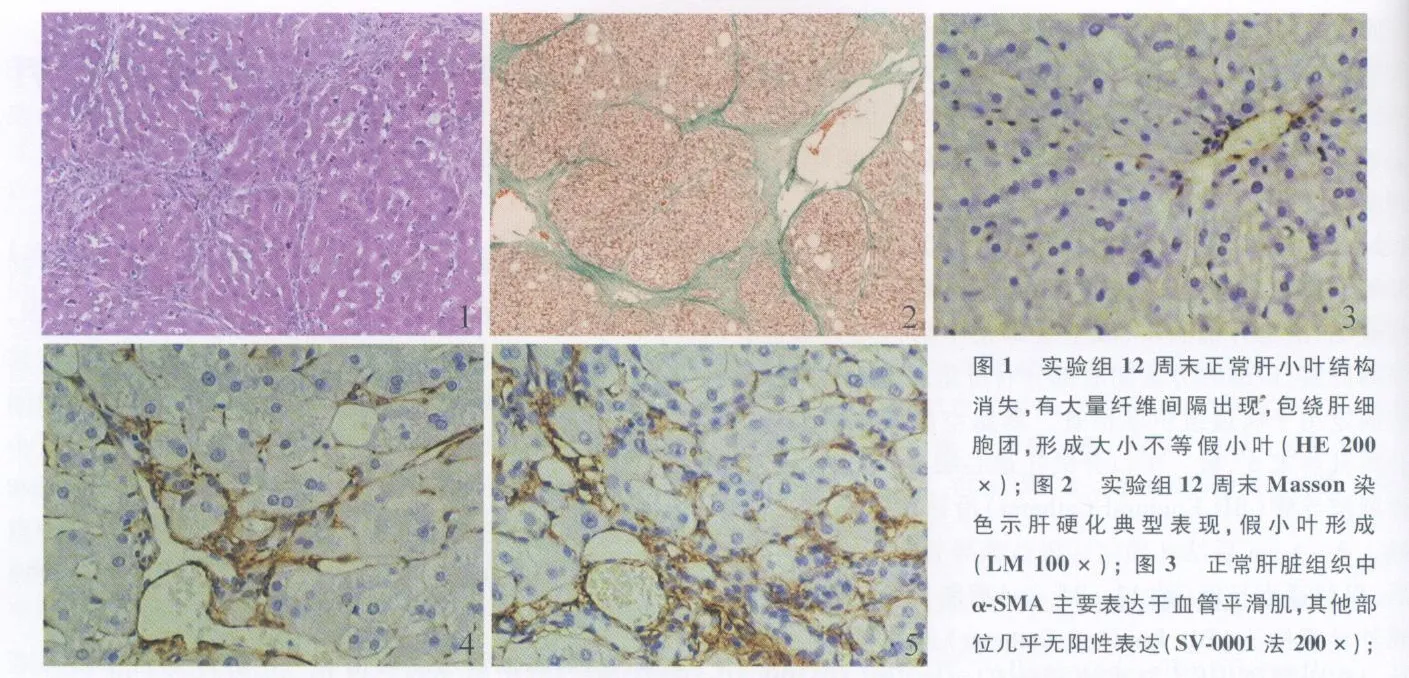
图 4 肝硬化兔肝组织中 α-SMA阳性表达细胞数明显增多,主要分布于门静脉、汇管区、纤维间隔和邻近的肝窦,胞浆呈棕黄色,呈片状或条梭状分布(SV-0001法 200×);图5 Ⅳ型胶原酶处理后兔肝硬化肝组织α-SMA表达较肝硬化对照组明显增强(SV-0001法200×)Fig 1 In testgroup,the normal anatomy of lobulihepatis disappeared at the end of 12weeks.Therewere lots of fibrous septum divided the liver tissue into pseudolobules with different size;Fig 2 In testgroup,therewas typicalappearance of liver cirrhosis with pseudolobu les formed at the end of 12weeks;Fig 3 In normal liver tissue,α-SMA primarily expressed in vascular smoothmuscle.There wasalmostno positive expression in other tissues;Fig 4 Thenumberof positive expression ofα-SMA increased obviously,most of those cells distributed in portal vein,portal area,fibrous septum and ad jacent sinus hepaticus.The endochylema of those cellswere stained with claybank and represented as schistic or fusiform;Fig 5 The expression ofα-SMA in liver cirrhosis tissue increased obviously afterⅣcollagenase treatment
HSCs活化是肝纤维化发生、发展的中心环节,α-SMA是HSCs激活的标志,其表达强度的变化与肝纤维化程度相关[5]。本实验结果显示,正常肝脏组织中α-SMA主要表达于血管平滑肌,其他部位几乎无阳性表达,而在肝硬化动物肝组织中α-SMA阳性表达细胞数明显增多,胞浆呈棕黄色,主要分布于门静脉、汇管区、纤维间隔和邻近的肝窦,呈片状或条梭状分布。证明在肝硬化过程中,HSCs大量被激活,α-SMA表达增强,肝纤维化程度加重。
胶原酶在临床上已应用多年,主要用于治疗胶原组织损害。有个别研究表明,胶原酶可以局部或全身应用,在安全剂量下未发现明显损害[6]。我们在前期动物实验中发现,小剂量的Ⅳ型胶原酶经门静脉灌注治疗肝硬化,可显著减少肝内胶原积聚,延迟甚至逆转肝纤维化的发展,且对其他重要器官未产生不良影响[2]。我们在本实验中应用门脉灌注的方法,将小剂量Ⅳ型胶原酶直接作用于硬化肝脏,结果表明,肝内纤维化程度明显减轻,但α-SMA表达显著增强,证明此方法在一定程度上减轻或逆转肝硬化,但可能引起HSCs激活的增加。其原因可能是Ⅳ型胶原酶直接水解胶原,破坏肝硬化过程中形成的纤维间隔,胶原量减少后反馈性增加HSCs的激活,形成更多的肌成纤维细胞,增加细胞外胶原基质的分泌。因此,在应用门脉灌注Ⅳ型胶原酶治疗肝硬化的实验中,应注意联合应用抑制HSCs激活的措施,从而提高治疗效果。
[1]Durand F,Valla D.Assessment of prognosis of cirrhosis[J].Semin Liver Dis,2008,28(1):110-122.
[2]Jin B,Alter HJ,Zhang ZC,et al.Reversibility ofexperimental rabbit liver cirrhosis by portal collagenase administration[J].Lab Invest, 2005,85(8):992-1002.
[3]Goldacre MJ,Wotton CJ,Yeates D,et al.Liver cirrhosis,other liver diseases,pancreatitisand subsequent cancer:record linkage study[J]. Eur JGastroenterol Hepatol,2008,20(5):384-392.
[4]Steib CJ,Hennenberg M,Beitinger F,et al.Amiloride reduces portal hypertension in rat liver cirrhosis[J].Gut,2010,59(6):827-836.
[5]Bae MA,Rhee SD,Jung WH,et al.Selective inhibition of activated stellate cells and protection from carbon tetrachloride-induced liver injury in rats by a new PPARgamma agonist KR 62776[J].Arch Pharm Res,2010,33(3):433-442.
[6]Watt AJ,Curtin CM,Hentz VR.Collagenase injection as nonsurgical treatment of Dupuytren's disease:8-year follow-up[J].JHand Surg Am,2010,35(4):534-539.
