双侧肾动脉不全结扎法建立肾前性急性肾衰动物模型
2011-03-08李卓然
李卓然,黄 迪,盛 旦,赵 娟,叶 静,陈 宁
(天津医科大学1.临床医学七年制;2.病理生理学教研室,天津300070)
急性肾功能衰竭(acute renal failure,ARF)是由各种原因引起的肾泌尿功能在短时间内急剧下降而出现的临床综合征。其中由肾缺血因素导致的ARF占50%。短期缺血时所出现的急性肾功能衰竭,通常为肾灌注减少导致肾小球滤过率降低所致。逆转血流动力学损害,会使肾功能迅速恢复。但若低灌注持续,可发生肾小管细胞损伤,从肾前性(功能性)转向肾性(器质性)急性肾功能衰竭[1-2]。因此及时恢复肾血流对患者的治疗和预后都有重要意义。目前教学和科研中所用的急性肾衰模型多为汞中毒和缺血-再灌注损伤所致的器质性急性肾衰[3]。本实验旨在复制出更贴近临床实际病因,体现治疗理论基础的缺血性急性肾衰,为教学科研提供实验参考。
1 材料和方法
1.1 主要药物、试剂和仪器 20%乌拉坦溶液,常规手术器械,膀胱漏斗,输液器,颈动脉插管,自制计尿器,直径0.70~0.90mm渔线,普通离心机(国产),i-STAT临床血液分析系统(美国Abott公司出产),P模块全自动生化分析仪(瑞士Roche公司产品)。
1.2 动物模型的制备 教学实验用健康新西兰白兔8只(由天津医科大学实验动物中心提供),体重1.6~2.2kg,雌雄不拘,雌者不孕。耳缘静脉注射20%乌拉坦全身麻醉,经静脉补充120~150ml生理盐水以增加基础尿量。输液期间暴露膀胱并置入连接胶管的膀胱漏斗;分离双侧肾动脉并穿线备用;颈总动脉插管以备取血。停止输液10min后,记正常15min尿量,取0.5mL动脉血做血气分析,并另取血1.5mL以备肌酐及电解质检测。然后将肾动脉与长0.80cm、直径为0.90mm的渔线一并结扎,随即取出渔线,造成肾动脉狭窄、肾血流减少的病理状态。缺血5min后开始收集尿液,并于15min后记录尿量,同时再次取血检测上述指标。缺血20min后剪断结扎线恢复肾动脉血流,随后每15min记录所收集的尿量1次并于恢复血流后30、60min时各取血1次。除肾动脉结扎前、结扎后20min及恢复肾动脉血流60min时所取供血气分析的血样立即检测外,其余所取血液标本离心后取血清保存于-20℃备检。分别在正常、缺血20min、恢复血流1h和5h时取左肾,做病理检查。
1.3 肾功能测定 用最小刻度为0.1mL的小量器收集尿液并记录尿量。采用Roche全自动生化分析仪及试剂,用P模块、酶法测定血清肌酐。采用电极法测定钠、钾、氯。使用i-STAT临床血液分析系统做动脉血气分析。
1.4 组织病理切片 将所取一侧肾脏于10%中性甲醛中固定后,石蜡包埋、切片,HE染色,光镜下观察各时段兔肾组织病理形态学变化。
2 结果
2.1 尿量 比较实验各阶段收集的15min尿量,双侧肾动脉结扎后(after ligation,AL)实验动物的尿量明显少于结扎前(before ligation,BL),恢复肾血流后(after resuming perfusion,ARP)尿量回升,15~30min期间的尿量增多达到峰值,之后回降到接近正常水平。见图1。
2.2 血清肌酐(Cr)水平 与结扎前比较,肾动脉不全结扎后动物血清Cr水平显著升高(P<0.01),恢复血流后30min其水平已有显著下降(P<0.05),至恢复血流60min时下降更甚(P<0.01),与结扎前相比已无统计学差异。见表1。
表1 家兔血清肌酐及电解质的变化(±s)Tab 1 Changes of serum creatinine and electrolytes in rabbits

表1 家兔血清肌酐及电解质的变化(±s)Tab 1 Changes of serum creatinine and electrolytes in rabbits
**P<0.01vs BL;△P<0.05,△△P<0.01vs 20minAL
时间BL 20min AL 30min ARP 60min ARP Cr(μmol/L) n=875.56±8.0590.64±10.28** 82.88±12.53△78.48±11.22△△Na+(mmol/L)n=5146.28±4.16147.30±5.57134.08±19.81142.90±3.91K+(mmol/L) n=52.82±0.312.95±0.392.68±0.542.84±0.17Cl-(mmol/L) n=5104.32±3.02106.74±2.6797.18±16.38104.20±4.14
2.3 血清钠、钾、氯检测 经重复测量分析各时段钠、钾、氯水平虽无统计学差异,但可见在肾动脉不全结扎20min后,血清钾水平呈升高趋势;随肾血流恢复,血清钠、钾、氯水平均呈下降变化,惟血钾水平下降后又有所回升。见表1。
2.4 动脉血气分析 实验动物肾动脉结扎后20min时,动脉血pH值及碳酸氢盐(HCO3-)值均较结扎前下降,而剩余碱(BE)负值增大。血流恢复60min后pH及HCO3-下降更加明显;BE负值继续增大。见表2。
表2 家兔动脉血气指标变化(n=4,±s)Tab 2 Changes of blood gas in rabbits(n=4,±s)
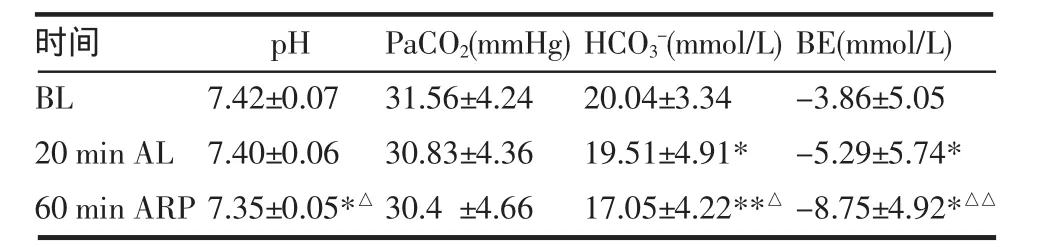
表2 家兔动脉血气指标变化(n=4,±s)Tab 2 Changes of blood gas in rabbits(n=4,±s)
*P<0.05,**P<0.01vs BL;△P<0.05,△△P<0.01vs 20min AL
时间BL 20min AL 60min ARP pH 7.42±0.077.40±0.067.35±0.05*△PaCO2(mmHg) 31.56±4.2430.83±4.3630.4±4.66HCO3-(mmol/L) 20.04±3.3419.51±4.91* 17.05±4.22**△BE(mmol/L) -3.86±5.05-5.29±5.74* -8.75±4.92*△△
2.5 兔肾病理形态学检查 将各时段兔肾组织于光镜下观察,缺血20min及恢复血流1h和5h兔肾肾被膜光滑,皮髓质结构清楚,肾小球体积未见缩小或肥大,数目未见减少,各肾小管上皮细胞未见变性、坏死或脱落,管腔中未见管型及结石,肾间质未见炎细胞浸润及纤维组织增生,肾盂上皮完整,与未结扎的正常兔肾相比无著变。
3 讨论
肾脏是机体最重要的排泄器官,急性肾功能衰竭是临床常见的危重病症。为更加明确其发病机制和探索新的治疗方法,在科研和教学中很多学者从不同角度、采取多种不同的方法制作急性肾功能衰竭的动物模型。目前采用的主要有以下2种方法:(1)肌内或皮下注射HgCl2复制急性中毒性肾功能衰竭动物模型[4-5]。(2)用动脉夹夹闭肾蒂,缺血一定时间后恢复血液灌流,造成缺血-再灌注损伤,进而形成急性肾衰动物模型[6-7]。但相对于低灌注来说,毒物并不是造成ARF的主要原因;而后一种模型已超过肾缺血本身对肾功能影响及其所导致的缺血性急性肾衰的范畴。此外虽可见通过肾动脉或静脉注射内毒素或去甲肾上腺素等药物造成急性肾衰动物模型的报道,但是也存在难以预料实验个体反应的问题[8-9]。能够在实验过程中控制双肾缺血程度的肾前性急性肾衰模型,目前尚鲜有报道。
经查阅相关文献[10-11]和大量预实验,最终选定以直径0.90mm的渔线进行双侧肾动脉不全结扎,并在肾缺血20min后恢复血流的方法制作急性功能性肾衰模型。结果显示虽然动物个体之间尿量差异较大,但总体看来,在双侧肾动脉不全结扎人为造成肾动脉狭窄状态,导致肾灌注量减少后,由于肾小球滤过率下降,出现了尿量减少。而同期的肌酐水平显著升高则显示了肾小球滤过功能受损造成了代谢产物的蓄积。此外,肾排泄功能下降还导致了代谢性酸中毒相应的血气变化和血清钾的上升。缺血20min后恢复肾血流,尿量随之逐步增多,至恢复肾血流30min时达到高峰,然后趋向正常。结合血清肌酐、电解质检测及病理检查,分析这种变化可能与前期肾排泄功能下降导致代谢产物潴留,随着肾滤过功能的恢复,代谢产物排出增多而引起的渗透性利尿有关[12]。至于恢复血流60min时血清钾水平又呈上升趋势,则不能排除尚存的代谢性酸中毒的影响。综合上述肾缺血后出现多重肾功能障碍表现、及时恢复血流后肾功能很快就得以改善恢复,以及病理切片没有发现肾单位结构发生著变的实验结果,提示所复制出的动物模型具有功能性急性肾功能衰竭的特征。
为提高模型成功率,通过大量预实验,摸索出以下经验:(1)为保证在短时间内收集到肉眼可见的基础尿量,对于缺水的实验用兔,最好于实验前经静脉补充适量生理盐水。(2)缺血时间以20min为宜,时间过短不足以造成显著的病理生理变化,时间过长,则可造成器质性损伤(如缺血30min后再恢复血流,病理上表现为光镜下部分肾小管上皮细胞有空泡变性及间质灶性淋巴细胞浸润),同时还存在再灌注损伤的可能。(3)根据家兔肾动脉粗细,可对结扎所用渔线的型号进行必要的调整。
综上所述,以双侧肾动脉不全结扎方法复制出的急性肾功能衰竭动物模型,体现了肾缺血因素在急性肾功能衰竭发生及治疗方面的作用,使学生在基础医学学习阶段即可体验到与临床实际的密切联系。该方法要求的实验工具和操作技术简易,内容丰富,可为开展肾前性(功能性)急性肾衰有关的实验教学和临床科研提供实验参考。
(本研究得到天津医科大学公共卫生学院卫生毒理学教研室王永明老师、天津医科大学代谢病医院检验科郭蓓老师的大力支持,在此一并致谢)
[1] 徐长庆.肾功能不全[M]//金惠铭,王建枝.病理生理学.第7版.北京:人民卫生出版社,2008:248-265
[2] 钱家麒.急性肾衰竭[M]//王吉耀.内科学.北京:人民卫生出版社,2005:618-623
[3] 张丽莙,朱学良.急性肾衰竭[M]//娄建石.机能学实验.北京:人民卫生出版社,2007:160-161
[4] Zhao ZG,Niu CY,Zhang YP,et al.Pancreatic injury in rabbits with acute renal failure[J].Ren Fail,2009,31(10):977
[5] Augusti PR,Conterato GM,Somacal S,et al.Effect of astaxanthin on kidney function impairment and oxidative stress induced by mercuric chloride in rats[J].Food Chem Toxicol,2008,46(1):212
[6] 陈彦文,严苏纯.百红胶囊对家兔急性肾缺血再灌注损伤中MDA、SOD及Ca2+的影响作用[J].中华中西医学杂志,2002,4(1):11
[7] Pinheiro HS,Camara NO,Noronha IL,et al.Contribution of CD4+T cells to the early mechanisms of ischemia-reperfusion injury in a mouse model of acute renal failure[J].Braz J Med Biol Res,2007, 40(4):557
[8] Cichy MC,Rocha FG,Tristão VR,et al.Biomarker and drug-target discovery using proteomics in a new rat model of sepsis-induced acute renal failure[J].Kidney Int,2006,70(3):496
[9] 肖文星,宾建平,许顶立.去甲肾上腺素对肾脏血流影响的研究进展[J].新乡医学院学报,2005,22(4):400
[10]张福林,孔祥林,吴细香,等.犬肾组织不可逆性损害模型的建立[J].中国危重病急救医学,2004,2(2):112
[11]符庆瑛,李著华.肾缺血再灌注损伤中微血管损伤防治的研究进展[J].微循环学杂志,2004,14(1):50
[12]胡维诚.肾功能障碍[M]//陈主初.病理生理学.北京:人民卫生出版社,2005:344-365
