特异性抗原致敏的DC-CIK与DC-CTL细胞对黑色素瘤抑瘤作用的比较
2011-03-08任鹏涛蔡建辉
任鹏涛,张 苑,蔡建辉,张 艳,田 青
(河北医科大学第二医院胃肠外科,石家庄050000)
黑色素瘤是临床上常见的恶性肿瘤之一,手术难以彻底切除,且化疗、放疗等常规治疗方法的效果均不明显。近年来发现过继免疫治疗对其有较好的疗效。过继免疫治疗对肿瘤病人免疫系统的重建,清除微小肿瘤病灶,提高病人生活质量及延长生存时间等具有重要的意义。但在治疗过程中最关键的是要获得杀伤效果好、存活时间长、数量多的免疫效应细胞。目前常用于临床的肿瘤浸润淋巴细胞和淋巴因子激活的杀伤细胞(lymphokine activated killer,LAK细胞)等效应细胞都存在杀伤活性弱、增殖活性低或在临床应用时副作用大等问题。细胞因子诱导的杀伤细胞(cytokine induced killer,CIK细胞)和细胞毒性T淋巴细胞(cytotoxic lymphocytes, CTL)因其具有杀瘤谱广、增殖能力强、副作用小等优点从而成为现阶段过继免疫治疗中效应细胞研究的热点。本实验试图通过两者对细胞增殖周期和细胞凋亡的影响以及杀伤实验效果的研究进一步为临床提供更为安全、有效的肿瘤免疫治疗效应细胞。
1 材料和方法
1.1 主要试剂和实验动物 IL-1α、IL-2、INF-γ、GM-CSF均购自美国PEPRO TECH公司,RPMI1640培养基和青霉素-链霉素购自美国HYCLONE公司,胎牛血清购自杭州四季青生物工程材料有限公司,四甲基偶氮盐(MTT)购自SIGMA公司。
C57BL/6小鼠(8周龄,雌性,体重15~20g,平均体重18g,共70只)由河北医科大学动物实验中心提供,按标准培养环境条件饲养。小鼠B16黑色素瘤细胞株由中国科学院上海生物化学与细胞生物学研究所细胞库提供。
1.2 实验方法
1.2.1 树突状细胞(DC)的制备[1]DC的培养:无菌条件下取小鼠脾脏(10只小鼠),研磨,200目筛网过滤,采用密度梯度离心,将得到的PBMC放入RPMI-1640培养基(含10%胎牛血清)吹打混匀,调整细胞浓度为5×106个/mL,加入24孔板中,每孔1mL,置于37℃,5%CO2培养箱中3h。用完全培养液洗去非贴壁细胞,获得贴壁的单核细胞。加入IL-4(500U/mL)和GM-CSF(1000U/mL),于5%CO2培养箱内培养,以后每3d半量换液1次。
1.2.2 CIK细胞的制备[2]CIK细胞的培养[2]:取上述含未贴壁细胞的培养液中加入INF-γ(1000U/mL),24h后加入IL-1α(100U/mL)、CD3McAb(50ng/mL)和IL-2(500U/mL),于5%CO2培养箱中培养,每3d半量换液1次,第14天收获细胞。
1.2.3 肿瘤全抗原和抗原负载的DC-CIK的制备 B16黑色素瘤细胞株在PRMI-1640培养基中培养、传代,消化收集对数生长期的该细胞,离心,洗涤,封装入冻存管中。缓慢放入液氮内10min,取出后立即置入37℃水浴箱中10min,该冻融步骤共重复3次。随后将其放入离心机中3000r/min,离心10min。取上清液,于-20℃冰箱中保存备用。在DC培养的第6天加入按上述方法制备的肿瘤冻融抗原,3d后收集该DC加入CIK细胞培养瓶中(DC∶CIK=1∶10)共同培养即为特异性抗原负载的DCCIK,再培养4d后记数并收集细胞。
1.2.4 特异性抗原负载的DC-CTL的制备[3]取正常小鼠抗凝静脉血梯度离心法分离外周血单核细胞,尼龙毛柱法分离得到T淋巴细胞。将培养9d的DC细胞与肿瘤抗原共同孵育3d,加入培养5d的T淋巴细胞培养瓶内,再共同培养24h,所获得的细胞即为特异性抗原负载的DC-CIK细胞。
1.2.5 建立B16黑色素瘤动物模型及效应细胞的注射 60只C57小鼠,将低温保存的B16恶性黑色素瘤细胞复苏后传代、培养,取对数生长期的细胞消化后,离心并进行细胞计数,调整细胞浓度至5×106/mL,C57BL/6小鼠左肩背部皮肤消毒后,注射器吸取0.2mL接种于该处皮下,迅速用镊子夹住皮肤,防止接种细胞悬液回流。然后随机将小鼠分为3组:第1组:特异性抗原负载的DC-CIK;第2组:特异性抗原负载的DC-CTL;第3组:对照组。待小鼠注射部位形成黑色肿瘤后(接种第14天接种部位出现直径0.33~1.67cm大小的肿瘤,平均直径0.68cm),按照分组于小鼠鼠尾静脉分别注射以上培养的DCCIK和DC-CTL效应细胞,剂量均为0.2mL(细胞浓度为1×106/mL,对照组于鼠尾静脉注射同等剂量的生理盐水)。第15天提取标本。
1.2.6 对肿瘤细胞的体外杀伤作用的检测 采用MTT比色法检测2组效应细胞对B16细胞的抑瘤作用。按效靶比例1∶10、1∶20、1∶40加入B16黑色素瘤细胞接种24h的96孔板内,共同培养24h加入新鲜配制的5mg/mL的MTT 10μL,共同培养4h,离心(2000r/min 5min),吸弃上清液,每孔加DMSO100μL振荡溶解10min,用酶标检测仪在570nm处测定吸光度A值。同时设空白对照、靶细胞对照、效应细胞对照。每孔数值减去空白孔对照,求出3个复孔的平均A值,按下面公式计算效应细胞的细胞毒活性,以杀伤率表示:杀伤率(%)=[靶细胞对照A值-(实验孔A值-效应细胞对照A值)]/靶细胞对照A值×100%
1.2.7 对肿瘤细胞增殖和凋亡作用的影响 每组取5只小鼠在治疗注射结束后5d脱颈椎处死。先测量瘤体大小及瘤体重量。再取癌肿结节2份,1份用4%戊二醛固定,制备电镜标本,透射电镜观察。另1份用70%乙醇固定,制备流式细胞仪检测标本上流式细胞仪检测凋亡率,每个标本重复3次。
1.3 统计学处理 计算癌细胞凋亡指数(AI)与增殖指数(PI)的比率以及细胞周期中G0/G1期、S期、G2/M期各期细胞比率,并应用SPSS11.0统计软件,采用方差齐性t检验进行统计学分析。
2 结果
2.1 DC细胞的形态学观察 从外周血获得的单个核细胞,培养3h后,获得贴壁细胞,多为体积小、圆形的单个核细胞。培养2~3d的细胞开始出现变形,体积增大,由规则的圆形变为不规则,表面有细小的树突状伪足。第5天时,细胞的体积更大,表面出现大量毛刺状突起,并且细胞常聚集成大小不等的细胞团,部分细胞开始悬浮。培养至7~9d成熟后,大部分细胞开始悬浮,呈典型的树突状细胞形态。在扫描电子显微镜下可以观察到DC细胞表面有丝状、星型、毛棘状等伪足样突起(图1)。
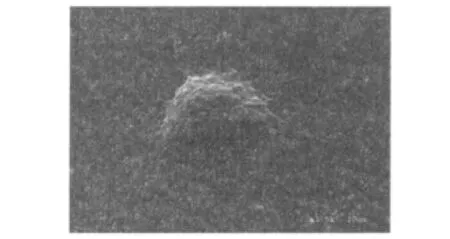
图1 DC细胞电镜图片Fig 1 Morphological observation of dendritic cell(DC)
2.2 免疫表型的测定 DC高表达CD1a、CD80、CD86、HLA-DR;流式细胞检测表明CIK细胞属于异质细胞群,但随着培养时间的延长,CD3+CD8+、CD3+CD56+所占细胞的比率明显升高。
2.3 DC-CIK和DC-CTL的抑瘤作用 DC-CIK组肿瘤平均体积(0.0377±0.0128)cm3,DC-CTL组肿瘤平均体积(0.0359±0.0131)cm3,对照组肿瘤平均体积(0.4052±0.0429)cm3。DC-CIK组和DC-CTL组肿瘤体积明显小于对照组(P<0.05),DC-CIK组和DC-CIK组两组之间比较,虽然DC-CTL组体积略小,但没有显著性差异(P>0.05)。瘤体重量对照组为(2.061±1.07)g,DC-CIK组(0.958±0.32)g,DCCTL组(0.939±0.41)g,两实验组瘤体重量明显小于对照组(P<0.05),但两实验组之间没有显著性差异(P>0.05)。
2.4 对肿瘤细胞凋亡作用的影响
2.4.1 透射电镜观察细胞凋亡情况 透射电镜观察对照组小鼠瘤细胞核增大、畸形,核膜结构清晰,细胞质少,核质比例失调,细胞质内有大量线粒体、游离核蛋白体丰富;实验组可见瘤细胞体积不同程度的减小,形态不规则,与邻近的瘤细胞脱离,且细胞核皱缩,胞质浓缩,线粒体空泡化,核异染色质边集,浓缩成半月形,可见小而圆的无结构的凋亡小体。部分肿瘤细胞出现细胞膜破坏,胞质外溢。
2.4.2 DC-CIK细胞、DC-CTL细胞对癌细胞增殖周期和细胞凋亡的影响 实验组两组细胞,流式细胞DNA直方图上均可见不同程度的凋亡峰,而对照组未见凋亡峰(图2)。
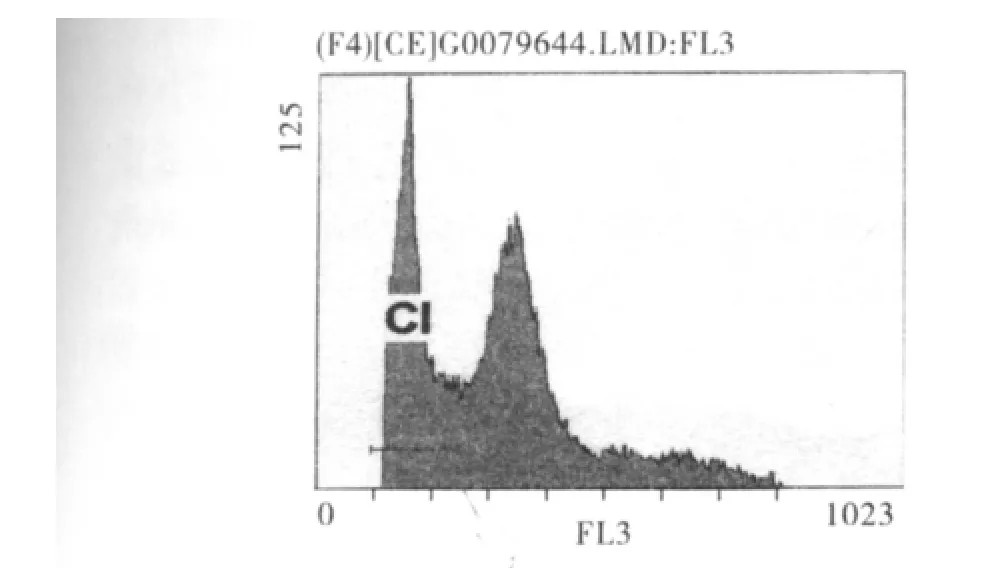
图2 凋亡峰在实验组表现Fig 2 Apoptosis peak observed in experiment group
实验组两组细胞作用后与对照组细胞相比较,瘤细胞中G0/G1期比率和细胞AI显著增加(P<0.05),S期未见显著变化(P>0.05),G2/M期细胞比率和细胞PI下降(P<0.05),但实验组两组之间没有有显著差异(P>0.05),见表1。
2.5 细胞体外抑瘤作用 DC-CIK和DC-CTL对肿瘤细胞都有较强的杀伤作用,但DC-CTL对B16黑色素细胞的杀伤作用明显高于DC-CIK(P<0.05),且杀伤活性随着效靶比的增加而升高,见表2。

表1 DC-CIK、DC-CTL细胞对B16黑色素瘤细胞G0/G1、S、G2/M期细胞比率及对AI、PI的影响Tab 1 Effect of DC-CIK cells and DC-CTL cells on the rate of B16melanoma cells in G0/G1,S,G2/M stages,PI and AI rate of tumor cells
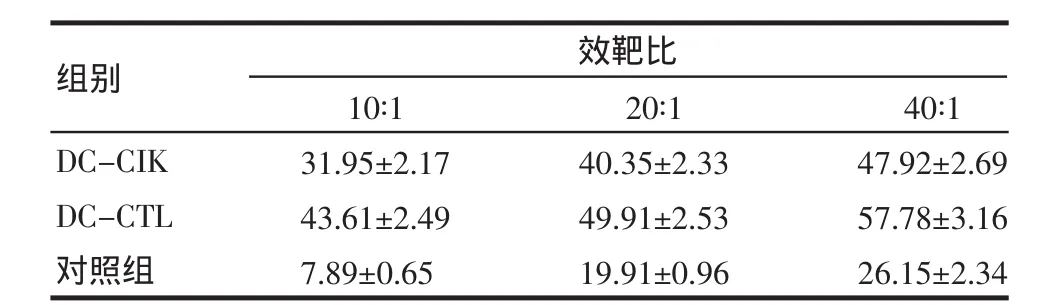
表2 DC-CIK和DC-CTL对B16黑色素瘤的杀伤活性Tab 2 Killing activity of DC-CIK and DC-CTL effector cells to B16melanoma cells
3 讨论
树突状细胞是体内最重要的、功能最强的抗原递呈细胞,它能有效的摄取、加工、递呈肿瘤抗原,在机体的抗肿瘤免疫中发挥着重要的作用[4]。CIK细胞是在体外通过加入不同的细胞因子刺激外周血单个核细胞培养而获得的一群异质细胞,具有T淋巴细胞强大的抗瘤活性和NK细胞的非MHC限制性杀瘤优点[5]。众多研究表明DC细胞与CIK细胞共同培养可以提高CIK细胞对靶细胞的细胞毒杀伤作用[6-8],其机制可能为(1)DC细胞分泌的多种细胞因子,如IL-2、INF-γ等可以促进CIK细胞的进一步成熟。(2)DC分泌的IL-12明显升高,诱导Th-1型免疫应答,可以进一步清除肿瘤细胞。且肿瘤细胞总蛋白中包含有丰富的膜抗原、MHC抗原表位等成分,经过特异性抗原致敏的DC细胞的摄取、加工和递呈后,可诱导针对该特异性抗原的特异性细胞毒性T淋巴细胞,发挥有效的抗肿瘤免疫效应。肿瘤特异性CTL对肿瘤细胞的杀伤在肿瘤免疫应答中起着极为重要的作用[9]。由于肿瘤细胞表达的抗原肽水平较低,不易于被T淋巴细胞所识别,难以诱发肿瘤细胞的特异性杀伤。而CTL细胞的激活需要肿瘤抗原致敏和抗原递呈细胞所提供的共刺激因子,DC作为功能最强大的抗原递呈细胞,可以提供共刺激因子来诱导CTL的肿瘤杀伤作用。本实验证实特异性抗原致敏的DC-CIK和DC-CTL对肿瘤细胞都有较强的杀伤作用,说明DC已经成功摄取了B16黑色素瘤细胞抗原递呈给淋巴细胞激活了针对B16黑色素瘤的特异性杀伤作用。同时实验表明DC-CTL的杀伤作用明显高于DC-CIK,说明虽然特异性抗原致敏的DC-CIK有一定的杀伤能力,但可能由于肿瘤细胞的免疫逃避等因素使得总的杀伤效能较DC-CTL低,但其机制有待进一步的研究。同时促进肿瘤细胞的凋亡也是治疗肿瘤的有效方法。此次实验表明,特异性抗原致敏的DC-CIK和DC-CTL对肿瘤细胞都有明显的诱导细胞凋亡的作用,两者之间并没有明显的差异。一些研究表明CIK和CTL都通过Fas/FasL系统诱导细胞的凋亡,但具体的途径尚不明了[10-11]。
本研究表明特异性抗原致敏的DC-CIK与DC-CTL细胞可以有效的杀伤B16黑色素瘤细胞并诱导瘤细胞凋亡,但DC-CTL的杀伤效能较DCCIK明显增高,虽然其机制有待进一步研究,但仍然为临床提供更为安全、有效的肿瘤免疫治疗效应细胞提供了一定的理论基础。
[1]谢遵江,曹立敏,贺业春,等.体外培养小鼠树突状细胞的扩增鉴定及形态学观察[J].解剖科学进展,2005,11(3)240
[2]Hishii M,Kurnick JT,Ramiraz T,et al.Studies of zhe mechanism of cytolysis by tumor-infiltrating lymphocytes[J].Clin Exp Immunol, 1999,116(3):388
[3] Bachleinter T,Stift A,Friedl J,et al.Stimulation of autologous antitumor T-CELL responses against medullary thyroid carcinoma using tumor lysate-pulsed dendritic cells[J].J Clin Endocrinol Metabol,2002,87(3):1098
[4] Leemhuis T,Wells S,Scheffold C,et al.A phase I trial of autologous cytokine-induced killer cells for the treatment[J].Biol Blood Marrow Transplate,2005,11(3):181
[5] Liebrich W,Schlag P,Manasterski M,et al.In vitro and clinical characterization of a Newcastle disease virus-modified autologous tumor cell vaccine for treatment of colorectal cancer patients[J]. Eur J Cancer,1991,27(6):708
[6] Marten A,Renoth S,Toal M,et al.Enhanced lytic activity of cytokine-induced killer cells against multiple myeloma cells after co-culture with idiotype-pulsed dendritic cells[J].Haematologica, 2001,86(10):1029
[7]Zoll B,Lefterova P,Ebert O,et al.Modulation of cell surface markers on NK-like T lymphocytes by using IL-2,IL-7or IL-12in vitro stimulation[J].Cytokine,2000,12(9):1385
[8]Geroea F,Bajdani B,Nisii C,et al.Reciprocal activating interaction between natural killer cells and dendritic cells[J].Exp Med,2002, 195(3):327
[9]Syme R,Gluck S.Generation of dendritic cells:role of cytokines and potential clinical application[J].Official J Eur Society FOR Haemapheresis,2001,24:117
[10]Panther E,Corinti S,Ldzko M,et al.Adenosine affects expression of membrane molecules,cytokine and chemokine release,and the T-cell stimulatory capacity of human dendritic cells[J].Blood,2003, 101(15):3598
[11]Gabriele L,Borghi P,Rozera,et al.TNF-alpha promotes the rapid differentiation monocytesfrom pqtientswith chronicmyeloid leukom into activated dendritic cells tumed to undergo full maluration LPS treatment[J].Blood,2004,103(3):980
