信号转导蛋白P65与放疗诱导口腔鳞状细胞癌细胞凋亡的关系
2011-03-07马利张东升吴军楼韩俊庆张世周刘桂军牟文丽张捷
马利 张东升 吴军楼 韩俊庆 张世周 刘桂军 牟文丽 张捷
(1.山东大学附属省立医院 口腔颌面外科;
2.肿瘤研究治疗中心;3.临床科研中心,济南 250021)
信号转导蛋白P65与放疗诱导口腔鳞状细胞癌细胞凋亡的关系
马利1张东升1吴军楼1韩俊庆2张世周1刘桂军1牟文丽3张捷3
(1.山东大学附属省立医院 口腔颌面外科;
2.肿瘤研究治疗中心;3.临床科研中心,济南 250021)
目的 探讨不同剂量的X射线对口腔鳞状细胞癌(OSCC)细胞中信号转导蛋白P65表达的影响以及P65与放疗诱导口腔鳞状细胞癌细胞凋亡的关系。方法 人舌鳞癌Tca8113细胞复苏后,在37℃,5%CO2的孵箱中培养。共分对照组、2、4、6、8、10Gy剂量组,待细胞长至对数生长期后,对细胞分别应用上述照射剂量一次性照射。照射后继续培养,并在照射后的不同时间点(1、3、6、10、24、48 h)应用免疫细胞化学和Western blot检测细胞中P65的表达量,并同时应用流式细胞仪和末端核苷酸转移酶介导的生物素化的dUTP末端标记(TUNEL)法检测不同X射线剂量组的细胞凋亡率。结果 不同X射线剂量组的细胞浆内P65蛋白的表达量与对照组相比差异均具有统计学意义(P<0.05),而不同时间点组的细胞浆内P65蛋白表达量相互比较,3 h组的细胞浆内P65蛋白表达量与其他时间点组相比差异有显著性(P<0.05)。不同剂量组的凋亡率与对照组相比,差异均具有统计学意义(P<0.05),而不同时间点组的凋亡率相互比较时,3 h组的凋亡率与其他时间点组相比差异有统计学意义(P<0.05)。结论 X射线可以激活口腔鳞状细胞癌细胞中核因子-κB(NF-κB)P65信号转导通路,而P65在细胞浆中表达与放疗诱导口腔鳞状细胞癌细胞凋亡具有正相关性,激活后进入细胞核内的P65蛋白可能具有抵抗细胞凋亡的作用。
P65; 口腔鳞状细胞癌; 细胞凋亡
在中国,口腔颌面部-头颈癌约占全身恶性肿瘤的5.6%,其中口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是最常见的类型,占该部位肿瘤的80%[1]。据目前的统计,经过手术和放疗为主的综合治疗后,口腔颌面部鳞癌患者5年生存率达到65%左右,但对晚期患者,尽管辅以放疗、化疗和生物治疗的综合治疗手段,5年生存率仅为20%~40%,尚不能令人满意[2]。细胞凋亡是放射线所致细胞死亡的形式,因此肿瘤细胞的凋亡有可能成为预测肿瘤放疗敏感性的指标之一。
核因子-κB(nuclear factor-κB,NF-κB)是与免疫球蛋白的轻链基因增强子κB序列(GGGACTTTCC)特异结合的核转录因子,在细胞的增殖调控和凋亡过程中起重要的作用[3]。因此本课题采用Tca8113细胞,通过研究X射线对口腔鳞状细胞癌细胞中NF-κB P65信号转导通路的激活作用以及放射线诱导口腔鳞状细胞癌细胞的凋亡变化,旨在探讨P65在放射线诱导口腔鳞状细胞癌细胞凋亡中的变化,为进一步揭示其在放射线诱导肿瘤细胞凋亡中的作用提供实验基础。
1 材料和方法
1.1 材料及试剂
实验所需舌鳞状细胞癌细胞系Tca8113由上海交通大学医学院附属第九人民医院口腔颌面肿瘤生物实验室提供;胎牛血清(杭州四季青公司),RPMI1640(Hyclone公司,美国),NF-κB P65单克隆抗体(Santa Cruz公司,美国),免疫组织化学试剂盒、DAB显示液(购自北京中杉金桥生物技术有限公司),细胞裂解液、蛋白浓度测定试剂盒(购自上海申龙博彩生物技术有限公司),β-actin(Santa Cruz公司,美国),鼠抗人二抗(Santa Cruz公司,美国),流式细胞仪(Sony公司,日本),Annexin V/FITC和PI双染标记试剂盒(深圳晶美生物工程有限公司),TUNEL试剂盒(Roche公司,德国)。
1.2 方法
1.2.1 细胞培养及传代 复苏Tca8113细胞,用含10%胎牛血清的RPMI1640培养基,在37℃、5%CO2的孵箱中培养,待细胞生长至80%时,用0.25%胰酶和0.2%EDTA以1∶1的体积比混合消化细胞,传代培养。
1.2.2 细胞照射 将细胞分为6个实验组,待细胞长至对数生长期后,对细胞进行照射,照射后继续在37℃、5%CO2的孵箱中培养。照射机器用山东大学附属省立医院肿瘤研究治疗中心德国西门子PRIMUSH医用直线加速器。照射时在细胞培养瓶上方覆盖约1 cm厚的湿润棉纱,以相当于肿瘤表面的正常组织厚度。
1.2.3 免疫细胞化学检测 细胞照射后的1、3、6、10、24、48h在无菌条件下分别自培养瓶中取出细胞爬片,用4%的多聚甲醛固定,并用2%的Triton X-100处理细胞,应用正常血清封闭10min后加入一抗,4℃冰箱过夜,第2天加入二抗后室温孵育20min,以上每步完成后应用PBS液冲洗5min×3次。DAB显色剂显色后应用中国树胶封片,并分别在每个实验组的每张切片上随机选择4个部位拍摄图片,并测其平均灰度值。
1.2.4 Western blot检测 在照射后不同时间点分别对每个剂量组细胞进行收集,对细胞进行裂解,裂解后4℃ 20 000 r·min-1高速离心10min,收集上清液于无菌EP管中,应用BCA法测试蛋白的浓度,并将蛋白样品于-80℃冻存备用。蛋白变性后按上样量20μg上样,电泳,转膜后加入一抗(浓度为1∶1 000),4℃冰箱孵育过夜,用1×TBST溶液洗膜3次,加入二抗(浓度为1∶5000)后室温孵育1h,暗室曝光显影。用图像分析仪定量细胞P65含量的灰度值。
1.2.5 流式细胞仪检测 照射后的不同时间点分别对每个剂量组细胞进行收集,用PBS洗细胞2次,用结合缓冲液重悬细胞,向反应管中加入Annexin V/FITC 5μL和PI 10μL,混匀后于室温避光孵育15min;孵育完成后分别在反应管中加入400μL 1×结合缓冲液,上机检测细胞的凋亡率。
1.2.6 TUNEL法检测 制作细胞爬片,细胞照射后的1、3、6、10、24、48 h在无菌条件下分别自培养瓶中取出细胞爬片,用4%的多聚甲醛室温固定1 h;加封闭液室温孵育10min;打孔液在冰上孵育2min;加入TUNEL混合反应液,37℃避光孵育60min;然后加入Converter-POD,37℃孵育30min;最后加入DAB显色液显色,室温孵育10min;以上每步完成后均用PBS漂洗,3次共15min,吸去多余的水分,自然晾干,中国树胶封片。分别在每个实验组的每张切片上随机选择4个部位拍摄图片,计算其凋亡率。
1.2.7 数据分析 应用SPSS 13.0软件包对实验数据进行方差分析。
2 结果
2.1 免疫细胞化学检测细胞中NF-κB P65表达的变化情况
NF-κB P65免疫细胞化学阳性染色呈棕褐色细颗粒状,主要定位于肿瘤细胞的胞浆中,以染色的深浅代表阳性的程度。在对照组的Tca8113细胞中,胞浆着色明显,胞核无明显着色,而随着照射剂量的增加,NF-κB P65在胞核中的染色逐渐深染(图1)。X射线照射细胞后,NF-κB P65在细胞浆中的表达量减少,其平均灰度值也相应降低,2、4、6、8、10Gy组与对照组的平均灰度值进行统计学检验,差异均具有统计学意义(P<0.05)。而不同时间点的平均灰度值相互比较,统计检验结果显示:3 h组的平均灰度值与其他时间点相比差异有显著性(P<0.05,表1)。

图1 不同实验组Tca8113细胞的染色情况 倒置显微镜 ×400Fig 1 The staining in various groups of Tca8113 cells inverted microscope ×400

表1 不同剂量组在照射后不同时间点测得Tca8113细胞灰度值Tab 1 Com parsion of Tca8113 cells between different dose groups and different time groups
2.2 Western blot检测细胞中NF-κB P65表达的变化情况
对照组中应用X射线照射细胞后各时间点的P65蛋白表达量无明显变化,而不同剂量组照射后细胞浆中的P65蛋白表达量均出现明显的变化,因此胞浆中P65蛋白的表达变化在一定程度上反映了细胞核中P65蛋白表达的多少,并且不同剂量组NF-κB P65蛋白表达量的平均值与对照组相比均具有统计学意义(P<0.05),同样,不同时间点其表达量的平均值相互比较,3 h组蛋白表达平均值与其他时间点相比差异有显著性,具有统计学意义(P<0.05),与免疫细胞化学检测到的结果一致(图2)。

图2 Western blot检测不同实验组Tca8113细胞浆中P65含量的变化Fig 2 Change of P65 of Tca8113 cells in various groups cytoplasm with Western blot
2.3 流式细胞仪和TUNEL法检测细胞的凋亡率
用X射线激活Tca8113细胞中的NF-κB信号转导通路后,用流式细胞仪和TUNEL法检测细胞凋亡率,凋亡曲线如图3、4所示。而TUNEL法检测到的阳性细胞散在分布,胞核或胞质同时呈棕黄色,有典型凋亡细胞形态特征,与周围细胞分离,胞体较小,染色质沿核膜呈规则半月形边集或碎裂或形成凋亡小体,其凋亡细胞的多少与放射线的剂量和时间有依赖关系(图5)。流式细胞仪和TUNEL法分别检测的不同剂量组的细胞凋亡率与对照组相比,差异均具有统计学意义(P<0.05),而将不同时间点组的平均细胞凋亡率相互比较后发现,3 h组的凋亡率与其他时间点组相比有统计学意义(P<0.05),其变化与细胞浆中NF-κB P65信号转导蛋白的表达变化趋势一致。

图3 流式细胞仪检测Tca8113细胞的凋亡曲线Fig 3 The cell apoptosis curve of Tca8113 cells by flow cytometer
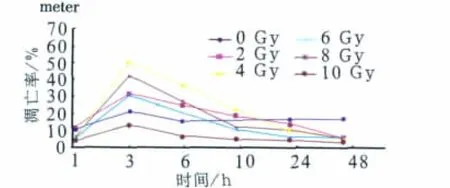
图4 TUNEL法检测Tca8113细胞的凋亡曲线Fig 4 The cell apoptosis curve of Tca8113 cells by TUNEL

图5 Tca8113细胞凋亡图像 TUNEL ×400Fig 5 The cell apoptosis figure of Tca8113 cells TUNEL ×400
3 讨论
3.1 X射线对NF-κB P65信号转导通路的影响
目前在哺乳类动物中发现的NF-κB/Rel蛋白主要有5种:RelA(P65)、RelB、c-Rel、NF-κB1(p50)、NF-κB(p52),它们均以同源或异源二聚体的形式存在细胞质中,其中最主要的是P65/P50异源二聚体[4]。研究表明许多因素如细菌、病毒、真菌、炎症因子、脂多糖(lipopolysaccharide,LPS),氧化应激反应,紫外线以及治疗用药物等均可以激活NF-κB P65信号转导通路[5]。NF-κB通过3种途径活化,其中2条途径是IκB激酶依赖的,另一条途径与酪蛋白激酶2有关,活化后的NF-κB进入细胞核中,可与相关基因启动子和增强子特殊DNA序列结合,调控凋亡相关基因、原癌基因以及肿瘤转移相关黏附分子、细胞外基质水解酶等多种基因的表达[6]。
Ramanan等[7]研究发现:在啮齿类动物中,放射线可以通过激活NF-κB P65信号转导通路而引起小神经胶质细胞的损伤;Fan等[8]同样应用放射线激活了小鼠皮肤表皮细胞的NF-κB信号转导通路;而本课题组先前的课题[9]研究也发现:应用X射线可以激活ACC-2细胞中的NF-κB P65信号转导通路。本实验应用不同剂量X射线一次性照射Tca8113细胞后,应用免疫细胞化学和Western blot均检测到了NF-κB P65信号转导蛋白在细胞浆中的表达变化,分析后发现此信号转导蛋白的表达具有时间和剂量依赖性,不同剂量组X射线P65的表达高峰是不一样的。目前临床上应用最广泛的放射治疗方法为常规分割放射治疗和非常规放射治疗,也即采用的均是连续多次照射。而本实验所采用的照射剂量均是一次性照射,因此一次性照射与连续性多次照射对此信号转导通路的影响是否一致还有待进一步的研究。
3.2 NF-κB P65在放射线诱导细胞凋亡中的变化
放射线诱导肿瘤细胞凋亡是放射治疗的主要机制之一,与肿瘤组织细胞放射敏感性或放射抗性有关。现代研究发现:放疗过程中可见大量具有凋亡特征的癌细胞。细胞凋亡是一个由多基因参与的细胞主动自杀过程,不同诱发因素经不同信号途径,将细胞外信号转导至细胞内,激活凋亡基因,进而激活各种蛋白酶降解各自的底物,导致凋亡发生。在肿瘤的放射治疗中,肿瘤细胞受照射后,DNA受损而发生单链断裂,而且核酸内切酶活性升高,使DNA单链断裂变为双链断裂,诱发凋亡[10]。
研究[11]发现:NF-κB在调节细胞凋亡中起着重要作用。激活后的NF-κB进入细胞核中与特异的DNA序列结合,从而参与在抗凋亡、细胞周期和细胞间黏附中起重要意义基因的转录调控,放射线和一些细胞毒性药物可激活NF-κB,抑制NF-κB可减少肿瘤的生长,并提高肿瘤细胞对抗肿瘤药物和放射线介导的凋亡敏感性。Beg等[12]通过检测敲除NF-κB P65亚单位的大鼠肝脏后发现:缺失P65亚单位大鼠的大量肝脏细胞出现凋亡。以后越来越多证据进一步证明了NF-κB对辐射的抗凋亡活性,激活NF-κB可以阻断辐射诱导的凋亡过程。而Chen等[13]应用去甲斑蝥素激活HepG2细胞中NF-κB信号通路后可以诱导细胞凋亡,可见激活后的NF-κB具有促进或抑制细胞凋亡的作用,此可能与诱导物或细胞类型有关。
本课题将流式细胞仪及TUNEL检测方法联合应用来检测不同剂量X射线诱导口腔鳞状细胞癌细胞的凋亡率。实验研究发现细胞经过不同剂量X射线照射后,与对照组相比均出现了细胞凋亡率的增加,且在不同的时间点其凋亡率也是不同的;各时间点组的平均凋亡率相比发现:3 h组的平均凋亡率更具有统计学意义,这与本课题组前期已经证实的不同剂量X射线照射口腔鳞状细胞癌细胞后NF-κB P65信号转导蛋白在细胞浆中的表达变化是一致的。由于对照组中P65蛋白在胞浆中表达无明显变化,因此胞浆中P65蛋白的表达变化在一定程度上也反应了细胞核中P65蛋白表达的多少,因此推测激活后进入细胞核中的NF-κB P65信号转导蛋白表达量的多少可能与X射线诱导Tca8113细胞凋亡有关,但其具体作用还有待进一步研究证实。
[1] 卞金友.口腔预防医学[M].北京:人民卫生出版社,2000:40-41.
BIAN Jin-you.Stomatological preventivemedicine[M].Beijing:People’s Medical Publishing House,2000:40-41.
[2] 邱蔚六,张志愿.口腔颌面肿瘤学[M].济南:山东科学技术出版社,2004:1-11.
QIU Wei-liu,ZHANG Zhi-yuan.Oral and maxillofacial oncology [M].Jinan:Shandong Science and Technique Press,2004:1-11.
[3] Pande V,Sharma RK,Inoue J,et al.A molecular modeling study of inhibitors of nuclear factor kappa-B(p50)—DNA binding[J]. J Comput Aided Mol Des,2003,17(12):825-836.
[4] Delhalle S,Blasius R,Dicato M,et al.A beginner’s guide to NF-kappaB signaling pathways[J].Ann N Y Acad Sci,2004,1030:1-13.
[5] Xiao G,Rabson AB,Young W,et al.Alternative pathways of NF-kappaB activation:A double-edged sword in health and disease [J].Cytokine Growth Factor Rev,2006,17(4):281-293.
[6] Salminen A,Huuskonen J,Ojala J,et al.Activation of innate immunity system during aging:NF-kB signaling is the molecular culprit of inflamm-aging[J].Ageing Res Rev,2008,7(2):83-105.
[7] Ramanan S,Kooshki M,Zhao W,et al.PPARalpha ligands inhibit radiation-induced microglial inflammatory responses by negatively regulating NF-kappaB and AP-1 pathways[J].Free Radic Biol Med, 2008,45(12):1695-1704.
[8] Fan M,Ahmed KM,Coleman MC,et al.Nuclear factor-kappaB and manganese superoxide dismutase mediate adaptive radioresistance in low-dose irradiated mouse skin epithelial cells[J].Cancer Res,2007,67(7):3220-3228.
[9] 刘桂军,张东升,韩俊庆,等.放疗对人唾液腺腺样囊性癌p65信号传导通路的影响[J].中国口腔颌面外科杂志,2006,4(5):361-365.
LIU Gui-jun,ZHANG Dong-sheng,HAN Jun-qing,et al.The effect of radiotherapy on p65 signal conduct access of adenoid cystic carcinoma cell[J].Chin JOral Maxillofac Surg,2006,4(5):361-365.
[10]Meyn RE,Milas L,Ang KK.The role of apoptosis in radiation oncology[J].Int J Radiat Biol,2009,85(2):107-115.
[11] Yeoh A,Gibson R,Yeoh E,et al.Radiation therapy-induced mucositis:Relationships between fractionated radiation,NF-kappaB,COX-1,and COX-2[J].Cancer Treat Rev,2006,32(8):645-651.
[12] Beg AA,Sha WC,Bronson RT,et al.Embryonic lethality and liver degeneration in mice lacking the RelA component of NF-kappaB[J].Nature,1995,376(6536):167-170.
[13] Chen YN,Cheng CC,Chen JC,et al.Norcantharidin-induced apoptosis is via the extracellular signal-regulated kinase and c-Jun-NH2-terminal kinase signaling pathways in human hepatoma HepG2 cells[J].Br J Pharmacol,2003,140(3):461-470.
(本文编辑 汤亚玲)
Relationship between P65 and radiotherapy-induced oral squamous cell carcinoma cell line apoptosis
MA Li1,ZHANG Dong-sheng1,WU Jun-lou1,HAN Jun-qing2,ZHANG Shi-zhou1,LIU Gui-jun1,MU Wen-li3,ZHANG Jie3.(1.Dept.of Oral and Maxillofacial Surgery,Provincial Hospital Affiliated to Shandong University,Jinan250021,China; 2.Cancer Center,Provincial Hospital Affiliated to Shandong University,Jinan250021,China;3.Medical Research Center,Provincial Hospital Affiliated to Shandong University,Jinan250021,China)
ObjectiveTo investigate the effects of different X-ray doses on the expression of nuclear factor-κB(NF-κB)P65 in human oral squamous cell carcinoma cell(OSCC)line and the relationship between NF-κB P65 and radiation-induced OSCC cell line apoptosis.MethodsThe squamous cell carcinoma of Tca8113 cell was cultivated in the 37℃,5%CO2incubator after recovery.The experiment samples were divided into six groups(control group,2,4, 6,8,10 Gy).After growing to logarithm period,Tca8113 cells were irradiated using above-mentioned X-ray doses. The immunocyteochemistry and Western blot were used to detect the expression of NF-κB P65 after irradiation in various times(1,3,6,10,24,48 h).The apoptosis rates under different radiotherapy dose were detected by flow cytometer and TDT-mediated dUTP-biotin nick end labeling(TUNEL).Results Compared with the control group,cytoplasm expression of P65 under different X-ray doses had statistically significant differences(P<0.05).While the cytoplasm P65 protein expression at different time were compared each other,the 3 h group demonstrated significant difference(P<0.05).Apoptosis rates in various groups,compared with control group,had statistically significant differences(P<0.05). While the groups at different time points were compared each other,the apoptosis rates of 3 h group had significant differences(P<0.05).ConclusionX-ray can activate the NF-κB P65 in oral squmaous cell carcinoma cell lines.The correlation between expressional quantity of P65 and radiotherapy induced apoptosis of oral squamous cell carcinoma cell lines possesses positive correlation.The activated and intranuclear P65 may have radiotherapy resistant effect.
P65; oral squamous cell carcinoma;cell apoptosis
R 739.8
A
10.3969/j.issn.1000-1182.2011.03.025
1000-1182(2011)03-0318-05
2010-02-17;
2011-03-18
山东省科技攻关基金资助项目(2006GG20002046)
马利(1983—),男,山东人,硕士
张东升,Tel:0531-85186950
