低温蛋白质氨化复合菌系对沼气酸化液pH及产甲烷活性的影响
2011-03-07王玥婷徐凤花赵忠宝郭建全
王玥婷,徐凤花,李 金,赵忠宝,郭建全
(东北农业大学资源与环境学院,哈尔滨 150030)
在沼气发酵时,普遍存在易酸化、不产气或产气率低等问题[6],需将酸化液调至6.8~7.5范围内,产甲烷菌才能很好的生长与产气。目前主要通过添加石灰、KHCO3类物质调节酸化液的pH,如果一口8 m3沼气池需要1.5~2.5 kg,不仅增加了成本,而且对产甲烷菌产生一定的抑制作用。黑龙江省年低温期长达5~6个月,低温影响氨化细菌的增殖,使氨化效率明显下降。因此,在酸化液中加入低温蛋白质氨化复合菌系,加快含氮有机物转化为氨态氮的速度,在调节pH的同时还为产甲烷菌提供了生长所需要的氨态氮,促进了低温产甲烷菌复合系增殖,使沼气启动时间提前,并为甲烷的形成提供了CO2前提物质[1-5]。本试验主要对低温蛋白质氨化复合菌系对沼气酸化液pH及产甲烷活性的影响进行研究。然而目前,国内外对低温蛋白质氨化复合菌系的报道甚少,因此,低温蛋白质氨化复合菌系的研究为沼气发酵提供了重要的理论依据。
1 材料与方法
1.1 材料
1.1.1 材料来源
自然发酵酸化液:新鲜牛粪∶水=1∶1,30℃培养箱内自然发酵而成。
KHCO3调试的酸化液:由东北农业大学工程学院提供。
1.1.2 菌群来源
本实验室选育效果良好的低温蛋白质氨化复合菌系和低温产甲烷复合菌系。
1.2 试验设计
1.2.1 酸氮含量化液氨态及pH变化的研究
本试验设2个处理组和1个对照组,每组3次重复。
处理1:自然发酵的酸化液加入KHCO3。
处理2:自然发酵的酸化液加入本实验室选育效果良好的低温蛋白质氨化复合菌系。
对照:自然发酵酸化液。
1.2.2 产甲烷活性的研究
本试验设2个处理组和1个对照组,每组3次重复,将实验室选育的低温产甲烷复合菌系接入3组酸化液中,接菌时酸化液的pH均为6.89。
处理1′:处理1加入低温产甲烷复合菌系。
处理2′:处理2加入低温产甲烷复合菌系。
对照′:对照加入低温产甲烷复合菌系。
1.3 测定方法
1.3.1 酸化液氨态氮含量及pH的测定
将3组酸化液置于(14±0.5)℃下培养,每2 d用蒸馏滴定法(GB/T3595-2000)测定氨态氮的含量,用玻璃电极法(PHS-25)测定酸化液pH的变化[6]。
1.3.2 产甲烷活性的测定
将3组酸化液置于(14±0.5)℃下培养30 d,每5 d测定产气量和甲烷含量。用排水法测定产气量,再根据每5 d产气量累积计算30 d的总产气量(mL);采用岛津14C气相色谱测定甲烷含量[7-8]。
2 结果与分析
2.1 低温蛋白质氨化复合菌系对酸化液氨态氮含量的影响
由图1可以看出,3组酸化液氨态氮均呈现先升高后降低的趋势,发酵前期由于低温蛋白质氨化复合菌系快速分解酸化液中的含氮有机物,使处理2的氨态氮含量迅速增加,且一直高于处理1和CK。5 d时达到高峰,高峰期较处理1和CK提前2 d,氨态氮含量为400.20 mg·L-1,较处理1和CK提高了34.08%和28.12%。发酵后期,由于含氮有机物减少,氨态氮含量下降,但处理2下降速度缓慢。处理1在整个发酵过程中氨态氮的含量均最低,且发酵后期氨态氮迅速下降,说明KHCO3对微生物的活性有一定的抑制作用,含氮有机物分解速度缓慢,为产甲烷菌提供的可利用氨态氮量减少。
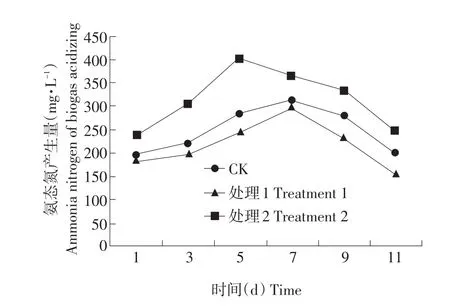
图1 低温蛋白质氨化复合菌系对酸化液中氨态氮含量的影响Fig.1 Effects of ammonia nitrogen of biogas acidizing fluid on low-temperature protein ammoniation composite strains
2.2 低温蛋白质氨化复合菌系对酸化液pH的影响
一般非产甲烷微生物对酸碱度的适应范围较广,而产甲烷菌只有在pH 6.8~7.5的环境中才能正常生长代谢[9]。从图2可以看出,由于低温蛋白质氨化复合菌系加快含氮有机物转化成氨态氮速度,使处理2的pH迅速升高,5 d时达到沼气发酵适宜的pH范围,7 d时pH稳定在7.00左右。而CK的pH上升缓慢,8 d时才达到沼气发酵适宜的pH范围。处理1中微生物分解含氮有机物产生的氨态氮量少因而pH变化不明显,一直稳定在初始的6.88左右。说明低温蛋白质氨化复合菌系可加快调节酸化液pH的速度,缩短达到适宜时间。

图2 低温蛋白质氨化复合菌系对酸化液pH的影响Fig.2 Effects of pH of biogas acidizing fluid on low-temperature protein ammoniation composite strains
2.3 低温蛋白质氨化复合菌系对产甲烷活性的影响
2.3.1 产气量的变化动态
在厌氧消化过程中,非产甲烷菌和产甲烷菌之间相互依赖,互为对方创造与维持生命活动所需要的良好环境条件,但它们之间又互相制约,在发酵过程中处于平衡状态[10]。
由图3可见,由于低温蛋白质氨化复合菌系在调节pH的同时,还为产甲烷菌提供生长所需要的氨态氮,使处理2′的产气量在整个发酵过程有明显增高。15 d时处理2′的产气量为80mL,达到产气高峰,较处理1′和CK′提高了45.45%和77.78%。处理1′20 d时达到产气高峰,较处理2′晚5 d,产气量为65mL,而处理2′的产气量虽较高峰时略有下降,但仍较处理1′和CK′提高了10.29%和50.00%。CK′25 d才达到产气高峰,较处理2′晚10 d,且产气量仅50mL。在整个发酵周期中处理2′的总产气量为 292mL,处理 1′为 221mL,而 CK′仅为 204mL,处理2′的总产气量较处理1′和CK′分别提高了32.13%和43.14%。由此说明低温蛋白质氨化复合菌系可提高产甲烷菌的活性,使发酵过程中的产气量增加。

图3 3组酸化液产气量的变化动态Fig.3 Dynamic change of the biogas production in three groups of different processing acidification liquid
2.3.2 甲烷含量的变化动态
从表1看出,由于处理2′中的低温蛋白质氨化复合菌系分解酸化液中的含氮有机物,为产甲烷复合菌系提供了生长所需的氨态氮,提高了产甲烷菌的活性,促进甲烷生成,从而使处理2′甲烷含量在发酵各阶段均最高,20 d高峰时较处理1′和CK′提高10.27%和24.08%。综合图4~6看出,20 d时处理2′的CO2含量也较处理1′和CK′提高7.13%和14.29%,说明低温蛋白质氨化复合菌系在分解含氮有机物的同时,还释放CO2为甲烷形成提供前体物质,使甲烷含量提高。
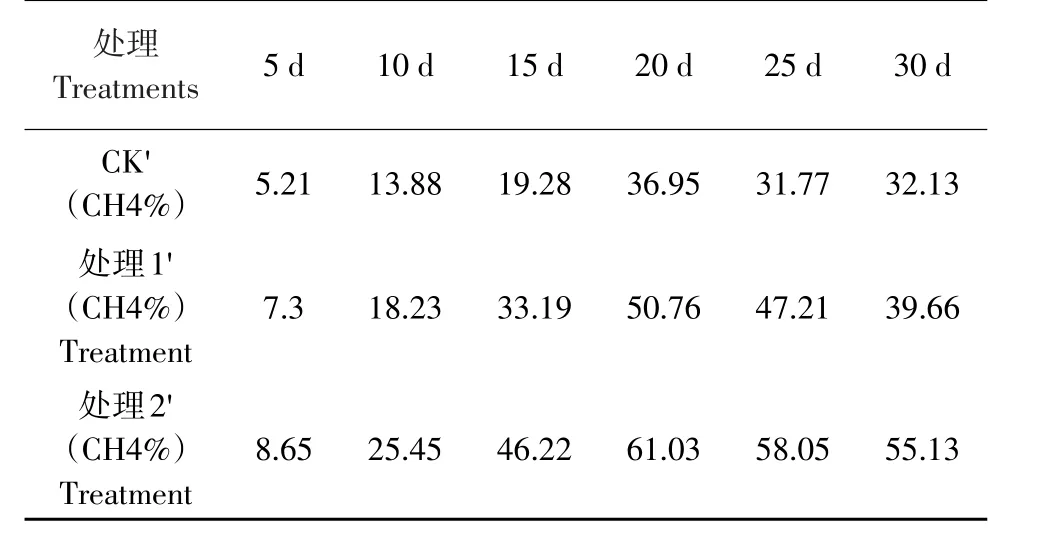
表1 3组酸化液发酵过程中甲烷含量的变化Table1 Change of methane content in three groups of different processing acidification liquid through fermentation process

图4 CK′的甲烷及CO2含量(20 d)Fig.4 The methane and CO2content of CK′(20 d)

图5 处理1′的甲烷及CO2含量(20 d)Fig.5 The methane and CO2content of the first processing acidification liquid(20 d)

图6 处理2′的甲烷及CO2含量(20 d)Fig.6 The methane and CO2content of the second processing acidification liquid(20 d)
3 讨论
低温蛋白质氨化复合菌系在沼气发酵过程中即可调节酸化液的pH,又可为产甲烷菌提供生长所需要的氨态氮,使沼气启动时间提前,并为甲烷的形成提供了CO2前提物质,具有着很高的实际应用价值。
低温蛋白质氨化复合菌系主要针对北方的特殊低温环境进行研究,低温会影响到氨化细菌的增殖,使氨化效率明显下降,从而导致沼气池产气率低或者不产气。因此,低温蛋白质氨化复合菌系的研究可有效地弥补北方气候的不足,具有可观的经济价值。
沼气发酵中不同微生物组成的菌群对提高产气率的影响差异较大,本试验只对酸化液中接入的低温蛋白质氨化复合菌系和低温产甲烷菌复合系进行了研究,而酸化液中还存在着纤维素分解菌,产酸菌等多种有益微生物,需进一步对低温氨化细菌、低温产甲烷菌复合系与其他微生物的协同作用进行深入研究。
4 结论
本试验主要对低温蛋白质氨化复合菌系对3组不同处理酸化液的pH及产甲烷活性的影响进行研究。可以得出,接低温蛋白质氨化复合菌系的酸化液中氨态氮含量高峰时较KHCO3调试的酸化液和自然发酵酸化液提前2 d,且高峰时氨态氮含量分别提高了34.08%和28.12%,pH也在5 d时达到沼气发酵适宜的pH范围,7 d时pH变化稳定。接低温产甲烷菌复合系后,可以明显看出,接低温蛋白质氨化复合菌系的酸化液的产气量为最高,15 d达到产气高峰时产气量较KHCO3调试的酸化液和自然发酵酸化液提高了45.45%和77.78%,总产气量提高了32.13%和43.14%。;同时CO2和甲烷含量也分别提高7.13%、14.29%和10.27%、24.08%。由此可见,低温氨化细菌在沼气发酵过程中具有重要的理论意义和实际应用价值。
[1]袁长波.微生物菌剂促进秸秆发酵产沼气试验研究[J].中国沼气,2009,27(增):15-16.
[2]王永泽.pH值对水稻秸秆厌氧发酵产沼气的影响[J].安徽农业科学,2009,31:37.
[3]林聪.沼气技术理论与工程[M].北京:化学工业出版社,2007.
[4]张全国.沼气技术及其应用[M].北京:化学工业出版社,2005.
[5]汪婷,何健,赵子如,等.牛粪沼气发酵过程中物质转化、微生物生理群变化及产甲烷多样性研究[C].沼气产生化发展研讨会论文选编,2005.
[6]李金,徐凤花,王胡婷,等.厌氧蛋白质氨化细菌筛选及对酸化液pH的影响[J].东北农业大学学报,2009,40(6):45-49.
[7]曾胤新,蔡明宏,俞勇,等.低温微生物及其酶类的研究概况[J].微生物学杂志,2004(5):83-88.
[8]Jill,Yitai Liu,mark Delwiehe,et al.Isolation of a methanogen from deepmarine sediments that contain methane hydrates,and description of Methanoeulleus submarinus sp.nov[J].Applied and Environmental Microbiology,2003,69(6):3311-3316.
[9]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002.
[10]刘金鑫,孙国朝.沼气发酵微生物代谢的相互关联初探:沼气新技术应用研究[M].成都:四川科学技术出版社,1988.
