经皮球囊血管成形术与肾动脉支架术治疗肾动脉狭窄的疗效对比观察
2011-02-27田玉龙,张曦彤,徐克
肾动脉狭窄(renal artery stenosis,RAS)是指肾动脉管腔狭窄≥50%[1],其常见原因为动脉粥样硬化、纤维肌性结构不良和大动脉炎。Grüntzig等于 1978年首次报道成功以经皮穿刺肾动脉腔内成形术治疗肾动脉狭窄。此后,介入治疗逐渐成为治疗肾动脉狭窄的常规治疗方法[2]。本研究旨在通过观察中国医科大学附属第一医院放射科 2005-01~2010-02收治的112例采用经皮球囊血管成形术(percutaneous transluminal balloon angioplasty,PTBA)或肾动脉支架术治疗的肾动脉狭窄患者的疗效,比较两种介入治疗方法在治疗肾动脉狭窄中的疗效。
1 资料和方法
1.1 一般资料 2005-01~2010-02中国医科大学附属第一医院放射科收治112例肾动脉狭窄患者,肾动脉管腔狭窄均≥50%,均经肾血管造影确诊并符合美国介入放射学学会(Society of Interventional Radiology)制订的《成人肾动脉狭窄诊断和治疗中血管造影术、血管成形术和支架置入术质量提高指南》[1]中的诊断标准。①入选标准:本研究经医院医学伦理委员会批准,入选标准为:单侧或双侧严重肾动脉狭窄,药物难以控制的高血压及近期快速肾功能减退者。剔除原发性高血压病、原发肾疾病及有糖尿病病史者。②基本情况:所有患者术前签署知情同意书。其中,男性40例,女性72例;年龄19~72岁,平均42.6±3.9岁;病变累及左侧肾动脉46例,右侧肾动脉57例,双侧肾动脉9例,共累及121支肾动脉。③病因:动脉粥样硬化62例,静止期多发性大动脉炎28例,肌纤维结构不良22例。术前血压为(150~270)/(90~160)mmHg;术前血肌酐为67~215µmol/L,其中78例肾功能正常,27例肾功能轻度受损,7例肾功能严重受损。④实验分组:112例患者根据病因及病变累及随机分为2组:A组,经皮球囊血管成形术组;B组,肾动脉支架术组。每组56例,2组患者经统计学比较具有可比性(P>0.05)。
1.2 方法
1.2.1 经皮球囊血管成形术(A组) 术前患者口服氯吡格雷75mg,每天2次,连服5~7d;行肾动脉造影术,以明确肾动脉狭窄的部位和程度。以8F导引管插至狭窄开口处,推入100µg硝酸甘油后,送入0.035in导丝开通狭窄段的肾动脉,经导引管推入造影剂以清楚地显示病变。然后行PTBA治疗,沿导丝送入血管球囊(巴德公司生产),球囊直径为 4~6mm,长度为20mm。工作气压为4~8个大气压。
1.2.2 肾动脉支架术(B组) 患者术前治疗及肾动脉造影术同经皮球囊血管成形术。释放Palmaz支架(盖丹特公司生产,工作气压为8~10个大气压)前先用导引管沿导丝预扩狭窄的肾动脉段,然后再将支架送至狭窄部位,退出导引管,再次经导引管推入造影剂,确认支架的位置后释放支架。支架直径为5~7mm,长度为12~18mm。
两组术后均常规给予抗凝治疗,给予低分子肝素钙100~200U/kg,1/12h,2/d,皮下注射,连续3~5d后改为口服阿司匹林100mg/d,连续3~6个月。
1.3 观察指标 所有患者术后6个月随访血压、血肌酐及肾动脉超声结果。记录患者的血压、血肌酐水平,首次手术成功率、并发症发生率、通畅率及术后即刻再狭窄率。采用肾动态显像测定总肾小球滤过率(TGFR)、左肾小球滤过率(LGFR)和右肾小球滤过率(RGFR),比较术前和术后的分侧肾功能。
1.4 疗效评价
1.4.1 技术成功标准[3]①被治疗血管无血栓、无明显夹层、残余狭窄<30%,血流通畅。②病变两端压力<20mmHg。③没有操作相关的严重血管并发症。
1.4.2 肾血管性高血压临床疗效判断标准[4]①治愈:术后不用药,舒张压<90mmHg。②改善:术后维持或减量用药,舒张压<90mmHg或至少降低15%。③无变化:术后未达到临床治愈或改善标准。
1.4.3 肾功能评价标准[5,6]①血肌酐,肾功能改善的判断指标。肾功能改善:血肌酐降至正常水平或较术前降低 20%以上;肾功能恶化:血肌酐增加 20%以上;肾功能稳定:血肌酐介于改善与恶化之间。②肾小球滤过率(GFR)反映肾功能损害程度的指标。肾功能轻度受损:GFR 25~35m l/m in;中度受损:GFR 15~25m l/m in;重度受损:GFR<15m l/min。
2 结果
2.1 两组患者首次手术成功率、并发症发生率、通畅率及术后即刻再狭窄率情况比较 表1示B组首次手术成功率和术后肾动脉通畅率均高于 A组,两组差异有统计学意义(P<0.01);术后肾动脉再狭窄率B组低于A组,两组差异有统计学意义(P<0.01)。术后并发症A组中,2例肾周血肿,1例肾动脉破裂导致后腹膜血肿,1例术后出现肾动脉衰竭;B组中,1例术中发生支架脱落,2例肾功能衰竭;两组并发症发生率相似,差异无统计学意义(P>0.05)。
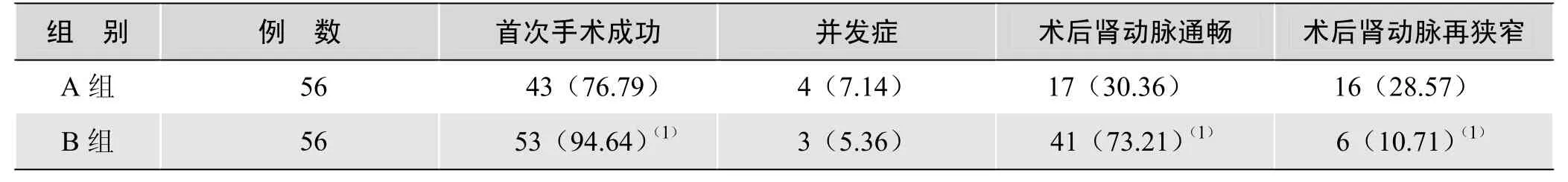
表1 两组患者手术首次成功、并发症、术后肾动脉通畅及再狭窄情况比较[n(%)]
2.2 两组患者术后血压情况 术后 6个月随访,A组肾血管性高血压治愈6例(10.71%);B组高血压治愈15例(26.79%)。两组高血压治愈率比较(表2),差异有统计学意义(P<0.01)。3种病因中,A组肌纤维结构不良所致肾血管性高血压的治愈率为5.36%,高于动脉粥样硬化及静止期多发性大动脉炎所致高血压的治愈率(分别为 3.57%、1.79%;P<0.01)。而B组动脉粥样硬化所致高血压的治愈率为16.07%,均高于静止期多发性大动脉炎及肌纤维结构不良所致高血压的治愈率(分别为3.57%、7.14%;P<0.01)。
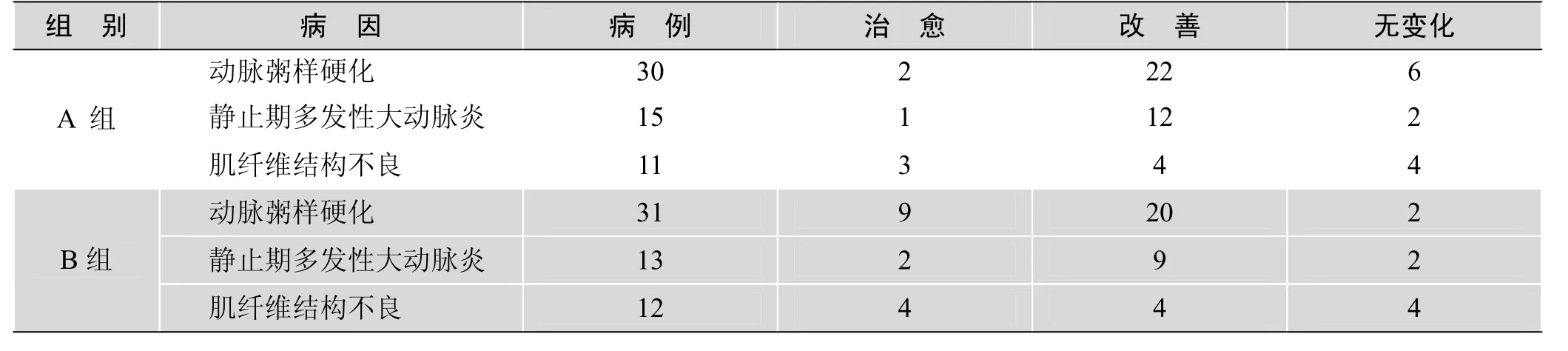
表2 两组患者术后血压获益情况与肾动脉狭窄病因的关系(n)
2.3 两组患者术后肾功能变化 A组术后6个月平均血肌酐水平较术前显著降低,差异有统计学意义(t=2.3130,P<0.05);B 组术后血肌酐较术前降低不明显(t=1.7962,P>0.05)。肾动脉支架术组肾功能改善率较经皮球囊血管成形术组低,肾功能恶化率较经皮球囊血管成形术组高,两组差异有统计学意义(t=2.1583,P<0.05)。A组术后TGFR、RGFR及B组术后 TGFR均较术前显著改善(t=2.6004,P<0.05);A组术后TGFR改善更明显,与B组比较,差异有统计学意义(t=2.5793,P<0.05)见表3。
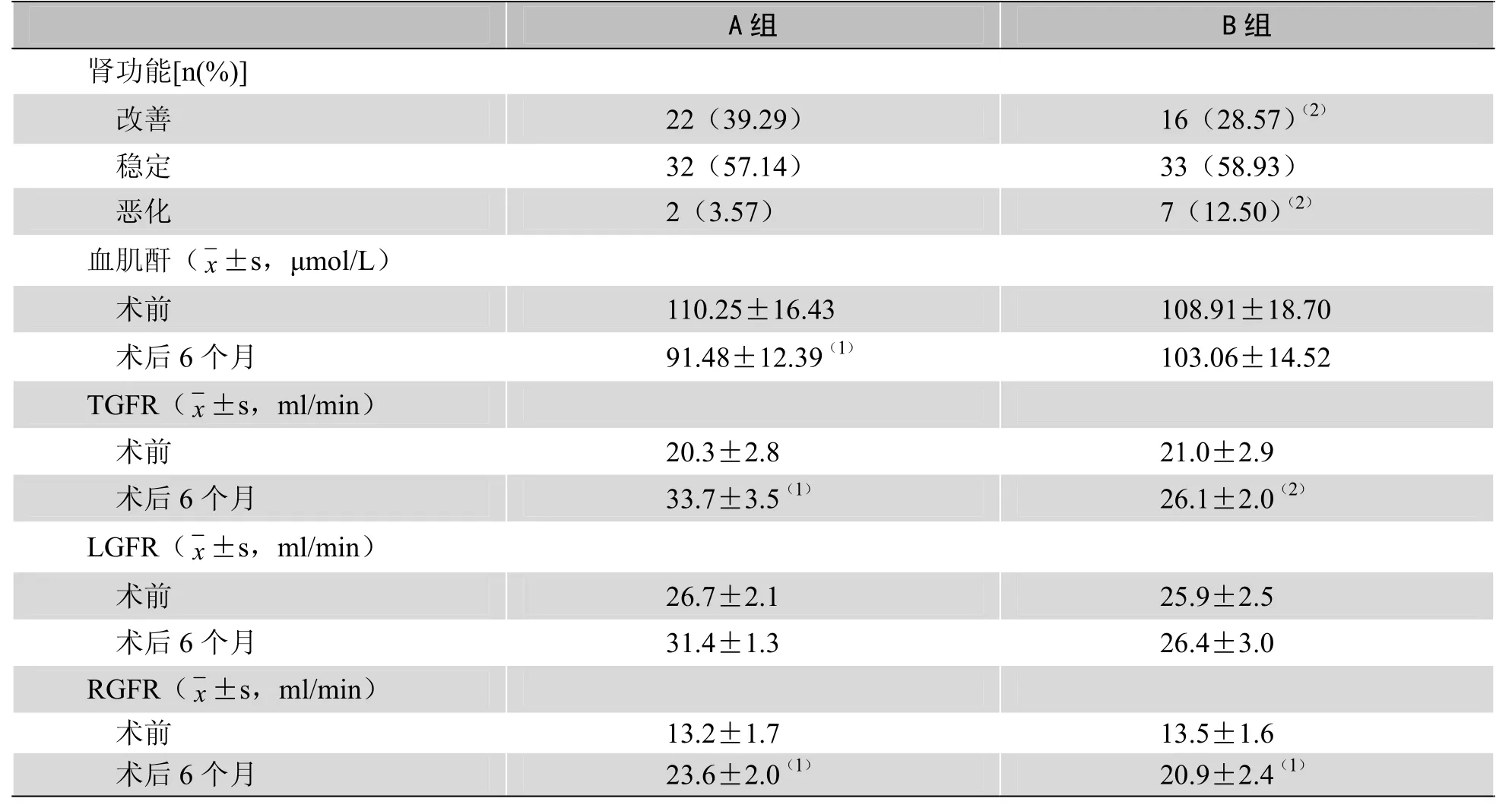
表3 两组患者术后肾功能变化情况
3 讨论
肾动脉狭窄引起的肾缺血可导致肾血管性高血压和慢性缺血性肾病,而肾血管性高血压是最常见的继发性高血压,占高血压的5%~10%,药物治疗常难以控制。而肾动脉狭窄的传统手术治疗创伤较大,术后并发症发生率及病死率较高。随着近年介入治疗的发展,其在治疗肾动脉狭窄方面的优势越加明显。20世纪90年代初,经皮球囊血管成形术逐渐成为治疗肾动脉狭窄的首选方法,其在肌纤维发育不良及动脉粥样硬化肾动脉狭窄患者中的应用效果较好,但再狭窄率较高[7]。
近来研究显示,支架置入术治疗肾动脉狭窄的再狭窄率显著低于经皮球囊血管成形术(14%对48%),并在其他方面显示出较经皮球囊血管成形术更明显的优势[8]。本研究结果显示,肾动脉支架术组成功率和通畅率均高于经皮球囊血管成形术组(P<0.01),与van Jaarsveld等[7]的报道结果基本一致;而两组再狭窄率(10.71%对 28.57%)均低于 Malacrida等[8]报道的再狭窄率,但肾动脉支架术组的再狭窄率更低(P<0.01)。术后6个月随访结果显示,肾动脉支架术组的高血压治愈率较经皮球囊血管成形术组高(P<0.01),经皮球囊血管成形术对肌纤维结构不良所致肾血管性高血压的改善情况最好,而肾动脉支架术对动脉粥样硬化所致高血压的改善情况最好。这与刘亚民等[10]的研究结果一致,分析其可能的原因为动脉粥样硬化所致肾动脉狭窄引起的肾病是缓慢发生的过程,肾动脉局部血运的重建不能改变肾小动脉的广泛硬化,而且引起动脉粥样硬化的其他因素也可造成肾的损害;肌纤维结构不良引起的肾动脉狭窄主要累及肾动脉主干,对肾单位的影响较小。
研究显示,血肌酐的基线水平是肾功能改善的独立预测因素[11]。本组研究显示,肾动脉支架术组肾功能改善率较经皮球囊血管成形术组低(28.57%对 39.29%,P<0.05),与 Leertouwer等[12]的结果(30%对 38%)基本一致;其肾功能恶化率较经皮球囊血管成形术组高,分析可能与血栓形成和造影剂对肾功能的损害有关。经皮球囊血管成形术组术后 6个月平均血肌酐水平较术前显著降低(P<0.05),肾动脉支架术组术后血肌酐降低不明显(P>0.05)。经皮球囊血管成形术组术后TGFR、RGFR及肾动脉支架术组术后TGFR均较术前显著改善(P<0.05),而经皮球囊血管成形术组术后TGFR改善更明显,与肾动脉支架术组比较,差异有统计学意义(P<0.05),与刘静等[6]的研究结果基本一致。尽管介入治疗有改善肾功能的潜在可能,然而其对于保护肾功能或阻止肾功能恶化尚无定论,其与肾功能的长期预后有待进一步研究。
综上所述,肾动脉支架术较经皮球囊血管成形术在治疗肾动脉狭窄上显示出较大的优势,其操作成功率、通畅率及再狭窄率均优于后者,对动脉粥样硬化引起的肾动脉狭窄所致高血压改善明显,但肾功能改善率较低,且存在恶化的潜在可能。故临床上应适当结合肾动脉狭窄的病因,选择恰当的介入治疗方法。
[1] 颜红兵, 王嘉莉, 焦媛. 美国成人肾动脉狭窄诊断和介入治疗指南解读. 中国介入心脏病学杂志, 2003, 11(6): 326-327.
[2] Dorros G, Jaff M, Mathiak L, et al. Multicenter Palmaz Stent renal artery stenosis revascularization registry report: Four-year follow up of 1058 successful patients. Catheter Cardiovasc Interv, 2002, 55(2): 182-188.
[3] 邹英华. 重新认识肾动脉狭窄的发生与发展, 规范肾动脉狭窄的介入治疗. 介入放射学杂志, 2007, 16(7): 433-435.
[4] Rundback JH, Sacks D, Kent KC, et al. Guidelines for the reporting of renal artery revascularization in clinical trials. Circulation, 2002, 106(12): 1572-1585.
[5] 李茂全. 临床血管治疗学. 北京:中国协和医科大学出版社. 2005. 65.
[6] 刘静, 张曦彤. 肾动脉狭窄介入治疗中期疗效评价. 介入放射学, 2009, 18(6): 433-436.
[7] Mann SJ, Pecker MS, August P, et al. The effect of balloon angioplasty on hypertension in atherosclerotic renal-artery stenosis. N Engl J Med, 2000, 343(6): 438-439.
[8] Malacrida G, Dalainas L, Massimo M. Endovascular treatment of a renal artery branch aneurysm.Cardiovasc Intervent Radiol, 2007, 30(11): 118-120.
[9] ASTRAL Investigators, Wheatley K, Ives N, et al. Revascularization versus medical therapy for renal-artery stenosis. N Eng J Med, 2009, 361(20): 1953-1961.
[10] 刘亚民, 吕良山, 田红燕, 等. 肾动脉狭窄的介入治疗.中国医学影像学杂志, 2004, 12(4): 262-265.
[11] Zeller T, Frank U, Müller C, et al. Predictors of improved renal function after percutaneous stent-supported angioplasty of severe atherosclerotic ostial renal artery stenosis. Circulation, 2003, 108(18): 2244-2249.
[12] Leertouwer TC, Gussenhoven EJ, Bosch JL, et al. Stent placement for renal arterial stenosis: where do we stand? A meta-analysis. Radiology, 2000, 216(1): 78-85.
