航天特因环境下抑郁模型大鼠行为学食物及糖水消耗量变化
2011-02-24刘军莲李勇枝白桂娥薛春美
刘军莲,李勇枝,白桂娥,王 静,薛春美
(中国航天员科研训练中心,北京海淀 100094)
在航天飞行过程中,航天员面临特殊而又复杂的航天环境,其中有运载工具和航天器带来的超重、失重、噪声、振动、冲击和曲线加速度所造成的影响,有来自航天器内外环境因素的影响,如舱内狭小环境、大气压力、有害气体、辐射、流星、陨石等,所有这些因素都可单一地、综合地、间接或直接地对人体的身心两方面造成影响。这些都会不同程度的增加航天员的精神负担,影响其身心健康,另一方面,长期停留在太空、单调、重复的工作也会使航天员感到抑郁。出现疲乏虚弱、懒言少动、心悸健忘、失眠多梦、胸闷不舒、不思饮食、体重减轻等郁证的表现。
航天过程中,郁证一旦发生不仅直接影响航天员的健康,甚至影响航天飞行任务的完成。随着我国载人航天事业的不断发展,人类在太空停留时间不断延长,航天郁证的防治将成为航天医学专家高度关注的问题,因此开展航天郁证的相关研究势在必行。本研究旨在通过航天特因环境所致的抑郁大鼠模型行为学变化,食物消耗量及糖水消耗量的变化研究该航天郁证模型,为将来进一步研究航天特因环境下郁证的病理机制奠定动物试验方面的基础。
1 材料与方法
1.1 动物及分组 动物模型,动物为成年SD雄性大鼠,体重180~200 g(购自北京维通利华实验动物技术有限公司),适应性喂养 1周,首先用 Open Field法作行为学评分,按照得分将30只大鼠平均分成对照组和模型组,每组15只,模型组每笼饲养1只,对照组共养。模型组共接受28 d各种不同的刺激,对照组不进行任何处理。
1.2 方法
1.2.1 抑郁模型的建立 其中包括禁水(24 h),禁食(24 h),摇晃(1次/s,5 min),噪声(1 h),昼夜颠倒,尾吊等刺激。平均每种刺激各进行3次,同种刺激不连续出现防止动物适应刺激影响试验结果。
1.2.2 动物行为学评定 在造模前对所有大鼠进行第1次旷场行为测试(Open Field test)。模型组给予连续28 d不可预见性刺激后,对两组大鼠进行第2次旷场行为学测试。旷场为箱底80 cm×80 cm的正方形,并被等分25个等边方格;箱壁为黑色,高40 cm,试验在下午安静时间进行,将大鼠放在中心方格内,观察大鼠跨过方格的次数(3只脚同时进入为准)及后肢直立次数(两前爪直立及攀附箱壁为准)。
1.2.3 食物消耗量测定 在早晨规定时间给每只老鼠放入预先称好的动物饲料,第二天同一时刻称量剩余饲料,计算每只动物24 h的食物消耗量,食物消耗量以24 h的摄入量/动物体重来评定。
1%蔗糖溶液消耗测定:采用1%蔗糖溶液供动物饮用,在测定前禁水、禁食24 h,测定动物24 h饮用1%蔗糖溶液的量。消耗量以24 h摄入1%蔗糖溶液的量/动物体重进行评定。
1.2.4 统计学处理 用SPSS 13.0统计软件进行分析处理,数据以±S表示。
2 结果
2.1 航天特因环境下郁证模型组与空白组行为学变化比较 见表1。
表1 航天特因条件下郁证模型组与空白组旷场试验变化情况 (±S,次数/60s)

表1 航天特因条件下郁证模型组与空白组旷场试验变化情况 (±S,次数/60s)
注:与空白组比较,***:P<0.001,差异极显著;*:P<0.05,差异显著,下表同
穿行格数分组 N直立次数 理毛次数试验前 试验后 试验前 试验后 试验前 试验后空白组 15 64.076±26.83 72±29.57 13.73±5.00 17.0±6.12 17.66±4.33 10.91±7.77模型组 15 61.300±33.48 5.83±2.91*** 12.86±5.90 6.5±3.70*** 15.12±7.05 17.93±9.72
行为学旷场试验测试结果显示,大鼠造模后,旷场试验中的穿行格数和直立次数发生了显著统计学意义上的减少,中央格停留时间,理毛次数及粪便粒数未发生统计学意义上的变化。
2.2 航天特因环境下郁证模型组与空白组体重、糖水及食物消耗量变化 见表2、表3。
表2 航天特因条件下郁证模型组与空白组体重变化情况 (±S,g)

表2 航天特因条件下郁证模型组与空白组体重变化情况 (±S,g)
分组 N 试验前 第1周 第2周 第3周 第4周空白组 15 187.27±6.85 272.50±15.60 305.61±23.88 331.78±30.01 354.51±36.78模型组 15 188.67±6.74 215.50±11.19*** 260.86±15.34*** 275.24±21.19*** 303.65±20.12***
结果显示,在尾吊的最初两天内体重没有任何变化,但是随着时间的延长,模型组大鼠的体重比同期正常组大鼠的体重发生了显著性变化。
表3 航天特因条件下郁证模型组与空白组糖水及食物消耗量变化情况 (±S,%)
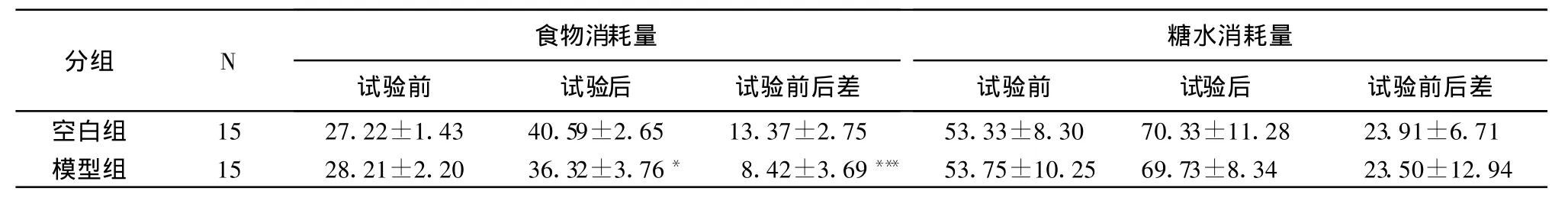
表3 航天特因条件下郁证模型组与空白组糖水及食物消耗量变化情况 (±S,%)
食物消耗量分组 N糖水消耗量试验前 试验后 试验前后差 试验前 试验后 试验前后差空白组 15 27.22±1.43 40.59±2.65 13.37±2.75 53.33±8.30 70.33±11.28 23.91±6.71模型组 15 28.21±2.20 36.32±3.76* 8.42±3.69*** 53.75±10.25 69.73±8.34 23.50±12.94
食物消耗量分析结果发现,试验后郁证模型组与空白组比较食物消耗量降低,而分析前后消耗量比较出现显著性差异,而糖水消耗量未发现具有统计学意义的差异。
3 讨论
现代社会竞争日趋激烈,抑郁症已成为现代人常见的精神疾病之一,在中医属于“郁证”。作为一种包含了身体和心理异常的疾病已经越来越受到人们的关注,对于抑郁的研究也成为目前研究的热点,到目前为止,已有20多种方法可以用作抑郁动物模型的制备,大致分为应激模型、神经生化功能改变模型、转基因动物模型、孤养结合模型等,分别从生物学、遗传学、社会心理学等各角度来模拟抑郁症的表现[1]。抑郁模型根据活动性测试中的水平运动和垂直活动来反映模型大鼠运动减少,兴趣减低;糖水消耗量降低反映抑郁大鼠的快感削弱。这些是研究抑郁模型常用的行为学测试指标。
根据郁证的临床特点,结合航天特因环境的特点,综合应激和分养两种经典模型,利用长期不可预见性的中等强度应激,造成分养动物的抑郁状态。根据行为学测试结果发现郁证模型大鼠造模后,旷场试验中的穿行格数和直立次数发生了显著性减少,中央格停留时间,理毛次数及粪便粒数未发生统计学意义上的变化,由此可以推断郁证模型基本上是成功的。
慢性轻度不可预见性的应激抑郁模型(CUMS)能够模拟人类抑郁的核心症状即快感缺乏,不同程度地表现出情感活动异常,如易怒、焦虑、淡漠等[2-3],CUMS基本符合抑郁模型的要求,是目前国内外文献中广泛使用的模型[4-5]。
在长期应激后,抑郁模型大鼠的水平得分和垂直得分降低,说明应激使得大鼠的活动能力和探究能力降低了说明应激对大鼠的活动能力、探究能力和焦虑程度造成了影响[6]。
中等强度不可预见的应激刺激结合孤养诱导的抑郁大鼠模型模拟了抑郁症病人的部分发病原因与临床症状,同样被广泛用于抑郁机制研究。在造模过程中发现,模型大鼠处于明显的抑郁状态,大鼠明显自主活动减少,且发现抑郁模型大鼠在造模后变得激惹、攻击行为增强。本试验动物模型造模后的行为学变化符合抑郁模型成功的评判标准[7-8]。因此,从行为学的角度证明了抑郁模型的成功。
糖水摄入量,即大鼠对糖水的偏嗜程度,可以反映大鼠对食物的欣快感,这一试验反映了奖赏系统在抑郁症中的作用。一般研究认为糖水消耗试验测试了动物对奖赏的反应性,应激后动物对奖赏的反应性下降,称之为快感缺失。有很多研究发现应激后大鼠的1%蔗糖水消耗量和1%蔗糖水偏爱百分比均下降,出现了快感缺失,并以此作为大鼠抑郁症模型建立的标志之一[9]。本试验测量糖水消耗,结果发现应激后抑郁大鼠液体消耗量两组差异没有显著性,不能说是对快感体验的缺乏,分析原因可能与体质量相关[10]。这种对奖赏的反应性没有明显的差异结果与国外部分报道基本一致[11]。
食物奖赏属于天然奖赏成分的一种,各种天然的奖赏性刺激都是通过各自的传入通路,激活中脑边缘DA系统而实现的[12]。有学者认为边缘系统DA含量的改变是应激引起快感缺失的原因[13]。抑郁状态下奖赏系统功能受损与脑内DA含量降低可能有密切关系。
本试验4周后,大鼠糖水消耗量没有发生明显的改变,分析原因可能与造模时间长短及刺激量有关,或者是因为航天特因条件下郁证模型大鼠的应激过程可能与普通郁证模型不同,在这种条件下,大鼠本身处在一种应激状态,由糖水消耗量表现出的快感并没有出现;而对食物的消耗量发生了改变,通过本试验研究可以为航天员载人飞行过程中的营养供给提供借鉴,有针对性的给与能够提高航天员情绪,增加飞行过程的兴趣感,更好地完成飞行任务。
试验1周模型大鼠的体重增长幅度与空白组比较明显降低。模型组自身比较发现第3周体重增长幅度较低,随后体重又开始增加,这种状态的出现可能与适应失重环境有关,在模拟失重开始的1周内体重增长幅度远远低于空白组;一旦适应失重环境,体重又呈现梯度升高的趋势,仍然是处在一种低于空白组水平。通过本试验研究失重状态下体重的增长规律,有可能为航天实践提供营养学参考。
[1] 丁凤敏,胡永年,王平,等.柴芩温胆汤对慢性应激抑郁模型小鼠行为学的影响[J].中国行为医学科学,2006,15(10):880-882.
[2] Suda T,Nakano Y,Tozaw a F,et al.The role of coai-cotropinreleasing factor and vasopressin in hypoglycemia-induced proopiomelanocortin gene ex pression in the rat an terior pituitary gland[J].Brain Res,1992,579:303.
[3] Davis M.Animalmodels of anxiety based on c lassical conditioning:the conditioned emotional response(CER)and the fearpoten tiated startle effect[J].Pharmacol Ther,1990,47:147.
[4] Pariante G M,Miller A H.G lu cocorticoid receptors in major dep ression relevance to pathophysiology and treamen t[J].Biol Psychiatry,2001,49:391-404.
[5] 王哲,胡随瑜,宋炜熙.白松片对慢性应激抑郁模型大鼠行为学及血浆CORT、ACTH的影响[J].中国行为医学科学,2004,13(12):185-187.
[6] 徐治,李娜,赵兴蓉,等.长期应激对大鼠免疫指标的影响[J].中国行为医学科学,2007,16(10):871-874.
[7] Willner P.Animal models as stimulations of dep ression.T rends in Pharmacological sciences[M].Elsevier Science Publishers Ltd,1991:131.
[8] Redei E E,Ahmadiyeh N,Baum A E,eta l.Novel animalm odels of affective disorders[J].Sem in Clin Neuropsy chiatry,2001,6(1):43-67.
[9] Willner P.Validity,reliability and utility of the chronic m ild stressm odel of depression:a 10 year review and evaluation[J].Psychopharm aco1ogy,1997,134:319-329.
[10]SousaN,Lukoyanoc N V,Madeira MD,et a l.Reorganization of them orphology of hlp pocam pal neu rites and synapses after stress-induced damage cor relates w ith behavioral im provement[J].Neu roscience,2000,97:253-266.
[11]Angela M,Gouirand,LeslieMatuszew ich.The effectsof ch ronic unp re.dictable stress on m ale rats in the w ater maze[J].Physiology Behavior,2005,86:21-31.
[12]Spanagel R,W eiss F.The dopam inehypothesisof rew ard:past and current status[J].T rends Neu rosci,1999,22(11):521-527.
[13]Willner P,Muscat R,Papp M.Ch ronicmild stress-induced anhedonia:a realistic animal model of dep ression[J].Neurosci Biobehay Rev,1992,16(4):525-534.
