银杏叶提取物对慢性阻塞性肺疾病模型大鼠ET-1、TGF-β1的影响
2011-02-13辽宁医学院附属第一医院呼吸内科锦州市121001
刘 忠(辽宁医学院附属第一医院呼吸内科,锦州市 121001)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)的患病率和死亡率不仅在我国而且在全球范围内均呈上升趋势。其中肺动脉高压是COPD最常见的并发症,也是临床防治的难点之一,其发病机制与低氧、炎症、内皮损伤等多种因素有关。近年来,银杏叶提取物(Ginkgo biloba extract,EGb)已应用于呼吸系统疾病的治疗,取得了一定的疗效,EGb可以在一定程度上减轻气道的炎症和改善气道的重构[1]。本研究选择熏吸香烟加气管内注射脂多糖(Lipopolysaccharicle,LPS)法[2]复制COPD大鼠模型,应用光镜、电镜观察COPD模型大鼠肺组织形态学变化,并测定EGb治疗前后大鼠支气管肺泡灌洗液(BALF)中内皮素-1(ET-1)和转化生长因子-β1(TGF-β1)水平变化、气道炎症细胞数量变化,以探讨EGb对COPD模型大鼠气道炎症是否具有抑制作用,为临床应用EGb治疗COPD提供理论依据。
1 仪器与材料
1.1 仪器
800型离心沉淀机(上海手术器械十厂);Ⅲ型超薄切片机(瑞典LKB公司);JEM-1200EX型透射电子显微镜(日本电子公司);BX40型光学显微镜(日本Olympus公司);CIAS-1000型细胞图象分析系统(北京大恒图象视觉有限公司);7170A型全自动生化分析仪(日本日立公司)。
1.2 试药
香烟为烤烟型无滤嘴大前门牌(上海卷烟厂,焦油量:15 mg,烟气烟碱量:1.1 mg);LPS(美国Sigma公司);酶联免疫(ELISA)试剂盒和放射免疫试剂盒(天津九鼎医学生物工程有限公司);EGb(北京双鹤高科天然药物有限责任公司,批号:20100712)。
1.3 动物
健康SD大鼠48只,鼠龄4~8周,体重(210±20)g,♀♂兼用,由辽宁医学院实验动物中心提供(动物生产合格证号:SCXK(辽)2003-2007)。
2 方法
2.1 复制模型和分组、给药
实验分为3组,即正常对照(将大鼠于第1、14天气管内注入0.9%生理盐水0.2 mL,第8天起每天ig 0.9%生理盐水0.05 mL·kg-1)、COPD模型[将大鼠于第1、14天气管内注入LPS 200 μL(1 μg·μL-1),第2~13、5~28天在自制吸烟染毒箱(70 cm×50 cm×50 cm,右上方带有1.5 cm×1.5 cm通气孔)内熏香烟2次/d,吸烟量为14支/次,其中每次吸烟时间1 h,2次间隔为1 h;第8天起每天ig 0.9%生理盐水0.05 mL·kg-1,至第28天处死]和EGb(气管内注入LPS和熏香烟过程同COPD模型组,第8天起每天ig EGb 200 mg·kg-1,至第28天处死)组。
2.2 BALF的采集
将大鼠用2%的戊巴比妥(25 mg·kg-1)麻醉后仰卧固定于操作台,切开胸部,暴露出气管和双肺,结扎右主支气管,在隆突上用套管针穿刺至左肺,缓慢注入无菌生理盐水3 mL,每次注入后立即回吸得到BALF,重复3次。灌洗液以纱布过滤,回收率为60%~70%。吸取1 mL BALF置于血细胞计数器上,计数白细胞总数和分类。余BALF于4℃、1 500 r·min-1离心10 min,取其上清液置入离心管,-20℃贮藏,备用。
2.3 ET-1、TGF-β1的检测
应用ET-1、TGF-β1检测试剂盒,按说明书用放射免疫法检测BALF中ET-1水平,用ELISA法测定BALF中TGF-β1的浓度。
2.4 病理标本制备和形态定量分析
取每只大鼠的隆突上2~3 mm处的气管和中叶肺组织5 mm3,10%福尔马林固定,酒精梯度脱水,浸蜡,包埋,切片,HE染色,光镜观察。将经过4%戊二醛固定的1 mm3右肺组织漂洗,用2%四氧化锇固定,丙酮梯度脱水,包埋,聚合;切片,醋酸铀-枸橼酸铅电子染色,透射电镜观察。每张切片均选取上、中、下、左和右5个视野,用高清晰度彩色病理图文报告分析软件对HE染色标本分别测量下列指标,测量时避开支气管和大、中血管:(1)肺平均内衬间隔(Mean lung internal lining interval,MLI):在高清晰度彩色病理图文报告分析软件上,以视野正中为中心划“+”字交叉线,计数通过该交叉线的肺泡间隔数(NS),测出“+”字线的总长度(L)为2.552×10-3m,以MLI=L/NS得到MLI,其数值反映肺泡平均直径。(2)平均肺泡数(Mean alveoli numbers,MAN):计数每个视野内的肺泡数(Na),测出每个视野的面积(S)为0.39×10-6m2,以MAN=Na/S计算各个视野的MAN,其数值反映肺泡密度。
2.5 统计学方法
3 结果
3.1 光镜观察
正常对照组大鼠肺组织气道黏膜上皮结构完整,纤毛排列整齐,管壁规整未见增厚,支气管黏膜下未见明显炎细胞浸润,管腔内未见渗出物,肺泡结构连续,肺泡壁完整,肺泡腔未见病理性扩大,肺间质血管未见充血;COPD模型组大鼠小支气管部分上皮脱落,支气管腔内可见黏液栓和大量炎细胞,管壁及其周围有明显炎细胞浸润,呼吸性细支气管破坏,管腔部分闭塞,肺泡壁变薄甚至破裂,肺泡腔不规则扩大,有的肺泡相互融合成肺大泡,肺小动脉平滑肌细胞增生;EGb组大鼠肺组织炎细胞浸润减少,支气管黏膜上皮纤毛脱落及肺泡壁变薄、断裂等损伤现象均较COPD模型组明显减轻。大鼠肺组织光镜下形态见图1。
3.2 电镜观察
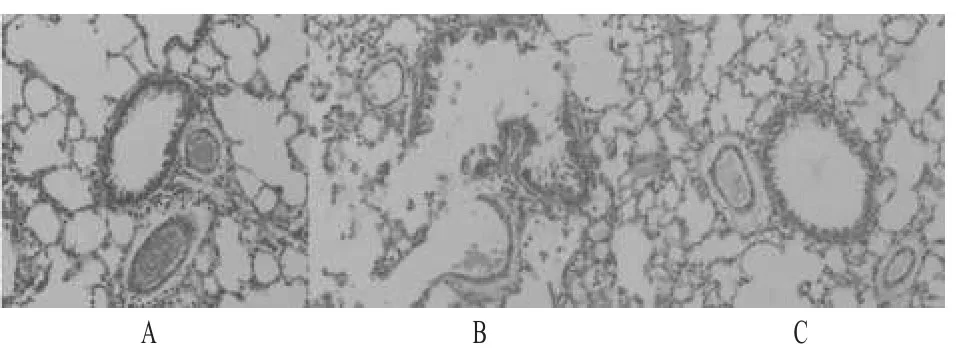
图1 大鼠肺组织光镜下形态(HE染色,40×)A.正常对照组;B.COPD模型组;C.EGb组Fig 1 Pulmonary morphology of rats in each group under light microscope(HE staining,40×)A.normal control group;B.COPD model group;C.EGb group
正常对照组大鼠气道、支气管黏膜上皮细胞纤毛排列整齐,无脱落,肺泡上皮细胞器结构正常,肺气血屏障结构完整,毛细血管内皮细胞无肿胀及空泡样变;COPD模型组大鼠Ⅰ型肺泡上皮细胞肿胀和脱落,杯状细胞分泌增加,Ⅱ型肺泡上皮细胞增生,板层小体排空,线粒体肿胀,呈空泡样变,内质网扩张,核固缩,表面纤毛减少脱落,肺泡腔内的巨噬细胞溶酶体增多;EGb组大鼠Ⅰ型肺泡上皮细胞肿胀、脱落和Ⅱ型肺泡上皮细胞线粒体肿胀、板层小体排空等损伤有所改善。大鼠肺组织电镜下形态见图2。

图2 大鼠肺组织电镜下形态(10 000×)A.正常对照组;B.COPD模型组;C.EGb组Fig 2 Pulmonary morphology of rats in each group under electron microscope(10 000×)A.normal control group;B.COPD model group;C.EGb group
3.3 肺组织形态学定量分析
与正常对照组比较,COPD模型组MLI显著升高,MAN显著降低(P<0.01);与COPD模型组比较,EGb组MLI显著降低,MAN显著升高(P<0.05)。大鼠肺组织形态学定量分析结果见表1。
表1 大鼠肺组织形态学定量分析结果(±s,n=16)Tab 1 Result of morphologic quatitative analysis of lung tissue in rat(s±s,n=16)

表1 大鼠肺组织形态学定量分析结果(±s,n=16)Tab 1 Result of morphologic quatitative analysis of lung tissue in rat(s±s,n=16)
与正常对照组比较:*P<0.01;与COPD模型组比较:#P<0.05vs.normal control group:*P<0.01;vs.COPD model group:#P<0.05
MAN/(×106个/m2)405.33±25.46 283.20±17.81*313.59±24.28#组别正常对照组COPD模型组EGb组MLI/(×106个/m2)51.24±8.37 91.67±16.81*77.96±9.81#
3.4 BALF细胞计数、分类计数和ET-1、TGF-β1水平的变化
与正常对照组比较,COPD模型组BALF中白细胞总数和中性粒细胞(PMN)数显著增加(P<0.01),ET-1、TGF-β1浓度显著升高(P<0.01);与COPD模型组比较,EGb组BALF中白细胞总数和PMN数显著下降(P<0.05),ET-1、TGF-β1浓度显著降低(P<0.05)。大鼠BALF中细胞总数、分类计数和ET-1、TGF-β1水平变化见表2。
表2 大鼠BALF中细胞总数、分类计数和ET-1、TGF-β1水平变化(±s,n=16)Tab 2 Result of the level of ET-1 and TGF-β1,the total counts and differential counting of WBC in BALF of rat(s±s,n=16)

表2 大鼠BALF中细胞总数、分类计数和ET-1、TGF-β1水平变化(±s,n=16)Tab 2 Result of the level of ET-1 and TGF-β1,the total counts and differential counting of WBC in BALF of rat(s±s,n=16)
与正常对照组比较:*P<0.01;与COPD模型组比较:#P<0.05vs.normal control group:*P<0.01;vs.COPD model group:#P<0.05
组别正常对照组COPD模型组EGb组TGF-β1/μg·L-1 1.62±0.46 5.66±0.35*3.25±0.69#细胞总数/(×108个/L)1.73±0.83 6.50±0.72*3.21±0.89#PMN数/(×108个/L)0.113±0.041 1.570±0.360*0.543±0.213#PMN/%6.09±2.95 24.95±5.99*17.19±5.49#ET-1/ng·L-1 66.7±10.55 129.33±12.67*104.69±10.82#
4 讨论
COPD是一组气流受限为特征的肺部疾病,气流受限不完全可逆,呈进行性发展,但可预防和治疗[3]。其发病机制尚未完全明了,目前普遍认为,COPD以气道、肺实质和肺血管的慢性炎症为特征,这种慢性气道炎症是由非常复杂的相互作用的细胞因子构成的网络调控的[4]。
本研究通过熏吸香烟加气管内注射LPS法复制COPD大鼠模型,结果显示,COPD模型组大鼠的气道、支气管有明显的慢性支气管炎特征性病理改变,肺组织出现局限性肺气肿,肺泡隔断裂、融合,周围纤维细胞增生。同时,图像分析系统提示,COPD模型组MLI较正常对照组增高,而MAN较正常对照组降低,两指标的差异显著,说明模型复制成功。
本研究表明,COPD模型组大鼠BALF中ET-1、TGF-β1的浓度、白细胞总数和PMN数均较正常对照组显著增高(P<0.01),提示COPD的气道炎症与支气管肺局部ET-1、TGF-β1的水平增高密切相关。ET-1是一种生物活性多肽,其在肺部有着广泛的生物学效应,不仅有收缩气管、支气管和血管平滑肌以及促平滑肌细胞、成纤维细胞增生作用,而且还有促进腺体分泌、炎性介质释放等多种作用。肺脏既是内皮素作用的靶器官,又是ET-1合成、分泌、代谢的主要场所。有研究表明,组织缺血、缺氧及酸中毒情况下,ET-l释放增多,且机体对其反应性增强,同时促使血管内皮强烈收缩[5]。TGF-β1是一种多功能细胞因子,能够诱导上皮细胞层破坏、气道炎症、平滑肌细胞增殖、杯状细胞增生以及促进血管重构等多种细胞反应[6]。TGF-β1主要由嗜酸粒细胞分泌,成纤维细胞、巨噬细胞、中性粒细胞等多种细胞均能分泌TGF-β1。在哮喘和COPD患者及急性、亚急性和慢性哮喘小鼠模型的上皮细胞和平滑肌细胞中均发现 TGF-β1的过度表达[7,8]。本文结果提示,COPD的气道炎症与支气管肺局部ET-1、TGF-β1的浓度呈显著正相关,可能ET-1释放增多致血管内皮细胞产生缺血性坏死,从而使血管内皮细胞本身释放TGF-β1增加,而TGF-β1能够通过促使杯状细胞增生,诱导释放ET-1导致血管重塑,促进气道平滑肌的增生肥大、迁移以及破坏上皮细胞层等多种途径参与气道重塑[9]。结果表明,ET-1、TGF-β1参与了COPD气道炎症反应和气道结构的重塑。
EGb是从银杏叶中提取的具有独特药理活性的化合物,主要化学成分有黄酮类、萜类、酚类等。研究报道,EGb具有清除自由基,改善血液流变学及保护血管内皮细胞,抗炎,阻止血小板、白细胞与内皮细胞的黏附等作用[10]。本研究利用EGb进行干预,以探讨其对COPD可能的预防保护作用。结果显示,EGb组大鼠病理学检查提示肺组织损伤较COPD模型组减轻。形态定量分析结果表明,EGb组MLI较COPD模型组降低,MAN较COPD模型组升高(P<0.05),说明EGb可以抑制肺泡融合等肺泡结构改变,对肺气肿结构的改建起到了一定的防治、缓解作用。同时研究结果表明,EGb组大鼠BALF中ET-1、TGF-β1浓度与白细胞总数、PMN数较COPD模型组下降(P<0.05),提示EGb还可以有效抑制腺泡内肺动脉血管壁炎细胞浸润、血管壁平滑肌细胞增生,抑制肺血管和气道结构的重塑。
由此可见,本研究中EGb对大鼠COPD气道重塑和肺血管重塑均有明显的抑制作用,笔者推测其作用机制可能与抑制气道、肺组织、肺血管的炎症反应有关,因为炎症贯穿COPD的整个发生发展过程。鉴于EGb的药理作用和COPD形成因素的复杂性,其确切的作用机制有待进一步深入研究。
[1] 王家珍,吴天清,周礼远.Egb761对哮喘模型大鼠MMP-9及TIMP-1表达的影响和对气道重构的干预研究[J].中国药房,2008,19(24):1 847.
[2] 宋一平,崔德健,茅培英.慢性阻塞性肺病大鼠模型的建立及药物干预的影响[J].中华内科杂志,2000,39(8):712.
[3] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8.
[4] Panzner P,Lafitte JJ,Tsicopoulos A,et al.Marked up-regulation of T lymphocytes and expression of interleukin-9 in bronchial biopsies from patients with chronic bronchitis with obstruction[J].J Chest,2003,124(10):1 909.
[5] Pullamsetti SS,Schermuly RT.Endothelin receptor antagonists in preclinical models of pulmonary hypertension[J].Eur J Clin Invest,2009,39(7):630.
[6] Makinde T,Murphy RF,Agrawal DK.The regulatory role of TGF—beta in airway remodeling in asthma[J].Immunol Cell Biol,2007,85(2):348.
[7] Takizawa H,Tanaka M,Takami K,et al.Increased expression of transforming growth factor—beta1 in small airway epithelium from tobacco smokers and patients with chronic obstructive pulmonary disease(COPD)[J].Am J Respir Crit Care Med,2001,163(9):1 476.
[8] Locke NR,Royce SG,Wainewright JS,et al.Comparison of airway remodeling in acute,subacute,and chronic models of allergic airways disease[J].Am J Respir Cell Mol Biol,2007,36(5):625.
[9] Tagaya E,Tamaoki J.Mechanisms of airway remodeling in asthma[J].Allergol Int,2007,56(2):331.
[10] 张 宏,孟亚娟,斯 琴,等.银杏叶提取物对脂多糖诱导大鼠急性肺损伤的保护作用[J].基础医学与临床,2002,22(1):155.
