注射用奥美拉唑钠与奥硝唑配伍稳定性的考察
2011-02-10段雪云冯汉鸽吴兵兵陈树和湖北省中医院药学部武汉43006华中科技大学同济医学院附属协和医院中西结合科武汉430022
段雪云,冯汉鸽,吴兵兵,陈树和,范 恒(.湖北省中医院药学部,武汉 43006;2.华中科技大学同济医学院附属协和医院中西结合科,武汉 430022)
奥美拉唑(omeprazole)是一种新型抗消化道溃疡药,能选择性地抑制胃壁细胞的H+-K+-ATP酶,从而有效地抑制胃酸分泌。由于H+-K+-ATP酶是壁细胞泌酸的最后过程,故其抑酸能力强大,目前临床上已广泛适用于治疗十二指肠溃疡、胃溃疡、反流性食管炎和Zollinger-Ellison综合征等。奥硝唑是继替硝唑后上市的第3代硝基咪唑类衍生物,是一种疗效更高、疗程更短、体内分布更广的强力抗厌氧菌及抗原虫感染药。在临床上,对于胃溃疡及出血且伴有严重感染的患者,为迅速制酸止痛、抗幽门螺杆菌控制症状,常常将奥美拉唑与奥硝唑联合应用,既能抗感染又减少并发症的发生。目前文献检索还未见注射用奥美拉唑钠和奥硝唑两药联合应用的实验性研究报道,本研究室在不同温度下不同时间内采用高效液相色谱法对2药混合液的含量进行测定,并根据《中华人民共和国药典》[1]方法对外观、pH进行考察,为临床应用提供参考。
1 仪器与试药
Waters 600高效液相色谱仪(美国 Waters公司,型号: Waters 600-2996,PDA二级管阵列检测器);精密pH计(瑞士梅特勒-托利多公司,型号:Delta 320-S);奥美拉唑对照品(中国药品生物制品检定所,批号:100367-200702);奥硝唑对照品(中国药品生物制品检定所,批号:100608-200301);注射用奥美拉唑钠(江苏奥赛康药业有限公司,批号:090919 42.6 mg/支,相当于奥美拉唑40 mg);奥硝唑氯化钠注射液(四川科伦药业股份有限公司,批号:C090802 B1,规格:100 mL∶0.5 g);水为重蒸水,乙睛为色谱纯,其他试剂为分析纯。
2 方法
2.1 波长的选择
用0.9%氯化钠溶液将精密称取的奥美拉唑和奥硝唑对照品制成浓度为 1.6 mg·mL-1的对照品溶液,在波长 190~400 nm内进行扫描,奥美拉唑的最大吸收波长为(301±1) nm,奥硝唑的最大吸收波长为(319±1)nm,故选择奥美拉唑钠的最大吸收301 nm波长作为测定波长(因奥硝唑含量较高,在301 nm处有也有较大吸收),见图1。

图1 奥美拉唑和奥硝唑的紫外吸收光谱图Fig 1 UV absorption spectrum of omeprazole and ornidazole1.奥美拉唑;2.奥硝唑1.omeprazole;2.ornidazole
2.2 色谱条件[2-4]
色谱柱Agilent HC-C18(4.6 mm×250 mm,5 μm);流动相:乙腈∶水(35∶65);流速1.0 mL·min-1;检测波长301 nm;柱温:25℃;进样量:10 μL;色谱图见图2。
2.3 线性关系考察
用0.9%氯化钠溶液溶解精密称取的奥美拉唑对照品,并制成浓度为1.6 mg·mL-1的对照品溶液(用0.1 mol·L-1NaOH调整pH),并稀释成系列溶液,按“2.2”色谱条件进样,以对照品的峰面积(Y)对浓度(X)进行线性回归,得回归方程: Y=2.34×107X-4.66×104,r=0.999 7(n=5),结果表明奥美拉唑在0.16~1.6 μg范围内线性关系良好。用0.9%氯化钠溶液溶解精密称取的奥硝唑对照品适量,制成浓度为1.6 mg·mL-1的对照品溶液,并稀释配成不同浓度的系列溶液,按“2.2”色谱条件进样,以对照品的峰面积(Y)对浓度(X)进行线性回归,得回归方程:Y=1.82×107X+6.18×104,r=0.999 9(n=5),结果表明奥硝唑在0.64~3.2 μg范围内线性关系良好。
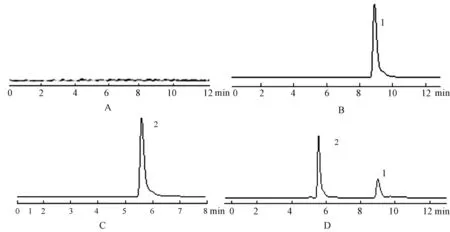
图2 奥美拉唑钠和奥硝唑的高效液相色谱图Fig 2 HPLC chromatograms of omeprazole sodium and ornidazoleA:0.9%氯化钠注射液;B:奥美拉唑对照品;C:奥硝唑对照品;D:奥美拉唑钠+奥硝唑;1.奥美拉唑钠;2.奥硝唑A.0.9%sodium chloride injection;B.omeprazole control;C.ornidazole control;D.omeprazole sodium plus ornidazole;1.omeprazole sodium;2.ornidazole
2.4 精密度试验
精密吸取 3个不同浓度奥美拉唑(0.032、0.096、0.128 mg·mL-1)的对照品溶液10 μL,同样取3个不同浓度奥硝唑(0.128、0.192、0.256 mg·mL-1)的对照品溶液10 μL,按“2.2”色谱条件在1 d内重复进样5次,测得奥美拉唑日内精密度RSD(n=5)分别为0.63%、1.04%、0.75%;奥硝唑日内精密度RSD(n=5)分别为0.85%、0.94%、1.22%;按“2.2”色谱条件在5 d之间重复进样5次,测得奥美拉唑日间精密度RSD(n=5)分别为0.98%、1.03%、1.21%;奥硝唑日间精密度RSD(n=5)分别为0.87%、0.68%、1.01%。
2.5 回收率试验
取奥美拉唑高、中、低3个不同浓度的对照品溶液分别加入0.5%奥硝唑氯化钠溶液中,配成不同浓度的混合液,按“2.2”项色谱条件进行测定,代入回归方程计算,回收率分别为95.32%、97.55%、98.21%,平均回收率为97.03%(n=9),RSD=1.22%;取奥硝唑高、中、低3个不同浓度的对照品溶液分别加入0.4 mg·mL-1奥美拉唑溶液中,配成不同浓度的混合液,按“2.2”项色谱条件进行测定,代入回归方程计算,回收率分别为 97.32%、99.26%、100.78%,平均回收率为 99.12% (n=9),RSD=1.54%。
2.6 配伍稳定性考察
模拟临床用药浓度,精密称取注射用奥美拉唑钠42.6 mg于100 mL量瓶中,加专用溶媒溶解后,用0.9%氯化钠溶液稀释成浓度为0.4 mg·mL-1的溶液(A溶液),另取0.5%奥硝唑氯化钠注射液100 mL(B溶液),将A、B溶液以(1∶1)混合,在避光条件下分别置于4、25、37℃环境中;并于混合后0、0.5、1、2、4、6 h根据《中华人民共和国药典》的方法测定pH值及外观变化和可见异物检查[5],采用HPLC法进行含量测定,计算不同时间的相对含量(以0 h含量为100%)。
3 结果
3.1 外观变化
在避光条件下,温度分别为4、25、37℃环境下6 h内,混合液均由无色或浅黄色澄明液体,逐渐变为深黄色乃至黄褐色,无异物产生。
3.2 pH值变化在不同温度和时间内,pH值发生一定变化,结果见表1。
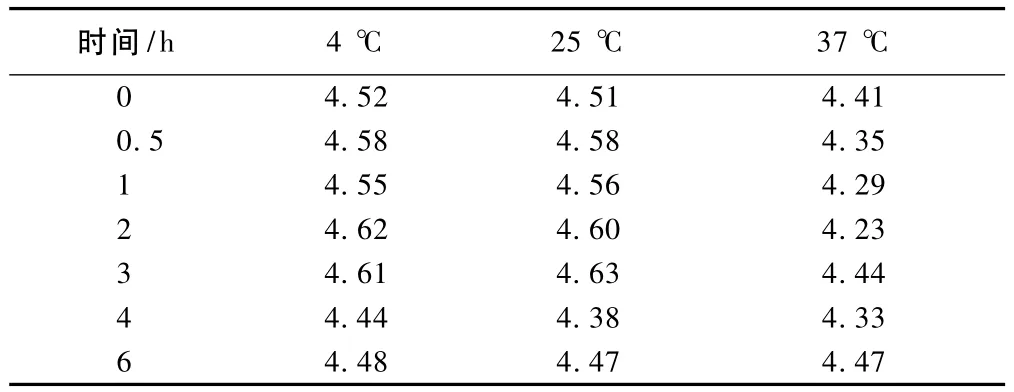
表1 配伍液在不同时间和温度的pH值Tab 1 pH values of admixture at different time point and different temperature
3.3 含量变化
在各温度条件下,不同时间内奥美拉唑钠和奥硝唑的相对含量结果,“-”表示含量过低无法计算,见表2。
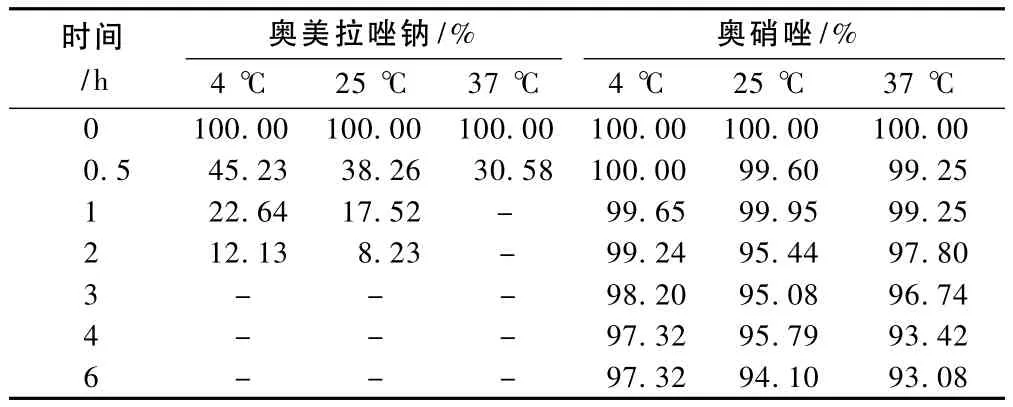
表2 配伍液在不同时间和温度的相对含量(%,n=5)Tab 2 Relative contents of the admixture at different time point and different temperature(%,n=5)
4 讨论
实验结果表明,在避光条件下,温度分别为4、25、37℃环境中6 h内配伍液中奥美拉唑钠和奥硝唑含量有明显变化,溶液pH值也有一定变化,色泽更是发生明显的变化。这是因为奥美拉唑是苯咪唑的衍生物,不溶于水,易溶于碱液,故将其注射剂制成钠盐;奥美拉唑钠的化学结构中具有亚磺酰基,在水溶液中不稳定,故制成冻干粉末制剂。其水溶液的稳定性易受pH值、光线、重金属离子、氧化剂等多种因素的影响,在碱性条件下比较稳定,在酸性条件下易分解,分解产物为砜化物和硫醚化物,出现变色、浑浊,甚至产生沉淀;而奥硝唑氯化钠注射液的pH<4,2药混合后,奥美拉唑钠溶液pH值由配伍前的碱性(pH=9.82)变为混合液的酸性,pH值发生明显变化,因此奥美拉唑钠在酸性条件下立即发生分解,出现变色现象。
2001年《健康报》有过关于《洛赛克为何变色》的报道,引起了人们对如何防止奥美拉唑(洛赛克)注射液变色失效问题的关注,现国内医院不断出现有关奥美拉唑注射液变色问题的报道。通过文献检索分析,发现奥美拉唑钠溶液在酸性条件下化学结构容易被破坏,引起溶液变色甚至聚合沉淀的发生,稳定性还受光线的影响,对重金属离子也特别敏感,以及受氧化性和还原性成分等多种因素的影响。文献检索和实验结果提示,在临床用药中,为了避免药液变色失效、减少不良反应发生,在静脉滴注过程中应注意避光,奥美拉唑钠注射液应单独使用,避免与奥硝唑在同组输液中配伍合用,联合应用时应及时更换输液器,或者是在2组药之间以0.9%氯化钠注射液冲管,温度高的环境更应注意。
[1] 国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录66.
[2] 陈 瑶.注射用加替沙星及左氧氟沙星与奥硝唑葡萄糖注射液配伍稳定性考察[J].中国医院用药评价与分析,2009,9(6):453.
[3] 王友新.HPLC法测定清胃胶囊中奥美拉唑和甲硝唑的含量[J].中国药师,2009,12(6).748.
[4] 陈昌彪,罗明芳.高效液相色谱法与紫外分光光度法测定注射用奥美拉唑钠的含量[J].医药导报,2007,26(6):668. (收稿日期:2010-12-27)
