基于逆转录病毒载体的外源基因表达系统的评价和应用
2011-02-09叶玲玲许建李世崇刘红刘兴茂王启伟陈昭烈
叶玲玲,许建,李世崇,刘红,刘兴茂,王启伟,陈昭烈
1 军事医学科学院生物工程研究所,北京 100071
2 中国医学科学院肿瘤医院肿瘤研究所,北京 100021
生物技术药物是 21世纪生物技术领域中引人关注的研究和产业热点。目前,采用哺乳动物细胞表达系统生产重组蛋白药物已经成为生物制药产业的主流,其市场份额已超过全球生物技术药物销售额的 2/3[1-2]。在以哺乳动物细胞为生产系统的重组蛋白药物的生产中,获得高效、稳定表达外源目的蛋白的细胞系是其中至关重要的环节[3-4]。
逆转录病毒表达系统通常由包膜蛋白载体、逆转录病毒载体和包装细胞系组成。逆转录病毒载体携带的外源目的基因整合到宿主细胞时,具有倾向发生于染色体开放区和转录活跃位点的明显特点[5-6]。这一基因整合特性能有效地将外源目的基因整合入靶细胞基因组并使之稳定高效地表达。同时,由于逆转录病毒可以与多种细胞表面蛋白结合而进入细胞,其宿主细胞范围很广,具有感染终末分化细胞的能力,使其成为基因治疗研究、RNA干扰和基因功能研究中广泛采用的基因转移载体[7-9]。
2005年,Bleck采用逆转录病毒表达系统构建了抗体表达水平达到1.6 g/L的CHO细胞系[10]。这一结果提示逆转录病毒表达系统有望成为构建高效、稳定表达外源蛋白的工程细胞系的新的技术途径。基于此,本研究以增强型绿色荧光蛋白(Enhanced green fluorescent protein,EGFP) 基因的表达水平和稳定性为指标,考察逆转录病毒表达载体pQCXIN介导的外源基因在HEK293细胞和CHO-K1细胞的表达效率,并采用 pQCXIN载体构建了高效表达人重组活性蛋白 C (Recombinant human activated protein C,rhAPC) 的HEK293细胞系。
1 材料与方法
1.1 细胞和质粒
HEK293细胞和质粒 pcDNA3.1(+)、大肠杆菌DH5α均购自美国Invitrogen公司;CHO-K1细胞购自美国ATCC;逆转录病毒表达载体pQCXIN、包膜蛋白载体pVSV-G和病毒包装细胞GP2-293均购自美国 Clontech公司;质粒 pcDNA3.1/EGFP和pcDNA3.1/rhPC由本实验室构建。
1.2 试剂和培养基
限制性内切酶及DNA连接酶购自美国NEB公司;DNA Marker、质粒提取试剂盒和DNA纯化回收试剂盒购自美国 Qiagen公司;转染试剂LipofectamineTM2000购自美国 Invitrogen公司;G418购自德国Merck公司;DMEM/F12培养基和胎牛血清购自美国HyClone公司;蛋白C标准品和蛋白C兔多克隆抗体购自美国Sigma公司;HRP标记山羊抗兔IgG购自上海莱博生物公司。
1.3 携带外源基因的pQCXIN逆转录病毒表达载体的构建
EGFP cDNA和 rhAPC cDNA分别从质粒pcDNA3.1/EGFP和 pcDNA3.1/rhPC中经 AgeⅠ/ PacⅠ双酶切、琼脂糖凝胶电泳分离、胶回收纯化,双粘端连入逆转录病毒表达载体 pQCXIN,构建携带EGFP基因的逆转录病毒表达载体pQCXIN/EGFP和携带 rhAPC基因的逆转录病毒表达载体pQCXIN/rhAPC。
1.4 携带外源基因的重组逆转录病毒的制备和滴定
GP2-293细胞在含10%胎牛血清的DMEM/F12培养基中,37 ℃、5% CO2贴壁生长于75 cm2培养瓶中,当细胞的汇合度达到 90%时,分别用pQCXIN/EGFP和 pVSV-G、pQCXIN/rhPC 和pVSV-G进行双质粒共转染。二质粒摩尔比为1∶1,总量20 µg,转染后5 h后更换新鲜的含10%胎牛血清DMEM/F12培养基,48 h后收获细胞培养上清。细胞培养上清经0.45 µm滤膜滤器过滤除去细胞碎片后,50 000×g、4 ℃超速离心1.5 h,倒掉上清,按100倍浓缩加入含10%胎牛血清DMEM/F12培养基悬浮沉淀,−70 ℃超低温冷柜保存。病毒滴定参照文献进行,并将病毒滴度定义为 GTU/mL (Gene transfer unit per ml)[11]。浓缩后的病毒滴度为1×107~2×107GTU/mL。
1.5 HEK293细胞和CHO-K1细胞的转染及筛选
1.5.1 阳离子脂质体介导的细胞转染
参照 LipofectamineTM2000说明书,转染前1天分别将HEK293细胞和CHO-K1细胞以7.5×105细胞/孔接种6孔板,37 ℃,5% CO2培养至细胞形成 80%~90%的汇合细胞层,转染前更换不含血清的 DMEM/F12培养基。取 10 µg质粒pcDNA3.1/EGFP或 pcDNA3.1/rhPC用不含血清的DMEM/F12培养基稀释至 250 µL;用无血清DMEM/F12培养基稀释10 µL LipofectamineTM2000至250 µL。将上述两种液体移入同一EP管中混匀,室温避光放置20 min后分别加入对应的6孔板中摇匀,37 ℃、5% CO2培养6 h后补加含10%胎牛血清DMEM/F12培养基继续培养24 h。
1.5.2 重组逆转录病毒的细胞感染
重组逆转录病毒感染前1天分别将HEK293细胞和CHO-K1细胞以7.5×105细胞/孔接种6孔板,37 ℃、5% CO2培养至细胞形成80%~90%的汇合细胞层,感染前更换含1%胎牛血清的DMEM/F12培养基。取200 µL逆转录病毒pQCXIN/EGFP或 pQCXIN/rhAPC分别加入对应的6孔板中摇匀,37 ℃、5% CO2培养 6 h后更换含 10%胎牛血清DMEM/F12培养基继续培养24 h。
1.5.3 转染阳性细胞的筛选和单克隆化
转染24 h后,用0.25% (W/V) 胰蛋白酶消化HEK293细胞并将各孔细胞分别接种至 24孔板,4~5 h细胞贴壁后,培养基换为含0.6 g/L G418和10%胎牛血清的DMEM/F12培养基。3~4 d换液1次。直到2周后阳性克隆长出。胰酶消化,扩大培养,用于外源基因表达强度分析;或采用有限稀释法将细胞接种于 96孔板克隆生长、筛选 rhAPC高效表达HEK293细胞系。
1.6 测定和分析方法
采用 Cedex AS20细胞密度和活力自动分析系统 (Innovatis,Germany) 计数活细胞密度。采用流式细胞仪 (BD FACSCalibur,USA) 分析质粒转染细胞和病毒感染细胞 EGFP的相对荧光强度(Relative fluorescence intensity,RFI),每个检测样品的细胞总数设定为30 000。转染阳性细胞的rhAPC表达水平分析参照文献采用ELISA法进行[12]。
2 结果与分析
2.1 pQCXIN逆转录病毒表达载体的构建和鉴定
选用 AgeⅠ和 PacⅠ位点作为EGFP cDNA和rhAPC cDNA的克隆位点,分别将EGFP cDNA和rhAPC cDNA连入pQCXIN中,正确质粒结构如图1A、1B所示,命名为 pQCXIN/EGFP和 pQCXIN/ rhAPC。所构建的表达载体经 AgeⅠ、PacⅠ酶切鉴定,分别出现与预期一致、长度约为700 bp和1 300 bp的片段 (图2)。该结果经进一步的测序分析得到证实。
2.2 逆转录病毒表达载体介导的EGFP表达效率
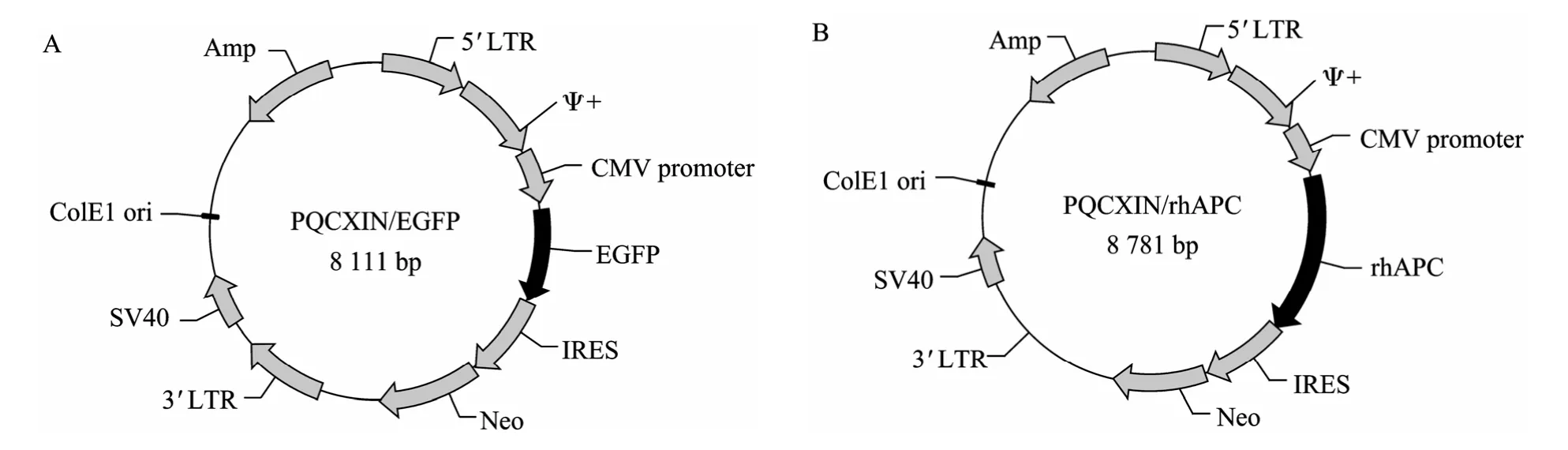
图1 pQCXIN逆转录病毒表达载体的结构示意图Fig. 1 Diagrams of recombinant retroviral vectors. (A) pQCXIN/EGFP retroviral vector. (B) pQCXIN/rhAPC retroviral vector.
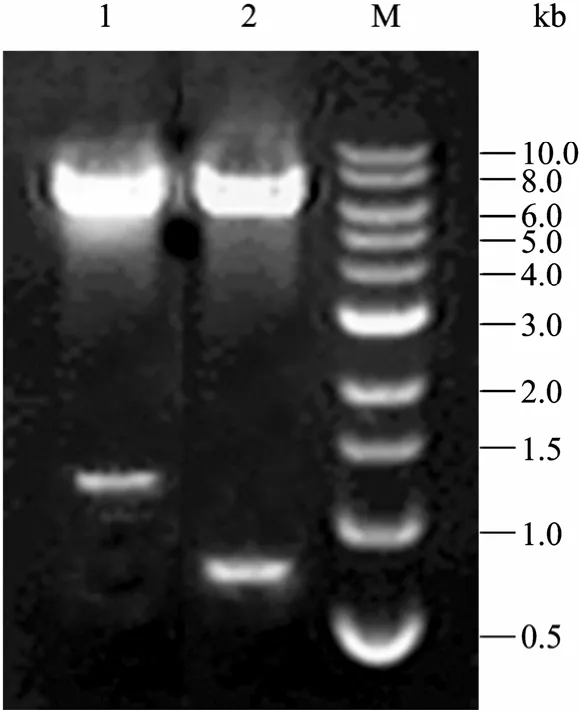
图2 pQCXIN逆转录病毒表达载体的酶切鉴定Fig. 2 Identification of recombinant retroviral vectors by enzyme digestion. 1: pQCXIN/rhAPC retroviral vector digested with Age I and Pac I; 2: pQCXIN/EGFP retroviral vector digested with Age I and Pac I; M: DNA marker.
分别用pcDNA3.1/EGFP质粒转染的HEK293细胞和CHO-K1细胞,以及用经由pQCXIN/EGFP和pVSV-G共转染GP2-293细胞制备的携带EGFP基因的重组逆转录病毒分别感染的 HEK293细胞和CHO-K1细胞,经过400 mg/L G418加压筛选2周,收集细胞进行流式分析,考察逆转录病毒表达载体介导的EGFP表达效果。HEK293细胞经质粒转染或病毒感染后,EGFP表达阳性细胞比例基本相同,约占细胞总数的 80%左右 (图 3A、B);病毒感染CHO-K1的 EGFP表达阳性细胞比例则明显高于质粒转染的 CHO-K1细胞 (图 3C、D)。定量分析EGFP表达阳性细胞的相对荧光强度,病毒感染HEK293细胞和CHO-K1细胞的RFI均约为对应质粒转染细胞的2倍 (图3E)。
2.3 逆转录病毒表达载体反复感染HEK293细胞的EGFP表达
将经由 pQCXIN/EGFP和 pVSV-G共转染GP2-293细胞制备的携带 EGFP基因的重组逆转录病毒一次感染后的HEK293细胞的RFI值设定为1,并据此考察逆转录病毒表达载体多轮反复感染HEK293细胞的EGFP表达。图4为HEK293细胞经 2~4轮逆转录病毒表达载体反复感染后流式细胞分析的RFI相对值。RFI的相对值随逆转录病毒表达载体感染次数的增加而升高,4轮病毒感染HEK293细胞的RFI值较1次病毒感染HEK293细胞的RFI值约提高2倍 (图4)。结果提示,多轮反复感染逆转录病毒表达载体能通过增加HEK293细胞中EGFP基因的拷贝数提高EGFP的表达效率。
2.4 逆转录病毒表达载体介导的 EGFP表达稳定性
表1为质粒转染或逆转录病毒表达载体感染的HEK293细胞在撤除 G418筛选压力后连续传代过程中的RFI值变化。经过6次连续传代,质粒转染HEK293细胞的RFI值由290.47降至88.89,下降幅度为 69.4%;经过 1到 4轮病毒感染 HEK293细胞的RFI值的下降幅度分别为44.5%、22.4%、37.5%和 21.5%。结果提示,逆转录病毒表达载体介导的外源基因表达的稳定性优于质粒转染的外源基因表达。
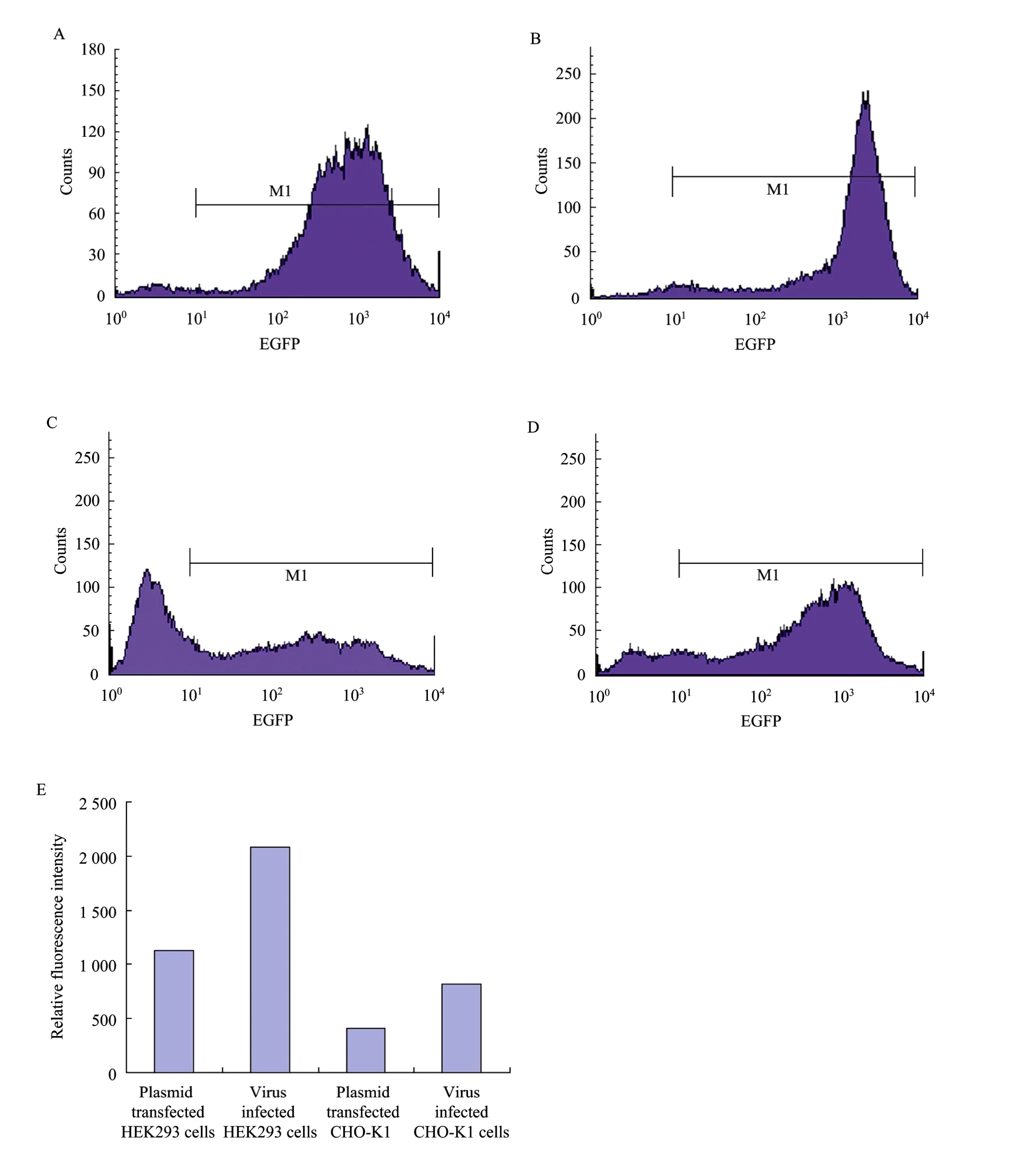
图3 质粒转染或病毒感染介导的EGFP在HEK293细胞和CHO-K1细胞表达的流式细胞分析Fig. 3 Analysis the effect of EGFP expression in both HEK293 and CHO-K1 cells via plasmid transfection or virus infection. (A) Plasmid transfected HEK293 cells. (B) Virus infected HEK293 cells. (C) Plasmid transfected CHO-K1 cells. (D) Virus infected CHO-K1 cells. (E) RFI in both HEK293 and CHO-K1 cells via plasmid transfection or virus infection. Results are expressed as the mean value of duplicate samples from different experiment. EGFP: enhanced green fluorescent protein.

图4 HEK293细胞经多轮反复逆转录病毒载体感染的EGFP表达情况Fig. 4 EGFP expression of the HEK293 cells with repeated virus infection. Results are expressed as the mean value of duplicate samples from different experiment.
2.5 逆转录病毒表达载体介导的rhAPC高效表达
分别用经由pQCXIN/rhAPC和pVSV-G共转染GP2-293细胞制备的携带rhAPC基因的重组逆转录病毒感染 HEK293细胞和 pcDNA3.1/rhAPC质粒转染HEK293细胞。经过400 mg/L G418加压筛选2周,病毒感染和质粒转染HEK293细胞的rhAPC表达水平分别为326.4 ng/(106cells·d) 和8.6 ng/(106cells·d),逆转录病毒载体介导的rhAPC效率明显高于质粒转染介导的rhAPC表达 (表2)。在96孔板采用有限稀释法对病毒感染HEK293细胞进行克隆并经ELISA筛选,获得了3株rhAPC表达水平为10~15 µg/(106cells·d) 的HEK293细胞系。
3 讨论
HEK293细胞为来源于人胚胎的转化细胞系,其不仅体外培养性状良好,且不存在啮齿类病毒感染的潜在威胁。此外,HEK293细胞具有CHO细胞缺乏的γ-羧基化修饰和有效水解原肽以及表达完全人型塘基化的重组蛋白的能力。HEK293细胞的上述优点使其成为日益受到重视的生物技术药物生产系统,采用HEK293细胞生产的重组蛋白药物和重组腺病毒载体也已分别获得FDA和SFDA的批准上市[3]。

表1 质粒转染或病毒感染的HEK293细胞在连续传代过程中的RFI值变化Table 1 Change of RFI of both plasmid transfected and virus infected HEK293 cells during continuous passage
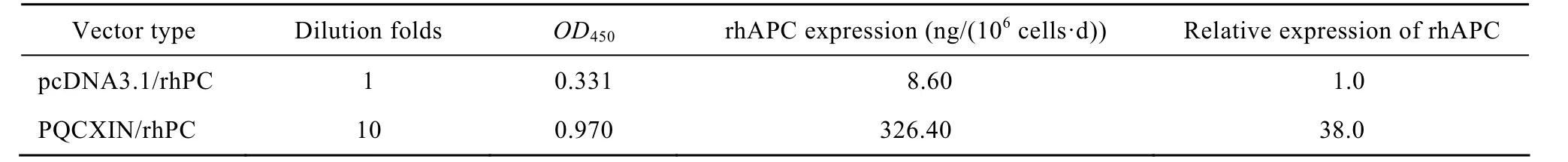
表2 ELISA检测病毒感染和质粒转染的HEK293细胞的rhAPC表达水平Table 2 rhAPC expression in HEK293 cells infected by retrovirus or transfected by recombinant plasmid by ELISA
哺乳动物细胞的基因组非常庞大,其中包含为数众多的外源基因整合位点,如CHO细胞基因组中大概有15 000个整合位点,但其中能使外源基因高效表达的转录活跃位点为数不多,大约只有15个位点[13]。通常的质粒转染等方法只能将外源目的基因随机整合到宿主细胞基因组内,因此,即使经过大量的筛选,获得高效表达外源目的基因的细胞系的几率仍非常低。
逆转录病毒载体携带的外源目的基因整合到宿主细胞时,整合位点通常位于DNase I高敏感性区域内的染色体开放区和转录活性区,这些区域与DNA的复制、转录和重组密切相关[14]。本研究的结果证实,对比质粒转染介导的外源基因表达,逆转录病毒表达载体在介导外源基因表达的效率和稳定性方面均有明显的优势。此外,逆转录病毒表达载体介导的外源基因表达还可通过病毒的多轮感染有效地提高整合于宿主细胞转录活性区的外源基因的拷贝数。这一基因整合特性为外源目的基因的高效表达提供了可能,并由此大大提高了获得到外源基因高效表达细胞系的几率。虽然,逆转录病毒表达载体介导外源基因高效表达需要以操作相对繁琐的高滴度病毒制备为前提,但仍不失为一种有发展潜力和应用前景的、能有效提高外源基因在哺乳动物细胞表达效率的技术途径。
REFERENCES
[1] Dingermann T. Recombinant therapeutic proteins: production platforms and challenges. Biotechnol J, 2008, 3(1): 90−97.
[2] Dutton G. Trends in monoclonal antibody production. Gen Eng Biotechnol News, 2010, 30(4): 22−27.
[3] Durocher Y, Butler M. Expression systems for therapeutic glycoprotein production. Curr Opin Biotechnol, 2009, 20(6): 700−707.
[4] Strohl WR, Knight DM. Discovery and development of biopharmaceuticals: current issues. Curr Opin Biotechnol, 2009, 20(6): 668−672.
[5] Bushman F, Lewinski M, Ciuffi A, et al. Genome-wide analysis of retroviral DNA integration. Nat Rev Microbiol, 2005, 3(11): 848−858.
[6] Daniel R, Smith JA. Integration site selection by retroviral vectors: molecular mechanism and clinical consequences. Hum Gene Ther, 2008, 19(6): 557−568.
[7] McTaggart S, Al-Rubeai M. Retroviral vectors for human gene delivery. Biotechnol Adv, 2002, 20(1) 1−31.
[8] Størvold GL, Gjernes E, Askautrud HA, et al. A retroviral vector for siRNA expression in mammalian cells. Mol Biotechnol, 2007, 35(3): 275−282.
[9] Löw R. The use of retroviral vectors for tet-regulated gene expression in cell populations. Methods Mol Biol, 2009, 506: 221−242.
[10] Bleck GT. An alternative method for the rapid generation of stable, high-expressing mammalian cell lines. Bioproc J, 2005, 4: 43−51.
[11] Liu H, Liu XM, Li SC, et al. A high-yield and scaleable adenovirus vector production process based on high density perfusion culture of HEK293 cells as suspended aggregates. J Biosic Bioeng, 2009, 107(5): 524−529.
[12] Boyer C, Rothschild C, Wolf M, et al. A new method for the estimation of protein C by ELISA. Thromb Res,1984, 36(6): 579−589.
[13] Thyagarajan B, Calos MP. Site-specific integration for high-level protein production in mammalian cells. Methods Mol Biol, 2005, 308: 99−106.
[14] Mooslehner K, Karls U, K Harbers L. Retroviral integration sites in transgenic Mov mice frequently map in the vicinity of transcribed DNA regions. J Virology, 1990, 64(6): 3056−3058.
