游离锌离子和锌转运体-8在小鼠胰岛β细胞中的定位
2011-02-08李力牛犁
李 力 牛 犁
(1华中科技大学同济医学院附属同济医院第二临床学院;2华中科技大学同济医学院组织学与胚胎学教研室武汉430030)
锌离子是生物体内最重要的微量元素之一,在多种生物代谢过程中扮演着不可替代的角色,因此生物体内锌离子代谢紊乱会导致很多代谢过程失调从而导致慢性疾病的发生[1]。此外,锌离子在某种特定的细胞内有着特殊的功能,例如锌离子在胰岛β细胞中高表达,并参与胰岛分泌小泡中锌-胰岛素结晶体的形成[2]。锌离子不能自由通过细胞膜,特定的转运体和膜通道参与锌的转运和代谢。锌转运体 (zinc transporter,ZNT)家族至少拥有8个成员,即ZNT1-8,它们在锌离子的跨膜转运过程中起重要作用[3,4]。ZNT-8克隆自SLC30AS基因(染色体8q24.H),是一段含有369个氨基酸片段的蛋白,最初被认为是一种胰岛素特异性锌转运体蛋白[5]。为了明确游离锌离子和ZNT-8在胰腺组织内的定位、表达特征从而为ZNT-8通过参与胰岛β细胞内锌离子转运调节胰岛素分泌形态学依据,本研究应用金属离子自显影技术,RT-PCR、免疫组织化学ABC法和免疫荧光双标记技术,观察了游离锌离子、ZNT-8和胰岛素在小鼠胰腺组织内的定位、表达特征和相互关系。
材料和方法
1.动 物
2月龄清洁级雄性昆明小鼠(由华中科技大学同济医学院实验动物中心提供)20只,其中5只用于胰腺游离锌离子的硫化锌金属自显影(AMG)染色,4只用于胰腺ZNT-8 mRNA的RT-PCR检测,6只用于胰腺 ZNT-8的免疫组织化学ABC法染色,5只用于胰岛ZNT-8与胰岛素的免疫荧光双重标记。
2.胰 腺游离锌离子的硫化锌金属自显影(AMG)染色[6]
将小鼠颈椎离断后先后灌注0.3%硫化钠溶液150ml、生理盐水150 ml和2.5%戊二醛150ml,每种液体均在10 min内灌完。取胰腺置2.5%戊二醛后固定3h,然后将标本转入30%蔗糖液4℃冰箱保存过夜,次日在恒冷箱冰冻切片机内制作冰冻切片,片厚10μm,贴于经铬明矾处理的载玻片上晾干。切片在AMG孵育液[6]内26°C孵育1h,常规脱水、透明、中性树胶封片后显微镜下观察。
3.胰 腺ZNT-8 mRNA的RT-PCR检测
断头处死小鼠后取胰腺,Trizol一步法常规提取胰腺总 RNA,用紫外分光光度计检测 RNA浓度,取2μg总RNA在25μl反应体系中进行逆转录反应,然后取逆转录反应产物进行 PCR扩增。ZNT-8 mRNAPCR扩增引物:上游序列为5’-TTTATGGTGGCAGAGGTG-3’,下游序列为 5’-GGTTGTAGCCAAAGTTCC-3’,产物长度为364bp。反应条件:预变性(94℃,30min),变性(94℃,30sec),退火 (58℃,30sec),延伸 (72℃,30sec),循环30次。反应结束后取 PCR产物10μl在1.0%琼脂糖凝胶中120mV电泳30min,紫外线下凝胶成像系统观察照相。
4.胰 腺ZNT-8的免疫组织化学染色
4.1 胰腺切片制作
小鼠经腹腔10%水合氯醛麻醉 (350 mg/kg)麻醉后开胸,经升主主动脉插管灌注含1%肝素的生理盐水后,继以含4%多聚甲醛的0.1 mol/L磷酸缓冲液(PB,p H7.4)灌流固定,取胰腺浸入同种固定液中4℃后固定6h,再入含30%蔗糖的 PB中4℃过夜,次日恒温箱冰冻切片机切片(片厚 10 μm),切片贴于经铬明矾处理的载玻片上晾干备用。
4.2 免疫组织化学ABC法染色
切片经0.01 mol/L磷酸盐缓冲液(PBS,p H7.4)配制的 Triton X-100、H2O2处理后,用含3%牛血清白蛋白(BSA)和1%正常羊血清 (NGS)的PBS室温孵育30min,兔抗ZNT-8(1:500;武汉三鹰生物技术有限公司)4℃孵育过夜,生物素化羊抗兔IgG(1:200;Vector)室温孵育 2h,ABC(1:200;Vector)室温孵育2h。以上抗体和ABC用含3%BSA和1%NGS的 PBS稀释,各步孵育后用PBS充分漂洗切片。最后用含0.02%DAB和0.005%H2O2的0.05 mol/L Tris-HCl缓冲液室温下显色10-15 min,冲洗显色液后苏木精复染,蒸馏水漂洗,梯度酒精脱水,二甲苯透明后,中性树胶封片,显微镜下观察、照相。
4.3 ZNT-8与胰岛素的免疫荧光双重标记
切片经 Triton X-100处理后,用含3%BSA和1%正常驴血清 (NDS)的 PBS室温孵育 30min,继而用兔抗ZNT-8抗体 (l:200)和豚鼠抗胰岛素抗体(l:5000;Sigma)混合液室温孵育过夜,Cy3标记的驴抗兔IgG和Cy2标记的驴抗豚鼠IgG混合液室温避光孵育2h,Heochest 33342(终浓度1μg)室温孵育15-20 min。抗体用含3%BSA和1%DGS的PBS稀释,各步孵育后用PBS充分漂洗切片。反应结束后,切片避光晾干,用含 10%甘油的 PBS封片,荧光显微镜下观察、照相。
结 果
1.游 离锌离子在小鼠胰腺内的分布
在硫化锌AMG染色的胰腺切片上,游离锌离子呈棕色颗粒状,广泛分布在胰腺外分泌部和内分泌部(胰岛),其中外分泌部染色较强,胰岛呈中等强度染色(图1A)。高倍镜下观察,染成棕色的游离锌离子均匀分布在胰岛内包括β细胞分布区域在内的各个区域,定位在胰岛细胞胞质内,细胞核内无游离锌离子存在(图1B)。
2.Z N T-8 mRNA在胰腺内的表达
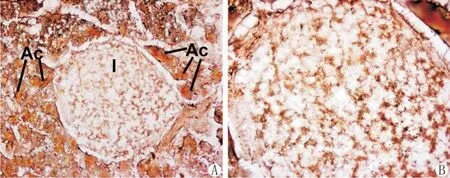
图1 游离锌离子在小鼠胰腺内的分布。A,游离锌离子在胰腺外分泌腺泡(Ac)和内分泌胰岛(I)中的分布(×100);B,A中胰岛(I)的高倍图像,示游离锌离子均匀分布在胰岛细胞胞质内(×400)。Fig.1 Distribution of free zinc ions in the mouse pancrea.A,distribution of free zinc ions in the exocrine acini and endocine islet(×100);B,the high magnification image of a islet in A showing even distribution of free zinc ions in the islet cells(×100).
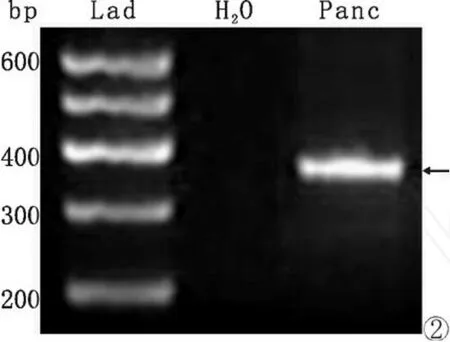
图2 小鼠胰腺ZNT-8mRNA表达的RT-PCR分析。bp,DNA分子量;Lad,DNA分子量标准;H2O,阴性对照;Panc,小鼠胰腺组织cDNA;箭示长度为364bp的 ZNT-8 mRNA PCR扩增产物。Fig.2 RT-PCR analysis of the mRNA expression of ZNT-8 in the mouse pancreas.bp,DNA molecular size;Lad,standard of DNA molecular size;H2O,negative control;Panc,cDNA of the mouse pancreas tissue.Arrow,indicating the ZNT-8 mRNA products amplified by PCR with a length of 364bp.
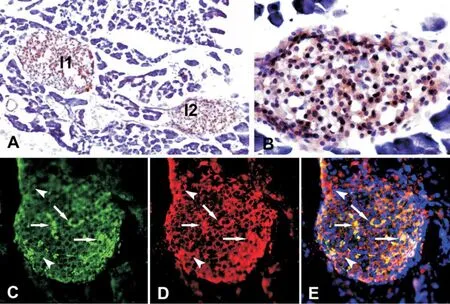
图3 ZNT-8在小鼠胰腺内的免疫组织化学定位。A,ZNT-8免疫组织化学ABC法染色,示ZNT-8免疫反应相应产物主要分布在胰岛(I1和I2)内,外分泌部未见明显阳性反应产物(×100);B,A中胰岛 I2的高倍图像,示 ZNT-8免疫反应相应产物均与分布在胰岛各区域细胞内(×400);C-E,ZNT-8与胰岛素免疫荧光双重标记(×200),所有胰岛素免疫反应阳性细胞(β细胞)均呈ZNT-8免疫反应阳性,部分ZNT-8免疫反应阳性细胞呈胰岛素免疫反应阴性,箭示ZNT-8与胰岛素双标细胞,箭示ZNT-8单标细胞。E为C和D的叠合图像,其中蓝色为呈 Heochest33342染色阳性的细胞核。Fig.3 Immunohistochemical localization of ZNT-8 in the mouse pancreas.A,immunohistochemical staining by ABC method showing that ZNT-8 immunoreactive products are mainly distributed in the pancreatic islets(I1 and I2),without obvious immunoreactive products in the exocrine portion(×100);B,the high magnification image of a islet(I2)in A showing that ZNT-8 immunoreactive products are evenly distributed in the all cells of the islet(×400);C-E,double immunofluorescent stai-
提取小鼠胰腺RNA,用ZNT-8特异性引物进行RT-PCR分析,在300bp和400bp之间出现的目的条带(364bp),即小鼠胰腺组织表达ZNT-8 mRNA。ning of ZNT-8 and insulin showing that all insulin-immunoreactive cells(βcells)are positive for ZNT-8 immunoreactivity but part of ZNT-8 immunoreactive cells are nagative for insulin immunoreactivity(×200),arrows indicating ZNT-8/insulin double labelled cells,arrow heads indicating ZNT-8 single labelled cells.E,merged image of C and D in which the nuclei stain blue Heochest 33342.
3.ZN T-8免疫反应产物在小鼠胰岛内的分布
在ABC法染色的胰腺切片上,ZNT-8免疫反应产物呈棕色分布在胰岛内,在胰腺外分泌部未见明显ZNT-8阳性免疫反应产物(图3A)。在胰岛内,ZNT-8免疫反应产物广泛均匀分布在所有胰岛细胞内,周边和中央区域细胞内的免疫反应性基本一致 (图3B)。
在ZN T-8与胰岛素免疫荧光双重标记的胰腺切片上,所有表达胰岛素的β细胞(绿色;图3C)均呈ZNT-8免疫反应阳性(红色;图3D),在叠合的图像中,这些双标细胞呈黄色或白色(图3E)。部分细胞胰岛素免疫反应阴性而ZNT-8免疫反应呈阳性,即ZNT-8免疫反应阳性细胞多于胰岛素免疫反应反应阳性细胞,这种ZNT-8单标细胞在叠合图像中呈红色或橘黄色(图4E),表明胰岛内除β细胞外,还有其他胰岛细胞也表达ZNT-8。
讨 论
锌离子作为人体的一种必需元素,在一些生物反应和生理过程中起着非常重要的作用[7]。人类基因组中有约10%的编码序列编码锌结合蛋白[8]。另外锌离子的游离形式在一些内分泌细胞中分布广泛,并在这些细胞的分泌过程中起到重要作用[9]。多种因素参与调节胞内锌含量,维持其在适当的范围内。锌离子是胰岛素分泌和贮存所必需的,在胰岛β细胞的分泌腺泡内6个胰岛素分子通过2个Zn2+形成较稳定的六聚体储存起来,当胰岛β细胞受到高血糖等刺激时才将其分泌出去[9]。本研究应用硫化锌金属自显影(AMG)染色技术为锌离子在小鼠胰腺中包括β细胞在内的胰岛细胞内存在,为锌离子与胰岛素分泌密切相关提供了直接的形态学证据。
在生物体内,锌离子不能自由通过细胞膜,需要特定的锌离子转运蛋白介导锌离子的摄取和外排,以维持细胞内锌离子的稳态[10]。己知的维持体内锌稳态的蛋白有两类,一类是金属硫蛋白,另一类是ZNTs[11]。ZNT-8克隆自 SLC30AS基因(染色体8q24.H),是一种由369个氨基酸组成的[12]。本研究的免疫组织化学研究表明,ZNT-8主要在胰腺的胰岛中表达,在胰岛内表达于所有区域的胰岛细胞中;免疫荧光双标染色进一步直接证明ZN T-8与胰岛素共定位于β细胞内。游离锌离子、ZNT-8均存在于胰岛β细胞内的事实提示,ZNT-8可能通过参与胰岛β细胞内游离锌离子的转运而调节胰岛素的分泌。由于游离锌离子广泛分布在胰岛所有细胞内,ZNT-8阳性细胞多于胰岛素阳性细胞,即除β细胞以外的其他胰岛细胞也含有游离锌离子和表达ZNT-8,因此,ZNT-8也可能通过转运其他胰岛细胞内的游离锌离子而调节其他胰岛激素如高血糖素、生长抑素的分泌。
[1]Scott DA,Fisher AM.The insulin and the zinc content of normal and diabetic pancreas.J Clin Invest,1938,17(6):725-728
[2]Dodson G,Steiner D.The role of assembly in insulin’s biosynthesis.Curr Opin Struct Biol,1998,8(2):189-194
[3]Palmiter RD,Huang L.Efflux and compartmentalization of zinc by members of the SLC30 family of solute carriers.Pflugers Arch,2004,447(5):744-751
[4]Eide DJ.The SLC39 family of metal ion transporters.Pflugers Arch,2004,447(5):796-800
[5]Seve M,Chimienti F,Devergnas S,et al.In silico identification and expression of SLC30 family genes:an expressed sequence tag data mining strategy for the characterization of zinc transporter’s tissue expression.BMC Genomics,2004,5(1):32-40
[6]Danscher G,Stoltenberg M,Bruhn M,et al.Immersion autometallography:histochemical in situ capturing of zinc ions in catalytic zinc-sulfur nanocrystals.J Histochem Cytochem,2004,52(12):1619-1625
[7]Chimienti F,Aouffen M,Favier A,et al.Zinc homeostasis-regulating Proteins:new drug targets for triggering cell fate.Curr Drug Targets,2003,4(4):323-338
[8]Andreini C,Banci L,Bertini I,et al.Counting the zincproteins encoded in the human genome.JProteome Res,2006,5(1):196-201
[9]Zalewski P,Millard S,Forbes l,et al.Video image analysis of labile zinc inviable Pancreatiei slet cells using a specific fluoreseent Probe for zinc.JHistochemCytochem,1994,42(7):877-884
[10]Sladek R,Rocheleau G,Rung J,et al.A genome-wide association study identifies novel risk loci for type 2 diabetes.Nature,2007,445(7130):881-885
[11]Liuzzi J P,Cousins RJ.Mammalian zinc transporters.Annu Rev Nutr,2004,24:151-172
[12]Huang L,Kirschke CP,Gitschier J.Functional characterization ofanovelmammalian zinc transporter,ZNT6.J Biol Chem,2002,277(29):26389-26395
