非小细胞肺癌中血管生成拟态和VEGF的表达及意义
2011-02-08承泽农武世伍宋文庆陶仪声
承泽农 武世伍 俞 岚 宋文庆 陶仪声
(蚌埠医学院第一附属医院病理科,蚌埠医学院病理学教研室 安徽 233003)
当肿瘤直径达到或超过1-2mm时,由环境渗透提供的营养物质已不能保证肿瘤细胞的生长。此时,向肿瘤提供营养的血管逐步形成。长期以来,人们一直认为肿瘤血管生成是其获得血液供应的唯一途径。直到1999年美国学者Maniotis发现人眼葡萄膜黑色素瘤中存在由肿瘤细胞围成的管道结构—血管生成拟态(Vasculogenic mimicry,VM),首次提出了一种与经典肿瘤血管生成途径不同的模式,VM概念的提出丰富了肿瘤血液供应理论。VM的存在与疾病进展和预后不良相关[1-2]。VEGF是一种特异作用于血管内皮细胞的生长因子,其在肿瘤血管生成中有确切的重要作用。本研究通过检测160例NSCLC病例标本VM和VEGF的表达,探讨VEGF与VM与NSCLC患者的预后关系及其与NSCLC浸润、淋巴结转移的关系。
材料和方法
1. 一般资料
收集蚌埠医学院第一附属医院病理科2003年1月—2005年4月存档石蜡包埋NSCLC组织标本160例(术前未行放、化疗)和正常肺组织标本20例,所有病例均有完整的临床、病理及随访资料,入选病例随访至患者死亡或截止2010年4月,随访时间为3-84个月。其中男性130例,女性30例;从大体类型看,中央型120例,周围型40例;鳞癌116例(高分化17例,中分化 71例,低分化28例),腺癌44例(高分化4例,中分化32例,低分化8例)。年龄26-82岁,中位年龄59.6±9.5岁,≥60岁86例,<60岁 74例;肿瘤长径D≥3.0cm 145例,D<3.0cm 15例;按淋巴结有无转移,有转移76例,无转移84例。根据UICC2002版PTNM病理分期标准进行分期,其中Ⅰ期患者31例,Ⅱ期患者43例,Ⅲ期患者34例,Ⅳ期患者52例。对照组正常肺组织20例取自肺癌肿块>5.0cm的肺组织,病理 HE染色证实为正常肺组织。
2. 试剂
鼠抗人 CD34单克隆抗体(产品编号:MAB-0034,克隆号QBEnd/10)购自福州迈新生物技术开发公司;鼠抗人VEGF单克隆抗体(克隆号:C-1)购自Santa Cruz公司;ElivisionTMplus试剂盒以及DAB显色试剂盒均购自福州迈新生物技术开发公司。PAS染色液为蚌埠医学院第一附属医院病理科配制。
3. 实验方法
3.1 采用免疫组织化学 ElivisionTMplus法,将石蜡标本以4μm厚连续切片,烤干,于二甲苯溶液及不同浓度的乙醇中脱蜡至水洗。免疫组化染色操作步骤按试剂盒说明书进行。采用已知阳性片作对照,以PBS液代替一抗作空白对照。
3.2 CD34和 PAS套染 CD34染色,DAB显色后,流水冲洗1min终止显色反应,将切片置于0.5%高碘酸溶液中氧化5-8min。流水冲洗2min,再用蒸馏水洗1次,于暗处置于Schiff液中染色10-20min,然后用0.5%偏重亚硫酸钠液滴洗2次,每次1min,流水冲洗2min;此后依次苏木素浅染细胞核、盐酸酒精分化、返蓝、脱水透明以及中性树胶封片。
3.3 微血管密度(MVD)计数 CD34主要表达在血管内皮细胞的细胞质和胞膜,从而可以通过CD34的阳性表达来进行MVD计数,参照修改过的Weidner[3]法来计数。
4. 结果判定
CD34和VEGF均以细胞膜和细胞质出现棕黄色颗粒为阳性。采取二次计分法:每例标本随机计数5个高倍视野(×400),计数每个高倍视野中阳性细胞所占百分比并计分。首先将染色强度计分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。再将阳性细胞百分比计分,0分为阴性,1分阳性细胞为<10%,2分为11%-50%,3分为51%-75%,4分为>75%。用染色强度得分和细胞数得分的乘积作为判断表达结果,若积分≤1为阴性,>1为阳性。免疫组化结果由高年资病理医师读片评定。
5. 统计学分析
采用SPSS17.0统计软件进行数据分析。VM和VEGF表达阳性组与阴性组生存分析用 Kaplan-Meier法,组间比较用log-rank检验,多因素分析采用Cox回归多因素模型,VM和VEGF在NSCLC组织中表达与正常肺组织、各临床及病理因素的相关性采用Fisher精确概率法Spearman等级相关检验,P<0.05为差异有统计学意义。
结 果
1. NSCLC中存在 VM(见图1 A,B),除了见到为PAS阳性染色但CD34阴性的管腔样结构外,还可见到网络状VM[4],具有VM的肿瘤细胞附近不见坏死的肿瘤细胞及炎症细胞。其中鳞癌中VM阳性率为35.3%(41/116),腺癌中VM阳性率为40.9%(18/44)。
2. NSCLC中VM与临床病理的关系 VM与患者的性别、年龄、组织学类型等之间差异无统计学意义(P>0.05)。VM阳性组的NSCLC比VM阴性组的 NSCLC分化差,差异有显著性(P<0.05),PTNM分期Ⅰ-Ⅱ期VM阳性率为4.1%(3/74),Ⅲ-Ⅳ期VM阳性率为65.1%(56/86),VM组的PTNM分期比无VM组的PTNM分期相比差异有统计学意义(P<0.05),且VM组的患者更易发生淋巴结转移(P<0.05)(表1)。
3. NSCLC中VEGF的表达及其与临床病理的关系 VEGF主要表达于NSCLC癌细胞膜和细胞质,呈棕黄色(见图 1 C,D)。对照组未见有VEGF表达,在NSCLC中VEGF蛋白阳性表达率为51.3%,其表达与患者性别、年龄及组织学类型无相关性(P>0.05)。随着NSCLC的分化越低,VEGF的表达越强,差异有统计学意义(P<0.05)。VEGF的阳性表达与淋巴结转移相关(P<0.05);Ⅰ-Ⅱ期肿瘤中VEGF的阳性率为16.2%(12/74),Ⅲ-Ⅳ期肿瘤中VEGF的阳性率为81.4%(70/86),两者之间差异具有统计学意义(P<0.05)(表1)。
4. NSCLC中VM与VEGF表达的关系 在VM阳性组的病例中,VEGF阳性率为89.8%(53/59);在VEGF阳性表达的病例中,VM的阴性率为35.4%(29/82),差异有统计学意义。Spearman相关分析显示,VM与VEGF在NSCLC中的表达呈正相关(r=0.590,P=0.000)(表2)。
5. 多因素分析 将病理组织分化(分为高分化组、中分化组与低分化组),年龄(分为≥60岁组与<60岁组)、PTNM分期(分为ⅠⅡ期组与Ⅲ Ⅳ期组)、肿瘤直径(分为≥3.0cm组与<3.0cm组)、肿瘤位置(分为中央型组与周围型组)、淋巴结转移(分为有转移组与无转移组)、性别(男性组与女性组)、VM(分为阳性组与阴性组)、微血管密度(microvessel density,MVD,因为 MVD的均值为22.42±12.8,故以MVD<22为阴性;MVD≥22为阳性)和VEGF(分为表达阳性组与阴性组)等因素引入Cox模型进行多因素分析,结果显示:VM和VEGF的表达及 PTNM分期影响NSCLC根治术后患者预后的独立因素(见表3)。
6. 生存分析 本组病例总的5年生存率为26.9%。Kaplan-Meier生存分析显示VM阳性组与阴性组5年生存率分别为1.7%和41.6%,差异有统计学意义(P=0.000);VEGF阳性组与阴性组5年生存率分别为2.4%和52.6%,差异有统计学意义(P=0.000),生存曲线见图2、图3。

图1 VM和VEGF在NSCLC中的阳性染色A和B:在NSCLC中VM阳性染色(黑箭头所示为VM结构,红箭头所示为血管,A和B为低分化鳞癌 ElivisionTM×400);C和D:在NSCLC中VEGF表达阳性,主要表达于细胞膜和细胞质(C为低分化鳞癌,D为中分化鳞癌,ElivisionTM×400)。Figure 1 Expression of VM and VEGF in NSCLC (ElivisionTM×400)A and B:positive staining of VM in NSCLC(black arrow is VM,red arrow is vessel,A and B are poor grading squamous carcinoma);C and D:positive staining of VEGF in membrane and cytoplasma of NSCLC(C is poor grading squamous carcinoma,D is mediate grading squamous carcinoma).
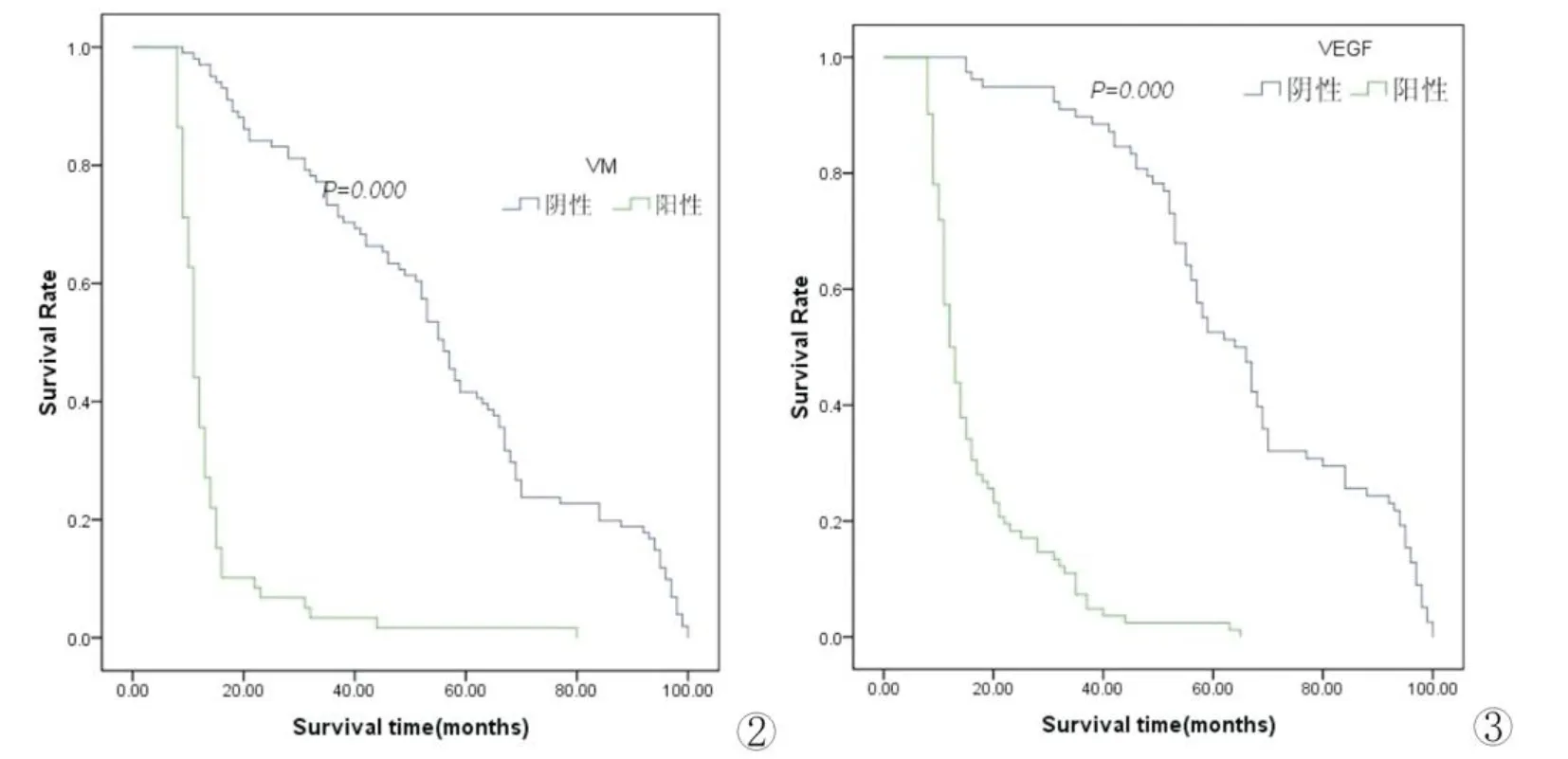
图2 VM表达阳性组与阴性组NSCLC患者生存曲线图3 VEGF表达阳性组与阴性组NSCLC患者生存曲线Fig 2 Survival curves of NSCLC patients with positive or negative VM expression.Fig 3 Survival curves of NSCLC patients with positive or negative VEGF expression.
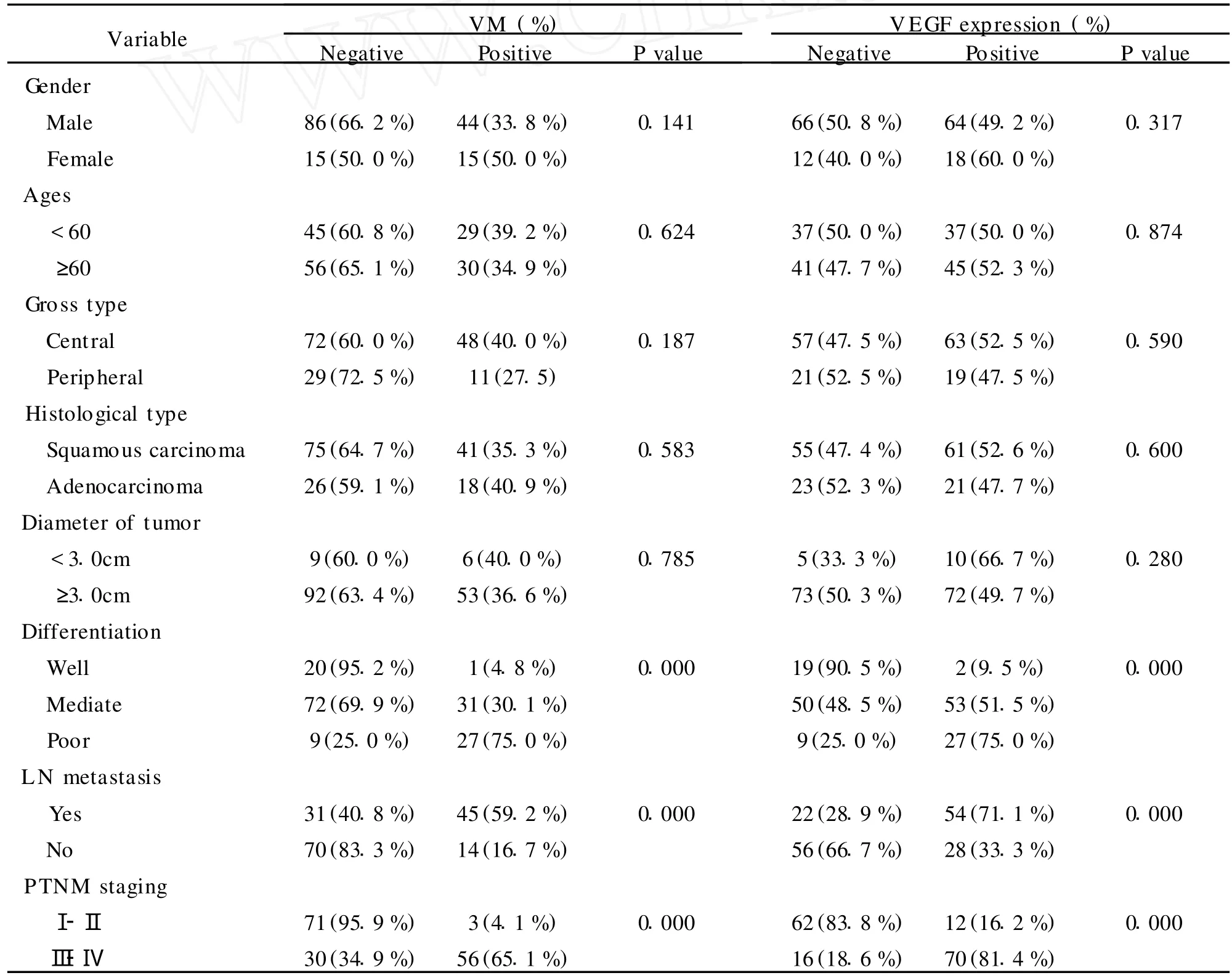
表1 160例NSCLC组织中VM和VEGF的表达与临床病理因素的关系T able 1 Correlation of VM and VEGF expression to clinicopathologic characteristics of 160 patients with NSCLC

表2 NSCLC中VM与VEGF表达之间的关系Table 2 Correlation of VM expression to VEGF expression in NSCLC

表3 160例NSCLC患者多因素分析Table 3 Multivariate survival analysis of 160 patients with NSCLC
讨 论
VM是高侵袭性肿瘤为了满足自身的血液供应,瘤细胞通过自身变形和细胞外基质重塑而围成的一种类血管样的管道,是一种不依赖血管内皮细胞的一种肿瘤微循环模式,并与宿主血管相连,获取血供。1999年美国学者Maniotis在研究高侵袭性葡萄膜黑色素瘤时发现肿瘤中除了存在由血管内皮细胞围成的血管外,同时存在由肿瘤细胞相互连接、细胞外基质内衬而形成的PAS阳性、CD34阴性的网状管道结构,与原静脉相连,甚至在某些空心管道中存在红细胞,于是提出了血管生成拟态(VM)。形成VM的肿瘤细胞具有胚胎样基因表型,使得肿瘤细胞可以表达与血管生成有关的标记:如 VE-cad、VEGF、EphA2、MMP2、HIF-1α等。后来 ,在肝癌[5]、前列腺癌[6]、卵巢癌[7]以及骨肉瘤[8]等高度恶性的肿瘤都报道存在VM。
VM在肿瘤生物学中具有十分重要的意义。一方面缺血和缺氧是恶性肿瘤发展过程中的普遍现象,缺氧会诱导VEGF表达增加进而刺激肿瘤血管新生,但当新生的血管还不能满足肿瘤生长所需时,部分肿瘤细胞可能就会相互连接,形成拟态血管,给肿瘤组织供氧。另一方面,VM管道直接由肿瘤细胞围成,肿瘤细胞与血流之间仅有一层PAS阳性的基底膜样物相隔,无血管内皮细胞屏障,因此肿瘤细胞释放的蛋白水解酶能够更容易地溶解基底膜样物而使肿瘤细胞直接进入血液,从而有利于肿瘤的侵袭和转移。
本实验在59例NSCLC中发现了符合VM标准的管道结构,证实在NSCLC中有VM的存在。同时表达VM的区域很少出现坏死,且VM的表达与细胞分化程度、淋巴结转移与否及临床分期等密切相关。即表达VM的肿瘤具有低分化、临床分期晚以及更易发生淋巴结转移,这与国内外的文献报道一致[9-10]。
VEGF及其受体是公认的介导新生血管形成的关键因素,是高度特异的促血管内皮细胞的有丝分裂素和血管生成中最主要的调节因子。VEGF的表达与肿瘤的病程及恶性程度密切相关,能刺激内皮细胞的增殖,有利于肿瘤细胞的浸润及转移。本研究结果显示VEGF的表达与NSCLC的分化程度、淋巴结转移及临床分期等呈正相关。本研究结果还显示VEGF的表达与患者的年龄、肿瘤的大小及组织学类型等无关。
目前,关于VEGF在恶性肿瘤血管生成拟态现象中的作用国内外文献报道结果不一。有人发现在有血管生成拟态的肿瘤中VEGF表达不仅没有增加,甚至下降,认为原因可能是VM的存在使肿瘤细胞获得足够的血液供应,氧气供应充足,刺激肿瘤细胞分泌VEGF的主要诱因减弱,导致VEGF的表达降低[11-12]。但另外一些学者认为VEGF在肿瘤的VM形成过程中有极其重要的作用[10,13]。那么,VEGF在NSCLC的VM形成过程中是否也有重要的作用?其能否成为一个抗NSCLC的VM的靶点呢?本研究结果显示,在NSCLC中,随着VEGF的表达率的升高,VM的阳性率显著升高,两者呈正相关。提示在NSCLC的VM形成过程中,VEGF可能起到一个关键的作用。根据结果初步推测缺氧会诱导VEGF的表达增加进而诱导肿瘤血管新生,且缺氧还能够诱导部分肿瘤细胞相互连接形成VM。在这个过程中,肿瘤细胞可以变形,而高表达的VEGF在这种细胞变形过程中可能起到一定的促进作用。
本研究多因素分析显示VM和VEGF的表达、PTNM分期是影响NSCLC患者的独立预后因素。进一步的生存分析显示VM阳性组与阴性组的5年生存率分别为1.7%和41.6%,差异有统计学意义,提示VM阳性组比VM阴性组有更低的5年生存率,这与文献报道结果相同[14];VEGF阳性组与阴性组的5年生存率分别为2.4%和52.6%,差异有统计学意义。提示VEGF的表达与肿瘤患者的生存率及生存期预后的估计可能有一定的指导意义。
VM的发现改变了人们以往对肿瘤血供的传统观念,VM的存在对现行的抗血管生成治疗提出了挑战。本研究结果提示VEGF在NSCLC的VM形成过程中起重要的作用,但在不同肿瘤中的VM形成过程中是否起到同样的作用?其机制是否相同?这需要通过进一步的实验来了解。
[1]Hendrix MJ,Seftor EA,Hess AR,et al.Vasculogenic mimicry and tumor cell plasticity:lessons from melanoma.Nat Rev Cancer,2003,3(6):411-421
[2]Yue WY,Chen ZP.Does vasculogenic mimicry exist in asrtocytoma?JHistochem Cytochem,2005,53(8):997-1002
[3]Kumada T,Tsuneyama K,Hatta H,et al.Improved 1-h rapid immunostaining method using intermittent microwave irradiation:practicability based on 5 years application in Toyama Medical and Pharmaceutical University Hospital.Mod Pathol 2004;17(9):1141-1149
[4]Folberg R,Maniotis AJ.Vasculogenic mimicry.APMIS,2004;112(7-8):508-525
[5]赵秀兰,杜静,张诗武,等.肝细胞肝癌中血管生成拟态的研究.中华肝脏病杂志,2006,14(1):41-44
[6]Danny R,Gray I,Wendy J,et al.Short-term human prostate primary xenografts:an in vivo model of human prostate cancer vasculature and angiogenesis. Cancer Res,2004,64(3):1712-1721
[7]Sood AK,Seftor EA,Fletcher MS,et al.Molecular determinants of ovarian cancer plasticity.AmJ Pathol,2001,158(4):1279-1288
[8]Cai XS,Jia YW,Mei J,et al.Tumor blood vessels formation in osteosarcoma:vasculogenesis mimicry.Chin Med J,2004,117(1):94-98
[9]Folberg R,Hendrix MJ,Maniotis AJ.Vasculogenic mimicry and tumor angiogenesis.Am J Pathol,2000,156(2):361-381
[10]朱芳,李振宇,任精华等.VEGF与肿瘤血管生成拟态关系的研究.临床肿瘤学杂志,2009,14(1):20-24
[11]郝希山,孙保存,张诗武等.双向分化肿瘤血管生成拟态的组织微阵列研究.中华医学杂志.2002,82(19):1298-1302
[12]郄硕,张涛武,张丹芳等.胃肠道间质瘤组织中基质金属蛋白酶2和9表达与血管生成拟态的关系.中华医学杂志,2009,89(16):1106-1109
[13]Vartanian AA,Burova OS,Stepanova EV,et al.The involvement ofapoptosis in melanomavasculogenic mimicry.Melanoma Res,2007,17(1):1-8
[14]Shirakawa K,Wakasugi H,Heike Y,et al.Vasculogenic mimicry and pseudocomedo formation in breast cancer Int J Cancer,2002,99(6):821-828
