雌激素削弱同型半胱氨酸诱导的N2a细胞Tau和NgR共表达
2011-02-08鲁亚平许家玉曹永才
童 飞 鲁亚平 朱 勇 许家玉 曹永才
(安徽省无为县畜牧局安徽 238300)
Tau蛋白是神经细胞主要的微管相关蛋白(microtubule associated protein,MAP),Tau蛋白高度磷酸化,形成成对螺旋丝(paired helical filament,PHF),并以纤维丝团形式堆积在神经元内,形成神经原纤维缠结(neurofibrillary tangle,NFT),使神经元产生退行性变[1]。Nogo-66 receptor(NgR)被确认是中枢神经系统(central nervous cystem,CNS)损伤后抑制再生的膜受体[2]。血浆中 Hcy水平:5~15μmol/L 为正常、16~30μmol/L 为轻度增高、31~100μmol/L 为中度增高、>100μmol/L 则为重度增高[3]。在许多神经疾病中,Hcy在脑中积聚,是潜在的神经毒素,超量的高半胱氨酸增加阿尔茨海默病(Alzheimer’s disease,AD)的发病率[4,5],但机制却不清楚。王建枝等通过大鼠尾静脉注射高半胱氨酸两个星期,在大鼠的海马检测到了AD样Tau过度磷酸化[6]。
在这里我们采用细胞培养技术,用100μmol/L的高同型半胱氨酸(homocysteine,Hcy)在不同的时间段(0.5h、5h)诱导 N2a细胞,促使 Tau蛋白的过度磷酸化,建立神经细胞 Tau过度磷酸化模型,检测用100nM的雌激素(17β-estradiol,E2)预处理过的N2a细胞NgR的表达变化。在体外已证明雌激素最佳实验浓度在1-100nM之间[7],为此我们用100nM的雌激素预处理小鼠神经瘤细胞系(Neuro2A,N2a)。本研究应用免疫荧光双标法观察了Hcy诱导组以及用17β-雌二醇预处理后N2a细胞Tau蛋白和NgR的共表达变化,旨在为临床上应用雌激素替代疗(estrogen replacement therapy,ERT)法预防因雌激素缺乏或断绝而导致的神经元功能衰退性疾病的发生,探讨雌激素对神经再生作用的机制及意义提供点实验依据。
材料和方法
1主 要试剂与仪器
小鼠神经瘤细胞系(N2a)(周江宁教授赠予,中国科学技术大学),DMEM(美国 GIBCO公司),胎牛血清 (FBS,美国 GIBCO公司),100 IU的青霉素和链霉素(美国 GIBCO公司),60mm的六孔细胞培养板(Corning Incorporated,USA),60 mm×15mm的细胞培养皿(CorningIncorporated,USA),p-Tau(ser-396)羊多克隆抗体、Nogo-R(H-120)兔多克隆抗体、生物素标记的牛抗兔 IgG-B、生物素标记的驴抗羊Ig-B分别购于美国Santa Cruz公司,streptavidin-FITC(Biolegend),Cy3-labeled streptavidin(Kirkegaard and Perry Laboratories,Gaithersburg,MD),同型半胱氨酸 (Hcy)、17β-雌二醇(17β-estradiol,E2)分别购于美国Sigma公司。
2实 验分组与细胞模型的建立
实验前一天,将N2a细胞系种到两块60mm的六孔细胞培养板上,每孔内各放一个经多聚赖氨酸处理过的盖玻片,隔一天换一次细胞培养液。实验分成4组:第1组为空白对照组(两孔),第2组加入100μM Hcy 0.5小时组(四孔),第3 组加入100μM Hcy 5小时组(四孔),第4组先用100nM 的 E2预处理2小时后再加入100μM Hcy诱导5小时组(两孔)。以上所有操作均在相同的条件下进行。
3 p-Ta u和NgR 的免疫荧光双标法
细胞爬片后取出,冰DPBS洗3×5min;4%多聚甲醛固定10分钟(4度冰箱中);ddH2O洗3×5min;3%H2O2封闭内源性过氧化物酶,室温下10min;DPBS溶液洗3×5min;5%羊血清室温下封闭1h,减少非特异性抗体的干扰;甩去血清(不洗),一抗Nogo-R兔抗人多克隆抗体(1:200)37℃孵育1h;DPBS溶液洗3×5min;滴加生物素连接(牛抗兔)的二抗(1:200)含5%羊血清37℃孵育30min;DPBS溶液洗3×5min;滴加Cy3-labeled streptavidin(1:500)(5μg/ml)37℃孵育1 hour(以下步骤在黑暗中进行!);DPBS溶液洗3×5min;细胞片浸入0.05 mol/L的glycine-HCl-buffered saline(p H 2.2)室温下1 hour,来淬灭多余的抗体;DPBS溶液洗3×10min;滴加一抗p-Tau羊多克隆抗体(1:200)37℃孵育1h;DPBS溶液洗3×10min;滴加生物素连接(驴抗羊)的二抗(1:200,containing 5%normal goat serum)37℃孵育30min;DPBS溶液洗3×5min;滴 加 Streptavidin-FITC(1:200)(5μg/ml)37℃孵育30min;DPBS溶液洗3×5min;90%甘油封片;OL YMPUS IX51(Tokyo,Japan)荧光倒置显微镜下观察和拍照。
4图 像分析及数据处理
用Image Pro Plus 5.1.1(Media Cybernetics.Silver Spring,MD,USA)软件分别测出每组中每张片子上任意五个细胞p-Tau和NgR的免疫荧光强度值,显微镜放大倍数为400,所有照片经过背底一致化处理,数据采用平均值±标准误。所得数据由SPSS13.0(SPSS Inc.,Chicago,IL,USA)统计学软件作单因素方差检验分析(表1),最后用Origin7.5(OriginLab,USA)软件作直方图分析(P<0.05被认为有明显统计学差异)。

表1 比较实验组和对照组NgR和p-Tau免疫荧光强度值Table 1 Compared the experimental groups and control groups NgR and p-Tall immunofluorescence intensity

图2 NgR和p-Tau的免疫荧光双标(×400) 图A,D,G,J绿色示p-Tau的免疫阳性反应(×400);图B,E,H,K红色示NgR的免疫阳性反应(×400); 图C,F,I,L黄色示两者的共表达 (×400); 图A,B,C分别是对照组的p-Tau、NgR的免疫阳性结果和共标; 图D,E,F分别是0.5h组的p-Tau、NgR的免疫阳性结果和共标; 图 G,H,I分别是5h组的p-Tau、NgR的免疫阳性结果和共标;图J,K,L分别是 E2+5hHcy组的p-Tau、NgR的免疫阳性结果和共标。Fig.A,D,G,J showing p-Tau immunoreactivity(green)expressed in N2a cells(×400). Fig.B,E,H,K showing NgR immunoreactivity(red)expressed in N2a cells(400×). Fig.C,F,I,L showing p-Tau and NgR immunoreactivity coexpressed in N2a cells(400×). Fig.A,B,C NgR and p-Tau immunoreactivity rarely co-expressed in control groups. Fig.D,E,F Showing much more p-Tau and NgR co-expressed in the N2a cells in 0.5 groups. Fig.G,H,I Showing high expression of p-Tau and NgR in the N2a cells in 5h groups. Fig.J,K,L Displaying fewer p-Tau and NgR immunoreactivity expressed in the N2a cells in E2+5h groups.
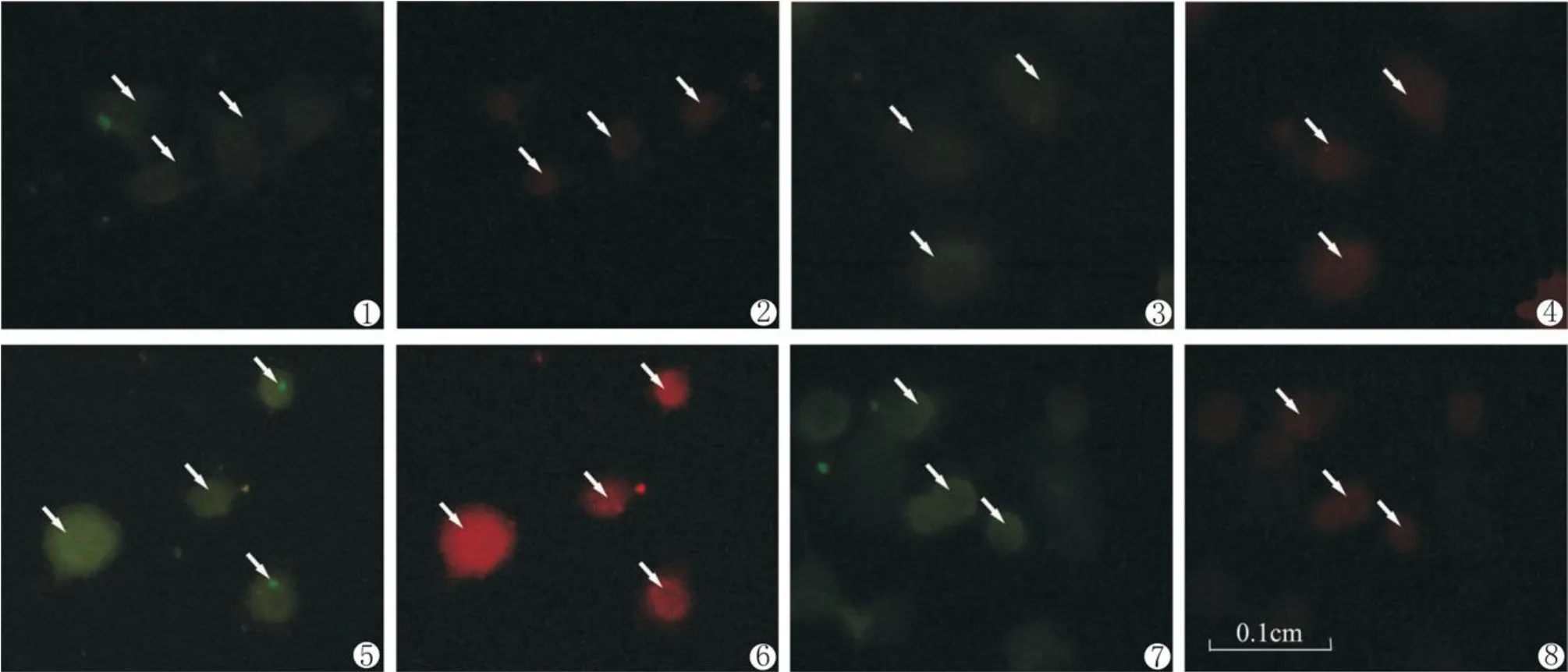
图3 NgR和p-Tau的免疫荧光双标(×800) ①,②,③,④,⑤,⑥,⑦,⑧分别取自图2中的 A,B,D,E,G,H,J,K;①,③,⑤,⑦箭头显示p-Tau的免疫阳性结果都广泛分布于N2a细胞的胞膜、胞质和突起上(比例=100:1); ②,④,⑥,⑧显示NgR的免疫阳性结果广泛分布于N2a细胞的胞膜,对照组(图②)中主要在核内(比例=100:1)。Fig.3:①,②,③,④,⑤,⑥,⑦,⑧were taken from Fig.2:A,B,D,E,G,H,J,KThe arrows of①,③,⑤,⑦show that the p-Tau’s immunopositive results are widely distributed in the N2a cell membrane,cytoplasm,and neurodendrite;②,④,⑥,⑧show the results of NgR immunopositive widely distributed in the N2a cell membrane,but in the control groups it mainly in the nucleus(figure②).
结 果
实验采用免疫荧光技术,结果显示在对照组和实验组中p-Tau的免疫阳性结果都广泛分布于N2a细胞的胞膜、胞质和突起上,细胞核中很少分布。NgR的免疫阳性结果与p-Tau类似,但它主要分布于神经元的胞膜、胞质和胞核,很少有全细胞分布(见图2、图 3)。在 Hcy诱导后5h组 N2a细胞中Tau蛋白和NgR蛋白的共表达强度与对照组相比有较大差异(P<0.01)(见表1)。用100nM 的 E2预处理2小时后再加入 Hcy诱导5小时组与对照组无明显差异(P>0.05)。
讨 论
我们发现NgR广泛分布于N2a细胞,与对照组相比高浓度 Hcy诱导0.5h和5h时NgR免疫活性明显增强(P<0.01)。这说明高浓度 Hcy在这一损伤过程中起了至关重要的作用。NgR是神经元表面受体,它是三种抑制性蛋白:Nogo-A、髓磷脂相关糖蛋白(myelin-associated glycoprotein,MAG)和少突细胞髓磷脂糖蛋白(oligodendrocyte myelin glycoprotein,OMgp)的共同受体,并与它们发生作用抑制轴突的再生[2,8,9]。我们发现对照组中NgR免疫阳性结果主要分布于细胞核,或许 NgR和p75NTR、APP(Aβprecursor protein)一样 ,可以被α-和γ-分泌酶剪切,释放出细胞外的NgR片段(the extracellular NgR,NgR ECD)和细胞内的NgR片段(the intracellular NgR,NgR ICD)[10]。NgR被神经分泌酶剪切后神经抑制信号被切断,轴突再生的抑制被解除[11,12,13]。这或许是神经瘤细胞能无限增殖的原因之一。同型半胱胺酸又称为高半胱氨酸,是蛋氨酸和半胱胺酸代谢过程中一个重要的中间产物。近年大量研究发现,阿尔茨海默病(AD)患者存在高同型半胱氨酸血症(hyperhomocysteinemia,HHcy),Hcy与AD的发生发展有着密切的联系[14,15]。细胞内 Hcy浓度的升高可引起tau蛋白的高磷酸化[16]。
本实验的P-Tau是羊多克隆抗体用来检测tau蛋白在Ser396位置的磷酸化,Hcy处理N2a细胞后多数NgR和p-Tau共表达于细胞中,这也暗示着NgR可能与tau蛋白的过度磷酸化进程密切关联着。我们发现NgR广泛分布于N2a细胞中,与对照组相比高浓度 Hcy处理0.5h和5h时NgR免疫活性明显增强(P<0.01),雌激素预处理组N2a细胞 Tau蛋白和NgR的表达减少,甚至恢复到原有水平。这说明高浓度 Hcy在这一损伤过程中起了至关重要的作用,而雌激素可以明显地拮抗 Hcy对神经细胞的损伤。此过程中,雌激素可能主要通过抑制糖原合成酶激酶-3β(Glycogen synthase kinase-3,GSK-3β)并与雌激素受体(estrogen receptor,ER)、β-catenin结合后,通过细胞间信号的传导作用削弱 Tau蛋白的过度磷酸化[7,17],从而减轻了神经细胞的损伤,引起NgR表达下调。雌激素在体内具有广泛的生物学活性,它对神经细胞的作用可能还受到遗传和环境依赖,其机制尚需要进一步研究。
这里暗示对于绝经后或因卵巢肿瘤切除卵巢患者实施雌激素取代治疗能减少或延迟AD的发生。我们应高度重视雌激素的作用,增加它们的供应,从源头上预防和治疗Hcy引起的相关疾病的发生。
致谢
感谢中国科学技术大学周江宁教授提供的N2a细胞系;感谢安徽师范大学鲁亚平教授给予实验指导。
[1]Carlo Ballatore,Virginia M.Y.Lee,John Q.Trojanowski.Tau-mediated neurodegeneration in Alzheimer’s disease and related disorders.Neuroscience,2007,8:663-672
[2]Alyson E.Fournier,Tadzia GrandPre&Stephen M.Strittmatter.Identification of a receptor mediating Nogo-66 inhibition of axonal regeneration.Nature,2001,409:341-6
[3]Stefan Bleich,Detlef Degner,Wolfgang Sperling,et al.Homocysteineasa neurotoxin in chronic alcoholism.Progress in Neuro-Psychopharmacology&Biological Psychiatry,2004,28:453-464
[4]Obeid R,Herrmann W.Mechanisms of homocysteine neurotoxicity in neurodegenerative iseases with special reference to dementia.FEBS Lett,2006,580:2994-3005
[5]Ravaglia G,Forti P,Maioli F,et al.Homocysteine and folacin as risk factors for dementia and Alzheimer disease.Am.J.Clin.Nutr,2005,82:636-643
[6]Chang E Zhang,Qing Tian,Wei Wei,et al.Homocysteine induces Tau phosphorylation by inactivating protein phosphatase 2A in rat hippocampus.Neurobiology of Aging,2007,29(11):1654-1665
[7]Hai-Rong Shi,Ling-Qiang Zhu,Shao-Hui Wang,et al.17β-estradiol attenuates glycogen synthase kinase-3β activation and tau hyperphosphorylation in Akt-independent manner.J Neural Transm,2008,115:879-888
[8]Betty P.Liu,Alyson Fournier,Tadzia GrandPre,et al.Myelin-Associated Glycoprotein as a Functional Ligand for the Nogo-66 Receptor.Science,2002;297:1190-1193
[9]Jan M.Schwab,Sagun K.Tuli and Vieri Failli.The Nogo receptor complex:confining molecules to molecular mechanisms.TRENDS in Molecular Medicine,2006,12:293-297
[10]Mirnics ZK,Yan C,Portugal C,et al.P75 neurotrophin receptor regulates expression of neural cell adhesion molecule 1.Neurobiol Dis,2005,20:969-985
[11]Niccolo‘Zampieri,Chong-Feng Xu,Thomas A.Neubert,et al.Cleavage of p75 Neurotrophin Receptor by α-Secretase andγ-Secretase Requires Specific Receptor Domains.The Journal of Biological Chemistry,2005,280:14563-14571
[12]Zubair Ahmed,Gordon Mazibrada,Ruth J.Seabright,et al.TACE-induced cleavage of NgR and p75NTR in dorsal root ganglion cultures disinhibits outgrowth and promotes branching of neurites in the presence of inhibitory CNS myelin. The FASEB Journal,2006,20:E1382–E1392
[13]Hahn-Jun Lee,Kwang-Mook Jung,Yang Z.Huang,et al. Presenilin-dependentγ-Secretase-like Intramembrane Cleavage of ErbB4. The Journal of Biological Chemistry,2002,277:6318-6323
[14]Barney E.Dwyer,ArunK.Raina,George Perry,et al.Homocysteine and Alzheimer’s disease a modifiable risk?Free Radical Biology&Medicine,2004,36(11):1471-1475
[15]Teodoro Bottiglieri.Homocysteine and folate metabolism in depression.Progress in Neuro-Psychopharmacology and Biological Psychiatry,2005,29(7):1103-1112
[16]Vafai SB,Stock JB.Protein phosphatase 2A methylation:a link between elevated plasma homocysteine and Alzheimer’s Disease.FEBS Lett,2002;518:1-4
[17]P.Cardona-Gomez,M.Perez,J.Avila,L.M.Garcia-Segura,et al.Estradiol inhibits GSK3 and regulates interaction of estrogen receptors,GSK3,and betacatenin in the hippocampus.Mol.Cell.Neurosci,2004,25:363-373
