荧光碳纳米粒子的制备及其在细胞标记中的应用*
2011-02-07韩文英常云珍
韩文英,常云珍,高 飞
(山西大学 分子科学研究所 化学生物学与分子工程教育部重点实验室,山西 太原 030006)
自从Iijima发现碳纳米管[1]以来,纳米科技获得了飞速发展。以碳为基础的纳米材料,包括碳纳米管、纳米金刚石、富勒烯、纳米碳纤维和碳量子点等,在纳米技术、生物传感、生物标记以及作为药物载体等方面都有着潜在的应用价值[2-4]。碳纳米粒子(Carbon Nanoparticles,CNPs)作为一种新的碳纳米材料,也引起了人们的极大关注[5-8]。Sun等人曾用激光消蚀法[9]获得了多种尺寸的碳纳米颗粒,经表面钝化处理,使碳纳米颗粒发出了较强的可见光并用于生物标记。Zhou等人[10]以碳纳米管为原料,用电化学方法制备了粒径约为3 nm的碳纳米颗粒。但与碳纳米管、纳米金刚石和传统量子点的研究相比,荧光碳纳米粒子由于其制备方法和分离技术匮乏,迄今尚无较充分的研究,相关报道也较少。
在生物医学领域,常用传统有机荧光染料对细胞、生物分子进行染色或修饰标记。但传统有机荧光染料具有荧光寿命短、容易光解和褪色,且光解产物大多有毒有害,难以进行多色同时标记,生物相容性差等不足,使它们的应用受到限制。新型荧光标记试剂如复合型纳米粒子、量子点、金属纳米粒子标记物,克服了传统有机荧光染料的缺点,在生物和医学领域中得到广泛的应用[11-14]。荧光碳纳米粒子(CNPs)作为一种新的量子点,与传统有机染料相比具有明显的优越性:其水溶性好;毒性小;荧光强度高且稳定性好,可经受多次激发而不发生荧光淬灭,有利于研究细胞中生物分子间长期相互作用;不同粒径大小的碳纳米粒子具有不同的颜色,激发波长范围宽且连续分布,可用同一波长的光激发获得多种标记颜色;发射荧光谱峰窄且对称,不出现交叠,使生物分子的多组分检测变得容易。因而,CNPs是一种理想的新型荧光标记试剂。
本文制备了能够发荧光的碳纳米粒子并将其作为荧光标记物,对Hela细胞进行荧光标记,24 h后细胞仍然保持着很亮的荧光,显示出荧光碳纳米粒子很好的荧光稳定性。鉴于荧光碳纳米粒子具有上述诸多优点,可望应用于生物分子和细胞的染色、标记、检测等过程,在生物和医药领域具有重要的应用价值。
1 实验部分
1.1 仪器与试剂
双波长紫外线分析仪;RE-52A旋转蒸发器;美国PE LS-50B荧光光谱仪;IX 71荧光显微镜;FV1000激光共聚焦荧光显微镜;HF 160W水浴式CO2培养箱;DZKW-4电子恒温水浴锅;PHS-3C型酸度计。
蜡烛;30%H2O2;HAC;乙醚;胎牛血清(杭州四季青公司);DMEM培养基;胰酶;多聚甲醛;人宫颈癌Hela细胞(本实验室传代保存培养)。
自配溶液:PBS平衡液;0.25%胰酶溶液(含10%胎牛血清的DMEM溶液);MTT溶液;4%多聚甲醛溶液。
1.2 蜡烛烟灰的制备
首先将普通蜡烛焖烧,即将燃烧的蜡烛安放于倒置的坩埚中。蜡烛焖烧会产生浓烟,后者在倒置坩埚中形成烟炱,便于收集。在进行后续反应前,将烟炱用研钵磨细。
1.3 荧光碳纳米粒子CNPS的制备
称取0.5 g研细的烟炱置于250mL圆底烧瓶中,加入30%H2O270mL和35mL HAc[15],用超声波处理使其混合均匀,然后在恒温磁力搅拌器上加热回流。精细控制温度使体系缓慢升温,待液体微沸出现回流液滴时停止升温。回流持续一昼夜,体系变成黑色悬浮液。反应液冷却至室温并过滤,滤液为棕黄色。在紫外灯下可观察到明显的荧光。在荧光光谱仪上测定不同激发波长下滤液的荧光强度。将滤液旋转蒸发至5~8mL,过滤。滤液用乙醚洗涤萃取(5×15 mL),将萃取物旋转蒸发,真空干燥后得到较纯的产品CNPS。
1.4 Hela细胞最佳接种密度选择实验
选取对数生长期Hela细胞,用0.25%胰蛋白酶消化处理,离心收集细胞,制备成细胞悬浮液。将细胞接种到96孔培养板中,每孔加200μL细胞悬液,调节细胞密度分别为 5.0×103、1.0×104、1.5×104、2.0×104、2.5×104、3.0×104和 3.5×104个·mL-1,每孔细胞数分别为 1000、2000、3000、4000、5000、6000和7000个·孔-1。设空白调零孔(只加培养液,不加细胞),每组设6个平行孔,重复两次,在37℃、5%CO2培养箱中培养48 h。实验终止前4 h每孔加入 20 μL MTT溶液(5 mg·mL-1),继续培养 4 h。用移液枪小心吸弃培养液,每孔加入150 μLDMSO,低速振荡10min,使MTT深蓝色结晶物溶解,用酶联免疫检测仪测定在490nm波长下各孔的吸光度(A值),记录实验结果。绘制吸光度与细胞密度曲线,确定后续实验的最佳细胞接种密度。细胞吸光度值应在0~0.7范围内。
1.5 MTT比色法测定不同浓度CNPs对Hela细胞活性的影响
选取对数生长期Hela细胞,消化,离心收集细胞,制备成细胞悬浮液。计数调整细胞密度为2.0×104个·mL-1,接种到96孔培养板中,每孔加200μL细胞悬液,细胞数约为4000个·孔-1。另外设一个空白组(只加200μL培养液,不加细胞)。每组设6个平行孔,重复两次,在37℃、5%CO2培养箱中培养。20 h细胞贴壁后,吸去上清液,加入新的培养液,同时加入不同浓度的CNPs溶液,使其成为终浓度为0、50、100、150、200、250、300、350、400、450、500、550和 600μg·mL-1的 CNPs培养液,在 37℃、5%CO2培养箱中培养48h。实验终止前4h每孔加入20μL MTT溶液(5 mg·mL-1),继续培养 4 h。吸去培养液,每孔加入150μL DMSO,振荡 10 min,使深蓝色沉淀物充分溶解,用酶标仪测定各孔在490 nm波长下的吸光度(A值),记录结果。按照下列公式计算细胞生长活力:细胞活力(%)=(加药组A值平均值/对照组A值平均值)×100%。
1.6 用CNPS标记Hela细胞
选取对数生长期Hela细胞,消化,离心收集细胞,制备成细胞悬浮液。将细胞接种于放有盖玻片的培养皿中,细胞密度以5×104个·mL-1为宜,在37℃、5%CO2培养箱中培养。20 h细胞贴壁后,吸去上清液,加入浓度为 0、50、100、150μg·mL-1的CNPs培养液,在37℃、5%CO2培养箱中培养4 h。取出培养皿,吸去培养液,用1 mL PBS平衡液洗3次,每次浸泡1min。然后加入500μL4%多聚甲醛溶液,室温下固定8min,吸去多聚甲醛溶液,再用1mL PBS平衡液浸泡3次,浸泡时间依次为2、2、5min。向载玻片上滴一滴0.9%的甘油,将盖玻片挑出,晾干后放置于甘油上,注意须使盖玻片上长有细胞的一面朝向甘油放置,用指甲油封口,晾干,保存于4℃冰箱中。在激光共聚焦荧光显微镜下观察CNPs对细胞的标记情况。
2 结果与讨论
2.1 荧光碳纳米粒子的发光特性
蜡烛烟炱经 30%H2O2/ACOH(V/V=2∶1)混合液回流一昼夜后得到黑色悬浮液,过滤后滤液呈棕黄色。在紫外灯下可观察到明显的荧光。图1为回流液过滤后滤液的荧光光谱图。
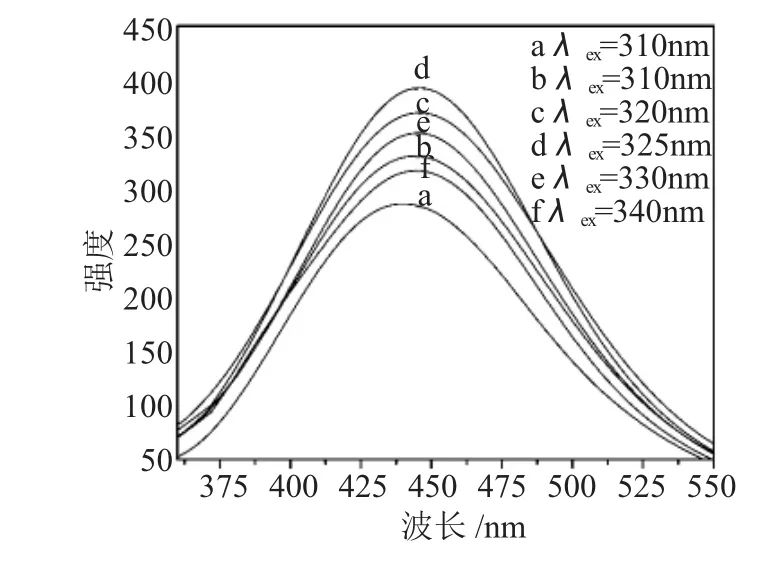
图1 不同激发波长下CNPS的荧光光谱图Fig.1 Fluorescence spectra of CNPS with different excitation wavelength
图1中6条谱线分别对应于不同的激发波长。由图1可知,荧光发射峰峰形对称、半峰宽较窄、具有较强的荧光。随着激发波长的增加,荧光强度是先增加后降低,最佳激发波长为325 nm,发射波长在445nm左右。
图2是不同pH值下CNPS的荧光光谱图。
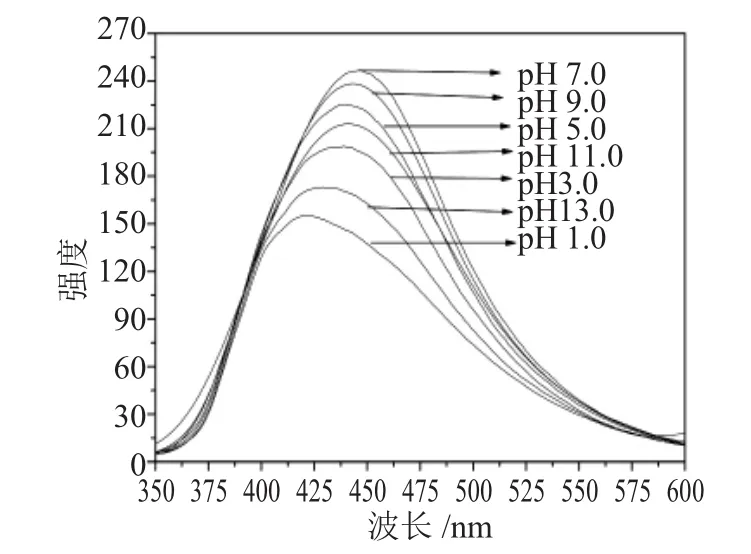
图2 不同pH值下CNPS的荧光光谱图Fig.2 Fluorescence spectra of CNPS in different pH value
将CNPS用三蒸水溶解配制成一定浓度的CNPS溶液,在不同pH值下测定其荧光强度。7条谱线分别对应于不同的pH值。由图2可知,随着pH值增大,CNPS溶液的荧光强度表现为先增后减,并且在pH值为7.0附近时溶液的荧光强度最大。此结果对于CNPS能够作为荧光标记物应用于细胞和生物医学领域具有重要价值。
在制备荧光碳纳米粒子过程中,用氧化剂回流蜡烛烟炱,其作用可能是破坏了碳纳米粒子间的相互作用,使之有利于形成较为分散的纳米晶粒,同时在粒子表面引入-OH、-COOH或其它氧化基团,使其带负电性和具有亲水性。氧化剂处理后得到的碳纳米粒子与原蜡烛烟炱的化学成分有所不同,氧化后的CNPS中氧含量明显增高,有羰基出现,这些结果得到红外光谱的支持。
图3为CNPs的红外光谱图。

图3 CNPs的红外光谱图Fig.3 IR spectrum of CNPs
图3中数字显示的是吸收峰的波长,在1735cm-1处有一强吸收峰。而大部分的羰基化合物是在1650~1900 cm-1,且羰基峰都尖锐或稍宽,其强度都较大,所以图中1735cm-1处应该是羰基峰。利用氧化剂处理碳纳米材料的方法业已广泛用于碳纳米管的表面修饰和功能化[9]。我们在实验中选用了H2O2作为氧化剂,其反应产物为水,属于绿色型试剂,对环境无污染,是理想的氧化剂。
2.2 Hela细胞最佳接种密度选择结果
为了得到Hela细胞在后续实验中的最佳密度,我们首先通过细胞密度筛选实验来确定实验最佳接种密度。MTT法得出细胞密度分别为5.0×103、1.0×104、1.5×104、2.0×104、2.5×104、3.0×104和 3.5×104个·mL-1时Hela细胞在490 nm处的吸光度值。从吸光度与细胞密度曲线图中可以看出,Hela细胞密度为2.0×104个·mL-1时处于曲线线性部位,且吸光度在0~0.7之间(如图4所示),故选取细胞的接种密度为2.0×104个·mL-1,后续实验中均采用此密度值。
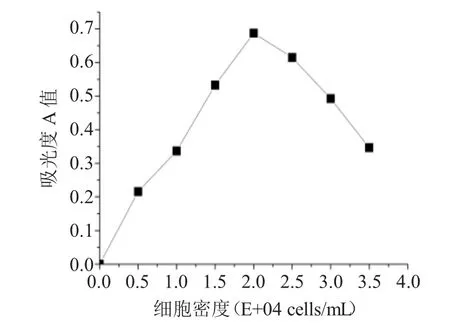
图4 Hela细胞接种密度与吸光度关系Fig.4 The relationship of Hela cells density of inoculation and OD value
2.3 不同浓度CNPs对Hela细胞活性的影响
为了研究CNPs对Hela细胞生长活性的影响,我们首先选择MTT法来检测CNPs对Hela细胞的细胞毒性作用。利用不同浓度的CNPs培养液孵育细胞48h,用酶标仪测定各孔在490 nm波长下的吸光度A值,实验结果见图5。
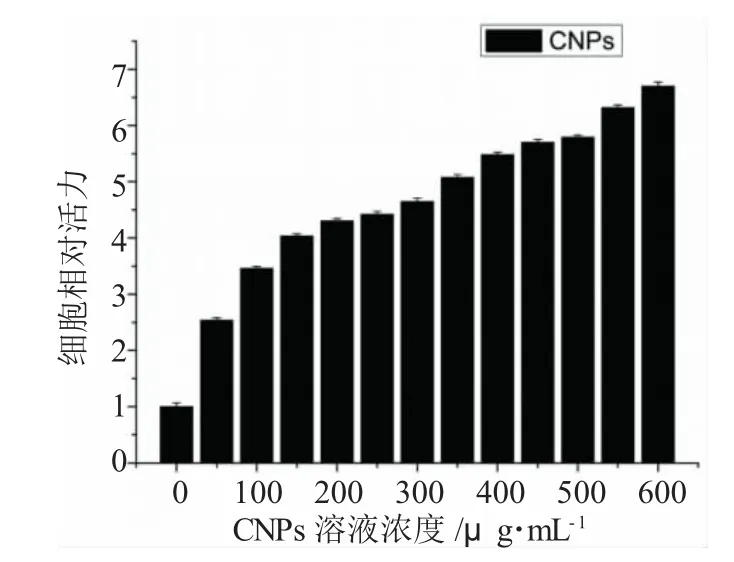
图5 不同浓度CNPs溶液作用Hela细胞48h后对应的细胞相对活力图Fig.5 The relative cell viability of Hela cells that incubated with different concentrations of CNPs solution after 48h
结果表明,不同浓度CNPs溶液处理Hela细胞48h后,细胞代谢MTT的能力增加,说明CNPs对Hela细胞具有明显的促进作用,并且细胞生长率随CNPs浓度的升高而增高,CNPs对Hela细胞没有毒性作用,而且CNPs能够促进Hela细胞的生长。
2.4 激光共聚焦荧光显微镜成像图像分析
图6为不同浓度CNPS溶液对HeLa细胞进行荧光标记。

图6 不同浓度CNPs溶液对HeLa细胞荧光标记图像Fig.6 The fluorescent labeling images of Hela cells with different concentrations of CNPS
作用4h后固定细胞的激光共聚焦荧光显微镜成像照片。图a~d分别对应质量浓度为0、50、100、150μg·mL-1的CNPS溶液作用于HeLa细胞4h后在高倍镜下的成像照片。图e是质量浓度为100 μg·mL-1的CNPS溶液作用HeLa细胞4h后在低倍镜下的成像照片。图b~e中HeLa细胞在488nm的蓝光激发下呈现出明亮的绿色荧光图片,表明可以通过荧光碳纳米粒子实现对HeLa固定细胞的直接染色标记。标记的固定细胞在4℃冰箱中放置24 h后在荧光倒置显微镜下观察,细胞仍然保持着很亮的荧光,表明荧光碳纳米粒子具有很好的荧光稳定性。
3 结论
本文用氧化剂回流蜡烛烟炱,制备了荧光碳纳米粒子,并用不同浓度的荧光碳纳米粒子对Hela细胞进行了荧光标记,结果表明荧光碳纳米粒子能很好地对细胞进行长时间荧光标记,具有较强的荧光稳定性。荧光碳纳米粒子具有无毒、化学惰性和良好的生物相容性等优点,且可进行多色标记,发光强度高,光化学稳定性好,它有望替代传统的有机荧光染料,实现对细胞、生物分子的染色或修饰标记,进行高灵敏度和高通量细胞和分子鉴别、测量分析等的研究。
目前,荧光碳纳米粒子的研究尚属初级阶段,对氧化回流获得的CNPs发光机理也有待研究。可以说,这一领域是一片尚未充分探索的蛮荒地带,存在诸多问题有待解决。例如,不同氧化剂能否改变粒子的荧光性质?初始蜡烛烟炱的微观结构对碳纳米粒子的发光性质有何影响?如何进一步提高CNPs的发光效率?虽然这一新材料仅仅初显峥嵘,但其不同凡响的特性昭示着它会在许多领域获得应用。我们相信,这一领域必将涌现出更多新的、令人神往的发现和灿烂的前景。
[1]Iijima S.Helical microtubules ofgraphitic carbon[J].Nature,1991,354:56-58.
[2]Kam N W S,Liu Z,Dai H J.Functionalization of carbon nanotubes via cleavable disulde bonds for efcient intracellular delivery of si-RNAand potent gene silencing[J].J.Am.Chem.Soc.,2005,127(36):12492-12493.
[3]Fu C C,Lee H Y,Chen K,et al.Characterization and application of single fluorescent nanodiamonds as cellular biomarkers[J].PNAS,January,2007,16:727-732.
[4]Li Z H,Wang K,Tan W H,et al.Preparation of luminescent CdTe quantum dots doped core-shell nanoparticle sand their application in cell recognition[J].Chinese Science Bulletin,2005,50(13):1318-1322.
[5]姚延立,马国利,伊厚会,王晓敏.制备粒径均匀碳纳米颗粒的研究[J].滨州学院学报,2009,25(3):54-57.
[6]张阳德,张彦琼,陈记稷,等.壳聚糖-碳纳米粒的制备及其体外性质的研究[J].中国现代医学杂志,2006,16(6):13-18.
[7]张阳德,肖志刚,张浩伟,等.载药纳米粒在肝癌靶向治疗中的研究进展[J].中国医学工程,2005,13(6):609-613.
[8]谢华清.壳状碳纳米颗粒的制备和分散[J].新型碳材料,2007,22(1):80-83.
[9]Sun YP,Zhou B,Lin Yet al.Quantum-sized carbon dots for bright and colourful photoluminescence[J].J.Am.Chem.Soc.,2006,128:7756-7757.
[10]Zhou J,Booker C.,Li R.et al.An electrochemical avenue to blue luminescent nanocrystals from multiwalled carbon nanotubes(MWCNTs)[J].J.Am.Chem.Soc.,2007,29(1):744-745.
[11]Bmchez MJ,Moronne M,Gin P,et al.Semiconductor nanocrystals as f1uorescent biological labels[J].Science(S0036-8075),1998,281:2013-201.
[12]Han M Y,Gao X H,Su J Z,Nie S M.Quantum-dot-tagged microbeads for multiplexed optical codingofbiomolecules[J].Nature Biotechnology,2001,19(7):631-635.
[13]James A.J.Fitzpatrick,Susan K.Andreko,Lauren A.Ernst,et al.Long-term persistence and spectral blue shifting of quantum dots in vivo[J].NanoLetters,2009,(9):2736-2741.
[14]Cao L,Wang X,Sun Y Pet al.Carbon dots for multiphoton bioimaging[J].J.Am.Chem.Soc.,2007,129:11318-11319.
[15]Liu H,Ye T,Mao C.Fluorescent carbon nanoparticles derived fromcandlesoot[J].Angew.Chem.Int.Ed.,2007,46:6473-6475.
