CYP2C19基因多态性在江苏及其周边地区汉族人群的调查研究
2011-02-06顾连云
顾连云,赵 萍
(南京医科大学第一附属医院,江苏南京,210029)
人细胞色素P450酶(Cytochrome P450)主要存在肝微粒体中,由3部分组成:血红素蛋白,黄素蛋白和磷脂。约有30多个CYP450同工酶参与药物的代谢,占主导地位的酶类有 4种:CYP2D6,CYP3A4,CYP1A2 和 CYP2C19。CYP2C19是CYP450超家族的一种同工酶,在药物代谢中有重要作用,代谢降解40%~50%的药物[1-3]。主要参与代谢的药物有:质子泵抑制剂、三环类抗抑郁药、抗癫痫药、抗精神病药、降糖药、抗凝药、抗疟疾药以及一些抗癌药物等[4-7]。
CYP2C19药物代谢有个体差异,而个体差异主要受遗传因素与环境因素的共同影响。约14.3%的中国人和3.5%的欧洲人CYP2C19酶的功能降低或缺失。因此CYP2C19酶的活性在人群中呈现二态分布,即弱代谢者和强代谢者。到目前为止,已发现CYP2C19 m1~CYP2C19 m7突变等位基因,影响该基因的正常表达,致使CYP2C19酶的功能降低甚至缺失。所有突变等位基因是CYP2C19遗传多态性的分子生物学基础。其遗传多态性也存在种族差异,在中国汉族人群中,CYP2C19基因突变的类型主要是CYP2C19*2和CYP2C19*3两型。CYP2C19*1为野生型基因,有催化活性,其余突变型均无催化活性。CYP2C19*2和CYP2C19*3在亚洲发生的突变频率较高,与药物代谢个体差异有很大关联,是东方人慢代谢表型的主要遗传突变类型,也是目前研究较深入的一类药物代谢酶[8-9]。尽管CYP2C19占人肝微粒体CYP450的含量较小(0.8%~1.4%),但其酶缺陷在东方人中高达15%~23%,成为其酶代谢底物产生药物效应个体差异和种族差异的主要原因,是药物代谢酶分子遗传药理学研究领域中最为关注的靶目标之一。已有许多临床研究认为CYP2C19基因多态性对其相关底物的药动学和药效学有一定影响,CYP2C19基因型可能是预计疾病恢复或愈合的决定因素[2,10]。因而CYP2C19基因多态性对于这些底物的治疗优化或个体化可能会非常有用。本研究旨在了解江苏及其周边地区汉族人群CYP2C19的基因多态性的分布情况,为进一步探讨临床中CYP2C19基因多态性与药物敏感性的个体化用药方案提供资料。
1 资料与方法
1.1 研究对象
江苏省人民医院体检的无血缘关系的健康人,共 81例,均为汉族人,无慢性疾病史,经过一般体检、肝肾功能、血尿便常规、心电图、胸片、乙型肝炎免疫指标检查正常。入选者3月内未参加任何临床药物试验,试验开始前1周内未服用任何药物,遵从临床药物试验研究过程规定,签署书面知情同意书。男42例,女39例,年龄(29.5±6.8)岁。
1.2 试剂和仪器
上海博彩PCR产物回收试剂盒,内切酶BamH Ⅰ和SmaⅠ,西班牙琼脂糖;离心机(Eppendorf 5415D,德国);凝胶电泳图像分析系统(JD801,江苏省捷达科技发展有限公司)。脱氧核苷三磷酸(dNTP)、10×PCR反应缓冲液、Taq DNA聚合酶、镁离子(日本 Toyobo公司);引物(上海生工生化公司);DNA分子量标记(Marker)、限制性内切酶缓冲液(Loading Buffer,美国Promega公司);PCR仪(PTC-200,美国MJ Research公司);电泳仪(D IY210C,北京六一仪器厂)。
1.3 CYP2C19基因型分析
1.3.1 CYP2C19 DNA扩增:全血基因组DNA的提取及纯度测定:采用 DNA提取试剂盒(Promega公司,美国)进行DNA抽提。PCR扩增:以研究对象外周血提取的基因组DNA为模板,设计以下引物为实验引物序列:
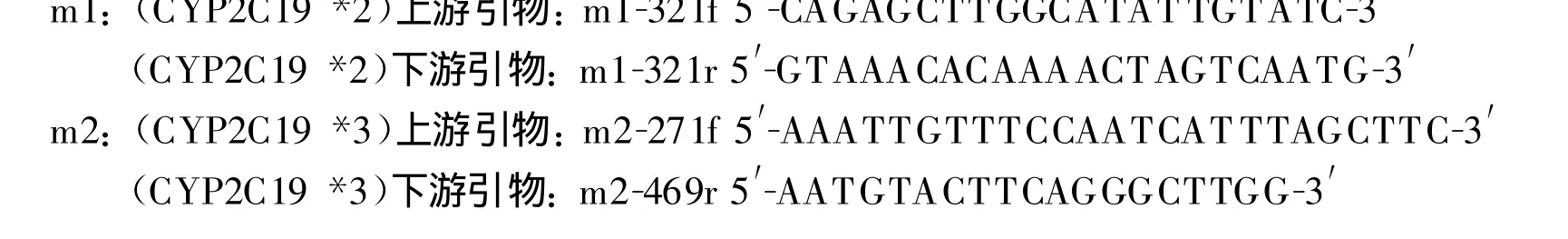
PCR 反应 体 系 20 μ L, 水 14.5 μ L;10 ×Buffer 2 μ L;10 mmol/L dNTP 0.4 μ L;10 μ mol/L 的上 、下游引物各 1 μ L;DNA Taq polymerase 0.2 μ L;DNA 1 μ L。反应参数为:95 ℃ 预变性5 min,94℃变性30 s,50℃退火30 s,72℃延伸1 min,共30个循环,最后72℃延伸5 min。扩增参数为:95℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,共30个循环,最后72℃延伸5 min。选取扩增特异性良好的PCR样本进行PCR产物回收,分别用限制性内切酶BamH Ⅰ和SmaⅠ进行酶切反应。3%琼脂糖凝胶电泳,应用凝胶成像系统进行成像处理。典型PCR图分别见图1、2、3。
2 结 果
2.1 CYP2C19基因片段的酶切及受试者CYP2C19基因型的判定
CYP2C19 m1的等位基因扩增得到169 bp的片段,用限制性内切酶SmaⅠ经3 h酶切后,据酶切结果可判定关于CYP2C19 m1等位基因的CYP2C19基因型,CYP2C19 m2的等位基因扩增得到329 bp的片段,用限制性内切酶BamHI经3 h酶切后,据酶切结果可判定关于CYP2C19 m2等位基因的CYP2C19基因型,两者结合的等位基因测定结果可判定受试者的 CYP2C19基因型。

图1 PCR扩增产物图

图2 CYP2C19ml基因结果图

图3 CYP2C 19m2基因结果图
3.2 CYP2C19基因型分布状况
81例样本CYP2C19的基因型经PCR-RFLP法检测,统计结果见表1。分别针对CYP2C19*2、*3 2个等位基因突变点进行基因型分析,PMs有3种基因型(CYP2C19*2/*2,*2/*3或*3/*3),EMs有2种基因型,为纯合子(*1/*1)和杂合子(*1/*2或*1/*3)。根据每个志愿者的2种基因变异结果,81名志愿者中纯合子EMs组 31例,占38.3%;杂合子EMs组37例,占45.7%;PMs组 13例,弱代谢型所占比例约为16.0%。
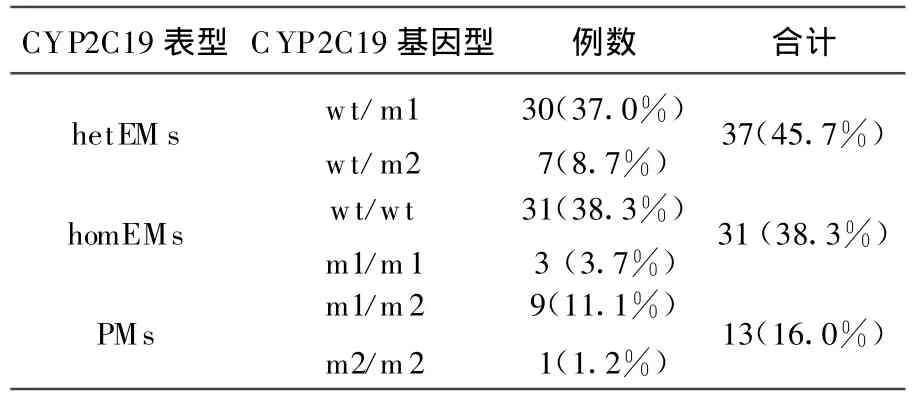
表1 CYP2C19基因型及表型的统计结果
3 讨 论
基因突变的多样性决定了其表型的多样性,等位基因的突变使酶活性降低,对药物代谢的能力随着等位基因的不同组合而呈现出一定的规律性,表现出正常基因纯合子、正常基因与突变基因杂合子、突变基因纯合子或杂合子的变化趋势。CYP2C19的基因多态性分布具有明显的种族和地域差异。中国是一个幅员辽阔的多民族国家,在遗传背景大致相似的基础上又有各自的特色[1,8]。中国人群的 CYP2C19变异主要是CYP2C19*2和CYP2C19*3两型,这 2种变异几乎涵盖了中国人所有的PM。由于CYP2C19*3的存在,使PM在中国人中的发生率较高,达到15%~17%。本试验中,作者对81例健康志愿者进行CYP2C19基因型的分析,PM的发生率是16.0%(13/81)。
CYP2C19基因多态性影响其相关底物的药动学和药效学,因而产生不同的药物临床疗效[2],因此CYP2C19基因型的检测是必要的,它可能是临床优化相关药物治疗作用的一种有用的工具,它可使临床医生决定药物的选择、治疗剂量和疗程,以及选择最佳的联合治疗方案,对研究CYP2C19基因多态性与疾病、药物疗效、毒副作用的相关性有一定参考价值。从图1可见,江苏及周边地区的弱代谢的比例低于蒙族人(33.3%)及海南黎族人(15%),高于独龙族(11.2%),布依族(10.2%),苗族(9.2%),土族(9.0%),藏族(8.7%)和维吾尔族(4.17%)等[9-14]。说明CYP2C19的基因多态性分布是具有种族和地域差异的。
近年来基因导向个体化治疗已在临床应用,对指导临床用药极为重要。由于药物反应存在个体差异,部分患者会导致治疗失败,部分患者甚至会因不良反应而死亡等。在美国约有0.32%的住院患者因药物不良反应而死亡,在各类死亡原因中药物不良反应死亡排名第4~6位[2]。基因导向个体化治疗不仅可以预防上述情况发生,还可以帮助患者以最小的药物剂量而获取最佳的治疗效果,真正体现出“因人用药,量体裁衣”的原则。CYP2C19酶的活性还受许多药物诱导或抑制酶的影响,如:巴比妥类、炔诺酮、利福平、泼尼松为诱导剂;西咪替丁、苯丙氨酯、氟西汀、帕罗西汀、氟伏沙明、吲哚美辛、酮康唑、奥美拉唑为抑制剂,它们之间也存在相互作用,对其疗效的影响也应慎重考虑,因此在临床联合用药时如何调整药物剂量仍有待进一步研究[15-17]。
[1] 付良青,黄丰,吴德政,等.中国汉族人群不同性别细胞色素氧化酶CYP2C19基因多态性的比较[J].药学学报,2004,39(3):161.
[2] 郑露,邵建国.CYP2C19的基因多态性与临床[J].第二军医大学学报,2007,28(11):1262.
[3] 张莉蓉,张伟,阴振坤,等.河南地区汉族人群药物代谢酶和基因多态性分析(英文)[J].中国新药与临床杂志,2006,25(8):561.
[4] Sim S C,Risinger C,Dahl M L,et al.A common novel CYP2C19 gene variant causes ultrarapid drug metabolism relevant for the drug response to proton pump inhibitors and antidepressants[J].Clin Pharmacol Ther,2006,79:103.
[5] Kirchheiner J,Nickchen K,Bauer M,et al.Pharmacogenetics of antidepressants and antipsychotics:the contribution of allelic variations to the phenotype of drug response[J].Mol Psychiatr,2004,9:442.
[6] T akada K,Arefayene M,Desta Z,et al.Cytochrome P450 pharmacogenetics as a predictor of toxicity and clinical response to pulse cyclophosphamide in lupus nephritis[J].Arth Rheum,2004,50:2202.
[7] Li Y,Hou J,Jiang H,et al.Polymorphisms of CYP2C19 gene are associated with the efficacy of thalidomide based regimens in multiple myeloma[J].Haematol.2007;92:1246.
[8] 周健,吕虹,康熙雄.中国汉族人群不同性别、年龄、体重指数之间细胞色素氧化酶CYP2C19基因多态性的检测[J].中国临床药理学与治疗学,2007,12(2):208.
[9] 牛春燕,关丽,罗金燕.维吾尔族健康人群CYP2C19基因多态性分析[J].新疆医科大学学报,2005,28(3):247.
[10] 胡咏梅,梅俏,许建明.安徽省汉族人群 CYP2C19基因多态性的调查研究[J].安徽医药,2007,11(8):717.
[11] 付良青,黄丰,吴德政,等.中国汉族和蒙族人群细胞色素氧化酶CYP2C19遗传多态性的比较[J].中国临床药理学与治疗学,2003,8(5):551.
[12] 叶峻杰,彭林,张松,等.中国独龙族人群中基因多态性的分布[J].中国新药杂志,2004,13(3):266.
[13] 付琼瑶,李佩琼,王九辉,等.海南黎族人群细胞色素P450 2C19基因多态性的研究[J].中国热带医学,2005,5(9):1087.
[14] 周健,吕虹,康熙雄.中国汉族人群不同性别、年龄、体重指数之间细胞色素氧化酶CYP2C19基因多态性的检测[J].中国临床药理学与治疗学,2007,12(2):208.
[15] Klotz U.Clinical impact of CYP2C19 polymorphism on the action of proton pump inhibitors:a review of a special problem[J].Int J Clin Pharmacol Ther,2006,44:297.
[16] Yasui Furukori N,Takahata T,Nakagami T,et al.Different inhibitory effect of fluvoxamine on omeprazole metabolism between CYP2C19 genotypes[J].Brit J Clin Pharmaco,2004,57(4):487.
[17] Qiao H L,Hu Y R,Tian X,et al.Pharmacokinetics of three proton pump inhibitors in Chinese subjects in relation to the CYP2C19 genotype[J].Eur J Clin Pharmacol,2006,62:1.
