心肌炎后大鼠左心室重构的实验研究
2011-02-06张振刚
李 伟,张振刚
(扬州大学第二临床医学院江苏省扬州市第一人民医院心血管内科,江苏扬州,225001)
心肌炎(嗜心肌病毒感染或自身免疫性炎症)导致的扩张型心肌病(DCM)日益受到重视。Jay W Mason提出了心肌炎的三步级联学说,阐述了心肌炎和DCM的内在联系,即由急性炎症反应期,自身免疫介导的慢性迁延期,心肌纤维化、心室重构的三阶段模式导致DCM的发生[1]。因而,在心肌炎向DCM的转化过程中炎症因子相关的左心室重构起到了至关重要的作用。
NF-κ B能调控免疫应答、炎症反应、细胞分化和生长、细胞黏附和细胞凋亡所必需的许多细胞因子、黏附因子,它可以启动和调节这些基因的转录,在机体的免疫应答、炎症反应等方面发挥重要作用,因而推测NF-κ B在心肌炎后的左心室重构进程中可能存在重要作用。本实验着重观察了大鼠心肌炎后左心室重构、心功能及外周血中炎症细胞因子水平的变化,并初步探究其机制是否部分通过NF-κ B来调控,从而为研究药物的作用靶点及机制,延缓心肌炎向DCM转化的疾病发展过程提供一定的依据。
1 材 料
7周龄SPF级雄性Lewis大鼠 28只,体质量130~170 g,购于北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2002~0003。饲养在屏障系统中(温度22~26℃,湿度50%~60%),自由饮用纯净水和食用标准合成的大鼠饲料。猪心肌球蛋白(编号:M-0531)、弗氏完全佐剂(编号:F-5881)、多聚赖氨酸、Ⅰ型、Ⅲ型胶原单克隆抗体购自Sigma公司;小牛血清购自杭州四季青生物工程材料有限公司;HRP标记的羊抗鼠IgG购自华美生物工程公司;SABC免疫组化试剂盒(羊抗鼠)购自武汉博士德生物工程有限公司;细胞因子试剂盒购自美国RB公司;细胞及组织总蛋白抽提试剂、NF-κ B Pathway Activation试剂盒购自上海康成生物公司。550型酶标仪(Beckman),4℃离心机:SIGMA,核酸蛋白定量仪(德国Eppendorf),IBAS 2.5全自动图像分析仪(德国Kontron),BX15型显微镜(日本Olympus),病理图文分析系统(瑞医RY-2000)。
2 方 法
2.1 模型制备与实验分组
模型组(14只),参照文献[2]方法,用猪心肌球蛋白免疫大鼠制备EAM模型;正常对照组(14只):于同时间同部位注射等体积生理盐水。实验直至结束,EAM模型组共存活了13只大鼠。
2.2 心脏结构和功能的评估
实验第 70天应用超声心动图仪(型号:PHLIP Sequoia C256,探头频率:3~5 MHz)行心脏检查。大鼠禁食12 h,禁饮2 h后,用氯氨酮50 mg/kg+安定5 mg/kg腹腔注射进行麻醉后测量左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、缩短分数(FS)、左室射血分数(LVEF);测量3个连续心动周期的图像,取平均值。
2.3 左心室重量和左心室质量指数的评估
心脏由滤纸轻吸后沿房室环剪去心房及右心室游离壁称量读数即为左心室重量(LVW)(单位mg),左心室质量指数(LVMI)(单位mg/g)由左心室重量(mg)/大鼠体重(g)得出。
2.4 组织学镜检
称重后将心脏分成心尖部,中间部和心底部三部分。中间部心肌做冰冻切片行Ⅰ型和Ⅲ型胶原检查,心尖部分用液氮罐冻存。
2.5 血清中 TNF-α、IL-1、MCP-1 的检测
血清中 TNF-α、IL-1、MCP-1的测定采用ELISA法。按照试剂盒说明书操作,酶标仪450 nm处测OD值,绘制标准曲线,计算样品中TNF-α、IL-1、MCP-1 的浓度。
2.6 心肌组织NF-κ B活性测定
核蛋白提取方法如下:取液氮冻存心尖组织,4℃PBS溶液中解冻后称重,每250 mg组织中加入1mL蛋白质抽提试剂(1 mL抽提试剂中加入5 μ L蛋白酶抑制剂混合液,5 μ L PMSF和5 μ L磷酸酶抑制剂混合液),匀浆器低速匀浆,4℃14 000 g离心15 min后收集上清,-80℃保存。样品蛋白浓度采用核酸蛋白定量分析仪测定。采用ELISA法测定NF-κ B的活性,按照试剂盒说明书操作。
3 实验结果
3.1 心脏结构和功能
如表1和图1所示,与Control组相比,EAM组LVEDD、LVESD均明显增加(P<0.01),LVEF明显下降(P<0.01)、FS也下降(P<0.05)。
表1 心肌炎后大鼠心脏超声参数的变化(n=27,±s)
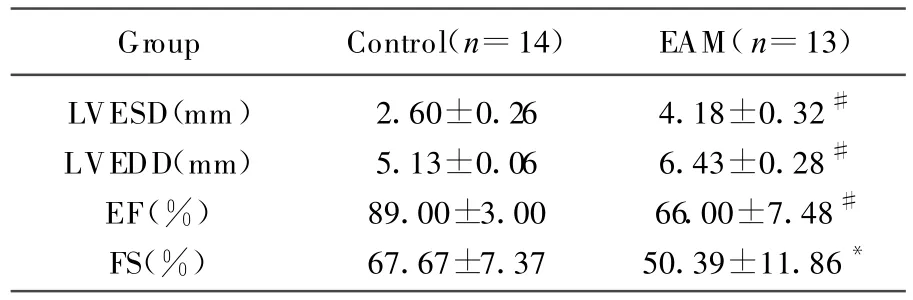
表1 心肌炎后大鼠心脏超声参数的变化(n=27,±s)
注:与正常对照组相比,*P<0.05,#P<0.01
Group Control(n=14) EAM(n=13)LVESD(mm) 2.60±0.26 4.18±0.32#LVEDD(mm) 5.13±0.06 6.43±0.28#EF(%) 89.00±3.00 66.00±7.48#FS(%) 67.67±7.37 50.39±11.86*
图1 各组大鼠的彩超评估
3.2 左心室重构质量指数的评价
EAM组LVW相比于Control组明显增加(P<0.01),而 EAM 组LVMI相比于Control组亦明显增加(P<0.01)。见表2。
表2 各组左心室重量及左心室质量指数(即左心室重量/体重)的变化(n=27,±s)

表2 各组左心室重量及左心室质量指数(即左心室重量/体重)的变化(n=27,±s)
注:与正常对照组相比,#P<0.01。
Group Control(n=14) EAM(n=13)LVW(mg) 787.63±51.28 921.89±70.84#LVMI(mg/g) 1.80±0.10 2.27±0.12#
3.3 免疫组化法染色胶原纤维
图2和图3显示:Control组心肌细胞间和血管周围见少量棕黄色Ⅰ、Ⅲ型胶原纤维;与Control组相比,EAM组Ⅰ、Ⅲ型胶原均呈明显增生分布(P<0.01),其中Ⅰ型多于Ⅲ型,Ⅰ/Ⅲ比值均增加(P<0.01);见表3。
表3 心肌Ⅰ、Ⅲ型胶原面积(×104)及Ⅰ/Ⅲ比值的比较(±s,n=27)

表3 心肌Ⅰ、Ⅲ型胶原面积(×104)及Ⅰ/Ⅲ比值的比较(±s,n=27)
注:与正常对照组相比,#P<0.01。
Group Control(n=14) EAM(n=13)CollagenⅠ 3.45±1.61 25.80±2.02#CollagenⅢ 2.37±1.41 7.07±0.65#Ⅰ/Ⅲ 1.57±0.38 3.67±0.42#
3.4 外周血清中细胞因子浓度变化
与 Control相比,EAM 组 TNF-α、IL-1、MCP-1的浓度明显升高(P<0.01),见表4。
表4 各组大鼠血清中细胞因子的水平(n=27,±s)

表4 各组大鼠血清中细胞因子的水平(n=27,±s)
注:与正常对照组相比,*P<0.05,#P<0.01。
Group(pg/mL) Control(n=14) EAM(n=13)TNF-α 76.67±13.50 211.58±66.23#IL-1 81.20±49.09 821.88±326.08#MCP-1 103.55±24.55 207.17±75.37*
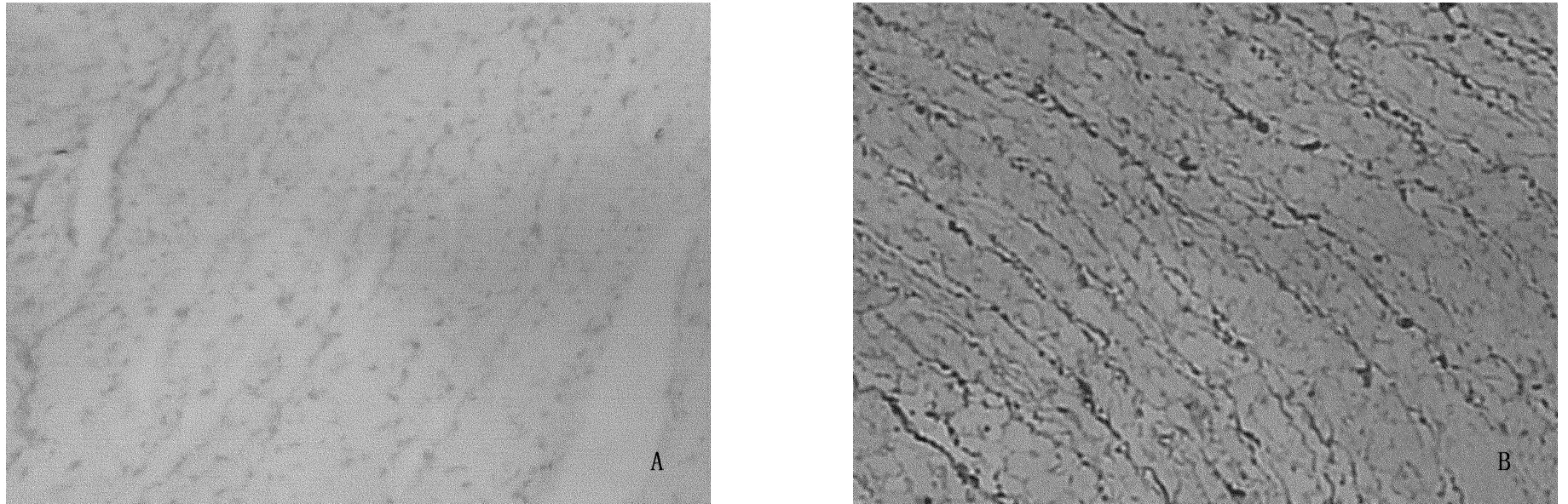
图2 大鼠心肌组织Ⅰ型胶原染色 200倍
3.5 各组心肌组织NF-κ B活性的变化
Control组心肌NF-κ B活性很低,EAM 组中活化的NF-κ B升高(P<0.01);见图4。
4 讨 论
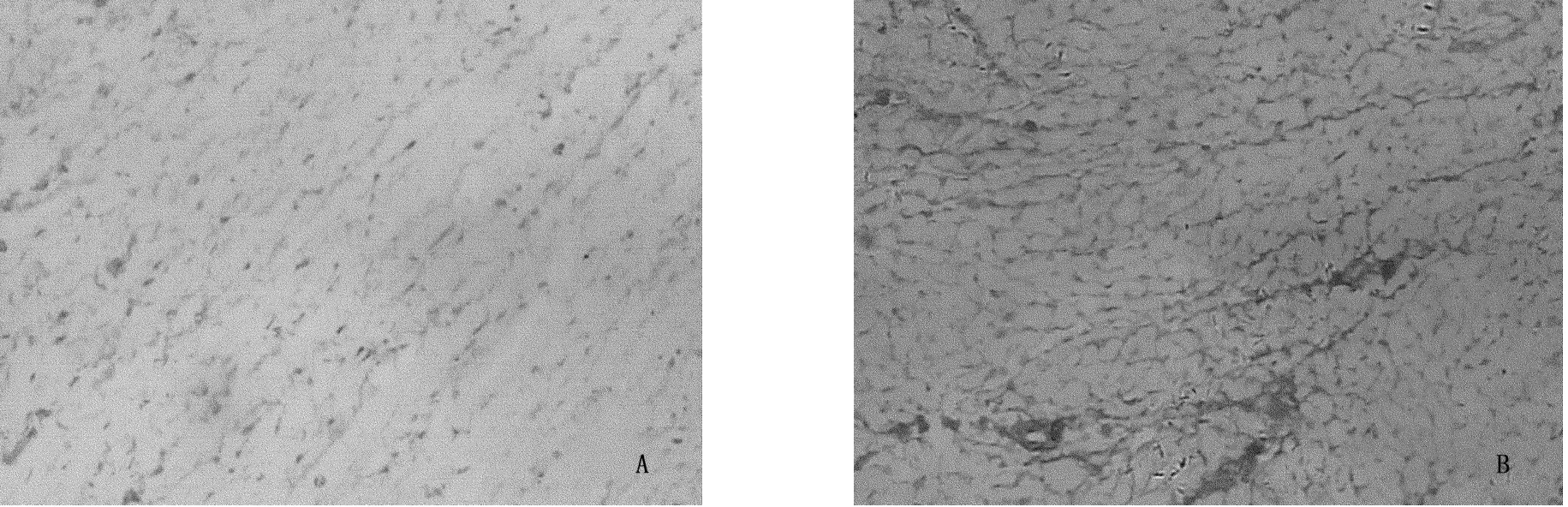
图3 大鼠心肌组织Ⅲ型胶原染色 200倍
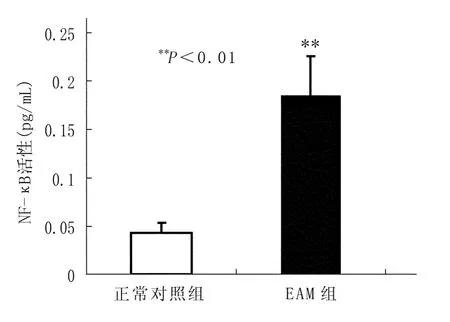
图4 大鼠心肌组织NF-κ B活性的变化
心肌炎和扩张型心肌病至今发病机制不清,大量国内外实验研究均集中在急性期阶段,认为抑制急性期相关指标能缓解症状延缓疾病进展;然而除重症心肌炎或有明显临床症状的心肌炎患者外,部分心肌炎开始无特异症状,待临床上发现时多已出现早期心脏结构、大小的改变或晚期心力衰竭的症状,所以研究心肌炎后的左心室重构是有临床意义的。
实验中观察到EAM大鼠出现少动,倦怠,易激惹,足部陆续出现溃疡,部分还出现踝关节肿胀;第28天血清中出现抗肌球蛋白抗体;第70天后发现EAM大鼠心脏呈灰白色,弹性差,心脏体积增大,LVW和LVMI增加,随后的免疫组化染色显示EAM大鼠心肌间质胶原纤维显著增生,提示EAM大鼠发生了左心室重构。此时实验中EAM大鼠外周血清中促炎细胞因子TNF-α、IL-1、MCP-1亦显著增加。这是因为心肌特异性自身免疫反应的起始依赖于将抗原呈递给T细胞以及DC的活化。在免疫反应中针对的抗原主要是心肌肌球蛋白[3],肌球蛋白释放后,被抗原提呈细胞吞噬,在共刺激分子的辅助下,激活了针对心肌肌球蛋白的自身反应性T细胞,释放炎症细胞因子如 TNF-α[4-5]、IL-1 、IL-2 、MCP-1、INF-γ等共同促进心肌间质的抗原提呈细胞上调MHC分子的表达,增加了心肌肌球蛋白α重链表位的提呈能力,因而心脏固有淋巴细胞和浸润淋巴细胞的活化以及局部细胞因子的释放,形成了一个炎症环境,导致免疫反应的起始和维持,自身反应性CD4+T细胞、CD8+T细胞和巨噬细胞被募集到心肌周围及实验免疫的部位,发挥致病效应;另外补体系统、粒细胞、树状突细胞、B细胞、肥大细胞的激活[6]和自身抗体的产生在心肌炎的进展过程中亦起一定作用。在实验中TNF-α能降低左室功能,导致左室重塑及代谢消耗、微血管内凝血[7];MCP-1又可以造成 IL-1、IL-2、INF-γ、TNF-α等炎症因子趋化聚集在炎症周围,加重炎症反应,故而第70天彩超提示EAM组大鼠左心室扩大,心脏收缩力下降,这与Horii[8]和 Yuji Okura[9]的结果相符合;此外,心脏浸润的免疫细胞及它们的产物,如活性氧簇、细胞因子、蛋白酶(包括基质金属蛋白酶)、抗体等,损伤心肌细胞并导致细胞外基质改变。当调节机制失代偿时,心肌间质细胞表型改变,成纤维细胞增殖,细胞外基质(ECM)成分分泌异常增多[10],局部损伤导致心肌细胞机能障碍和死亡、替代性纤维变性以及心功能障碍,从而一定程度上造成了心肌炎后心肌纤维化,心室重构的表现。既往的实验表明TNF-α在该模型中至关重要,赵培等研究显示在急性期TNF-α浓度极高[11],在本实验中TNF-α虽较正常组明显升高,但浓度较急性期是下降的,那么后期的病理改变除了TNF-α的重要作用外,可能还与IL-1相关,从结果中看到实验结束时IL-1的浓度还较正常组高了10倍左右,并没有因为后期急性炎症的消退而明显下降,由此看出后期心室重构与IL-1的持续引起心肌细胞肥大,细胞坏死和细胞凋亡,同时产生负性肌力作用造成心功能的下降有关;心肌炎症产生的IL-1、TGF-β等能调控MMPS,诱导MMPs基因表达,使其活性升高,引发心肌胶原的降解[12],MMPs/TIMPs的平衡遭到破坏后,心肌胶原的合成增多,胶原的成分比例发生改变,Ⅰ型、Ⅲ型胶原增生,左心室重构形成。
由上看出心肌炎后左心室重构的过程十分复杂,不仅仅是抑制一种或几种炎症因子就能阻止其进展的,在这整个过程中,炎症因子的合成、释放必然要经历一个由胞膜到胞浆,再由胞浆到胞核的信号传导过程,最后必须再经过核内传递才能诱导相关炎性基因的表达,而NF-κ B正是此过程的核心[13-14]。实验发现正常对照组心肌NF-κ B活性很低,EAM 组NF-κ B的活性要高于正常对照组,NF-κ B是一种活跃的转录因子,参与多种炎症介质和细胞因子基因的表达调控,在静息状态下NF-κ B与其天然抑制因子Iκ B结合存在于胞质内,当细胞受到刺激后Iκ B被磷酸化,随之被泛素化蛋白小体降解释放NF-κ B进入胞核,NF-κ B结合与靶基因启动子上的顺式作用元件,从而促使基因表达形成并放大炎症反应[15];故而实验中NF-κ B可能刺激炎症性细胞因子的分泌产生大量致炎症细胞因子(IL-1、IL-6、IL-2、TGF-β、TNF-α等)、趋化因子(MCP-1)、粘附分子、急性期蛋白等,从而导致心肌的炎症反应,由此实现NF-κ B激活,完成其作为一种核转录因子而调控基因转录的功能。所以实验中看到即使在急性心肌炎后,NF-κ B的活性仍然高于正常对照组,NF-κ B的激活伴随了心肌炎-心肌病的全过程,正是由于NF-κ B的激活导致了炎症因子的大量释放,造成了大鼠心肌炎症反应,同时也影响了心肌间质的成分及结构的改变,从而促进了心肌炎后大鼠左心室重构的发生。刘东华等[16]通过病例对照分析,采用免疫组化等方法检测到心力衰竭患者NF-κ B表达增高,细胞因子 TNF-α、IL-l、IL-6分泌增多;而Shioji等在急性期EAM 大鼠中用免疫组化法检测心肌组织有NF-κ B的显著表达,且其表达水平与心肌病变程度相关[17]。因而我们有理由推测心肌炎后的左心室重构至少部分与激活的NF-κ B可在转录水平上调控炎症网络分子的表达相关,抑制其激活可以抑制炎症介质的合成和瀑布式级联反应,从而可能阻断病理效应,延缓左心室重构的发展。
[1] Mason JW.Myocarditis and dilated cardiomyopathy:An inflammatory link[J].Cardiovascular Research,2003,60(1):5.
[2] Horii T,Tambara K,et al.Residual fibrosis affects a longterm result of left ventricular volume reduction surgery for dilated cardiomyopathy in a rat experimental study[J].Eur cardio-thoracic Surgery,2004,26(6):1174.
[3] 汪朝晖,廖玉华.肌球蛋白致自身免疫性心肌疾病的实验研究[J].中华心血管病学杂志,2003,31(12):937.
[4] Yuki Yoshida,Tetsuo Shioi,et al.Resveratrol Ameliorates experimental autoimmune myocarditis[J].Circulation,2007,71:397.
[5] Maeda K,Shioi T,et al.Rapamycin ameliorates experimental autoimmune myocarditis[J].Int Heart,2005,46(3):513.
[6] Suresh PS,Kenichi W,et al.Involvement of Mast Cells in the Development of Fibrosis in Rats with Postmyocarditis Dilated Cardiomyopathy[J].Biol Pharm Bull,2005,28:2128.
[7] Bolger AP,Anker M.Tumour necrosis factor in chronic heart failure:a peripheral view on pathogenesis,clinical manifestations and therapeutic implications[J].Drags,2000,60(6):1245.
[8] Horii T,Tambara K,et al.Residual fibrosis affects a longterm result of left ventricular volume reduction surgery for dilated cardiomyopathy in a rat experimental study[J].Eur cardio-thoracic Surgery,2004,26(6):1174.
[9] Node K,Fujita M,et al.Short-term statin therapy improves cardiac function and symptoms in patients with idiopathic dilated cardiomyopathy[J].Circulation,2003,108(7):839.
[10] Afanasyeva M,Georgakopoulos D,et al.Autoimmune myocarditis:cellular mediators of cardiac dysfunction[J].Autoimmun Rev,2004,3(7-8):476.
[11] Zhengang Zhang,Pei Zhao,et al.Effects of methotrexate on plasma cytokines and cardiac remodeling and Function in postmyocarditis rats[J].Mediators of Inflammation,2009,10:1155.
[12] LiYY Mc,Tiernan CF,Feldman AM.Interplay of matrixmetal Loproteinases,tissue inhibitors of metal loproteinases and the irregulator sincardiac matrixremodeling[J].Cardiovasc Res,2000,468:2142.
[13] Christman JW,Lancaster LH,et al.Nuclear factorκ B:a pivotal role in the systemic inflammatory response syndrome and new target for therapy[J].Intensive Care Med,1998,24:1131.
[14] 李欣,廖晓星.核因子κ B在全身炎症反应综合征和多器官功能障碍综合征中的作用[J].中国急救医学,2002,22(5):303.
[15] Thanos D,Maniatis T.NF-kappa B:A lesson in family value[J].Cell,1995,80(4):529.
[16] 刘东华,刘应才,潘金生.心力衰竭患者核因子-κ B活化与细胞因子分泌的相关性研究[J].四川医学,2006,27:706.
[17] Shioji K,Kishimoto C,et al.Upreagulation of thioredoxin expression in gaint cell myocarditis in rats[J].Febs Lett,2000,472(1):109.
