抗癌药物羟基喜树碱对PC12细胞毒副作用的研究
2011-02-05胡洪华宋海星胡瀚丹
胡洪华,宋海星,胡瀚丹
(1.成都医学院检验医学院,2.成都医学院生物医学系,四川 成都 610083)
羟基喜树碱(H ydroxycamp tothecin,HCPT)是从我国特有的珙桐科植物喜树中提取分离的天然生物碱。国内外近年来大量研究表明,喜树碱能够诱导乳腺癌、膀胱癌、前列腺癌、胃癌、直肠癌等多种肿瘤细胞凋亡[17-21]。羟基喜树碱通过选择性抑制DNA拓扑异构酶Ⅰ(TopoⅠ)而具有广谱抗肿瘤效应,目前在临床上已广泛用于胃癌、肠癌、肝癌、肺癌等多种恶性肿瘤的治疗[1-3]。
PC12细胞为大鼠嗜铬细胞瘤细胞株,在形态结构及功能方面均具有神经元的特征,且可传代培养,类型较为单一,细胞特性稳定[6],已被作为一种良好的神经系统体外模型用于神经细胞分化、离子通道、受体等研究,也是检测神经毒性最常用的细胞株,可用于多种神经系统疾病,如阿尔茨海默病、帕金森病等的研究[7]。
抗癌药物的毒副作用一直是肿瘤治疗中的一大难题,为探讨抗癌药物对神经系统的毒副作用,本研究选用具有神经内分泌细胞和神经元特性的大鼠肾上腺嗜铬细胞瘤细胞株(PC12细胞)和具有广谱抗肿瘤作用的羟基喜树碱(HCPT),研究了HCPT对PC12细胞的毒性作用及细胞毒副作用机制。
1 材料和方法
1.1 试剂
羟基喜树碱为湖北黄石飞云药业产品,嗜铬细胞瘤细胞株PC12由本实验室传代培养。FACS Calibur flow cytometer激光流式细胞仪为美国BD公司产品,二氧化碳培养箱为美国Thermo公司产品,倒置显微镜为日本Olympus公司产品,荧光显微镜为日本Olym pus公司产品,ZS-2板式酶标仪由美国Bio-tek公司生产,电泳仪为美国Bio-rad公司产品,成像仪为美国BD公司产品,DMEM培养基为GIBCO公司产品,CCK-8试剂盒由碧云天生物技术研究所提供,无支原体新生牛血清为杭州四季青生物工程材料有限公司产品。
1.2 方法
1.2.1 细胞培养 PC12细胞冻于液氮中,实验时进行复苏并培养于含体积分数为10%新生牛血清、100 U/m L青霉素、100 U/m L链霉素及2mmoL/L L-谷氨酰胺、pH值为7.2-7.4的DMEM培养液中(完全培养液),于37℃、5%CO2条件下培养,生长到80%左右用0.125%的胰蛋白酶消化、传代,选取对数生长期细胞进行实验。
1.2.2 HCPT对PC12细胞的细胞毒作用 取对数生长期细胞,0.125%胰酶制成细胞悬液,重悬于含体积分数为10%新生牛血清的DM EM培养液(含100 U/m L青霉素、100 U/m L链霉素及2 mmoL/L L-谷氨酰胺)中,细胞以1×104个/m L的终浓度接种于96孔培养板,培养24 h后进行药物处理,按设计要求分12个实验组,每组设3个复孔,HCPT终浓度分别为20μmol/L、15μmol/L、10 μmol/L、5μmol/L、1μmol/L、0.5μmol/L、0.1 μmol/L、0.05μmol/L、0.01μmol/L、0.005μm ol/L、0.001μm ol/L、0.0005μmo l/L(HCPT用含10%新生牛血清DMEM培养液稀释),对照组加入等量的DMEM培养基,空白组不做任何处理。加药后继续培养,每隔24 h观察细胞形态变化。培养72 h后,实验组、对照组、空白组分别每孔加入200 μl的空白培养基,静置5 min,然后吸取培养基,每孔加入10μLCCK-8溶液和90μL空白培养基,37℃孵育3 h,酶标仪测定450 nm处的吸光度(A)值。细胞活力=(A加药-A空白)/(A未加药-A空白)×100%。
1.2.3 吖啶橙/溴化乙锭(AO/EB)染色观察细胞形态 收集正常培养和羟基喜树碱处理后的细胞,PBS洗涤后,每95μL的PBS液加入5μL的AO/EB混合液(各自以100μg/m L浓度等体积混合),室温静置5m in。分别取50μL混合产物于载玻片上,盖玻片封片,荧光显微镜下观察细胞凋亡形态。1.2.4 细胞DNA分析 不同浓度的HCPT处理细胞48 h后,收集细胞,用PBS离心洗涤,按照试剂盒说明书的操作步骤提取DNA,1.2%琼脂糖凝胶电泳2 h后,紫外灯下观察照相。
1.2.5 HCPT对PC12细胞凋亡和细胞周期的研究 根据细胞活力测定结果,选择适当的HCPT浓度处理细胞。收集2×106个细胞,用PBS洗涤二次后,重悬于500μL的PBS中,加入4℃乙醇固定12 h以上,离心除去乙醇,用PBS重悬洗涤,离心去PBS,加入碘化丙啶(PI,Sigm a公司)染色,室温避光20min,上流式细胞仪检测DNA含量和细胞周期,资料用modfit软件分析。
1.3 统计学分析
两样本均数间的比较采用方差分析和t检验,率的比较用χ2检验,所有数据用SPSS 13.0分析,P<0.05为差异有显著性。
2 结果
2.1 形态学观察
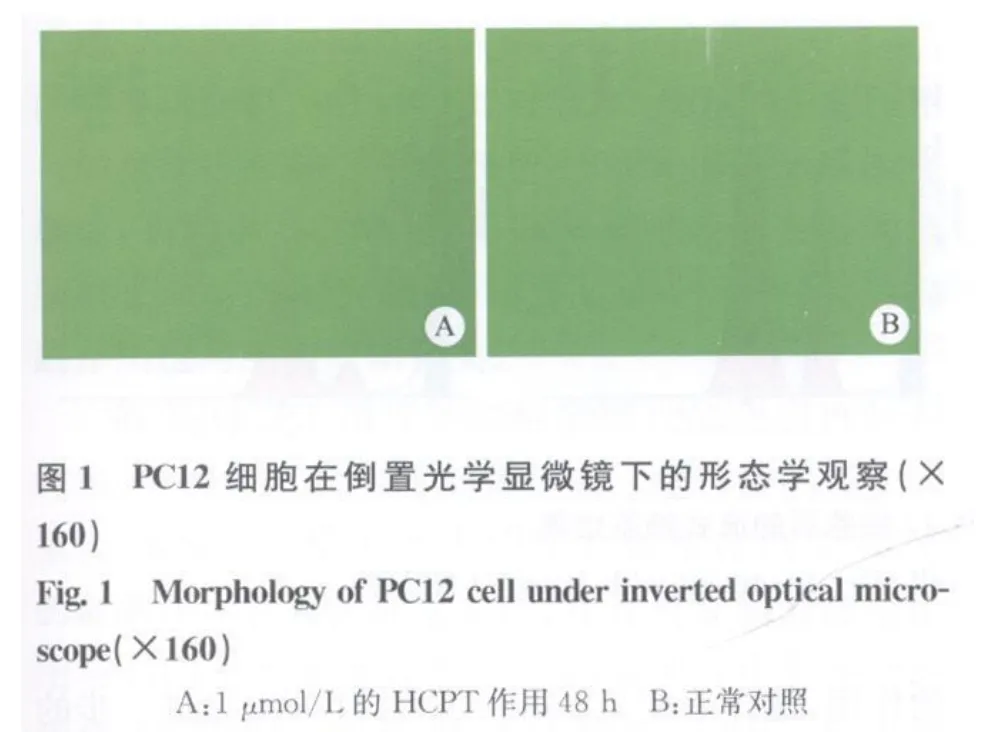
倒置光学显微镜下观察:对照组PC12细胞变多达到85%左右,细胞均贴壁生长,呈长梭形,细胞质均匀而透明,胞体近中央处可见圆形或椭圆形的细胞核;1μmol/L的HCPT浓度组细胞停止生长,细胞高度固缩,细胞核固缩,核碎裂,细胞膜完整,可见膜发泡成芽形成凋亡小体(见图1)。
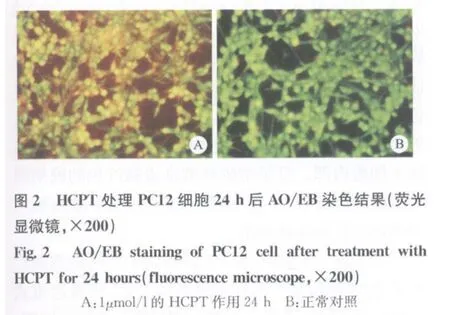
应用1μmol/L HCPT处理PC12细胞24 h后,AO/EB双染于荧光显微镜下可见:正常细胞为绿色;早期凋亡细胞为淡绿色;凋亡晚期的细胞为桔红色、绿色相间;死亡细胞为红色(见图2)。
2.2 HCPT对PC12细胞的细胞毒作用
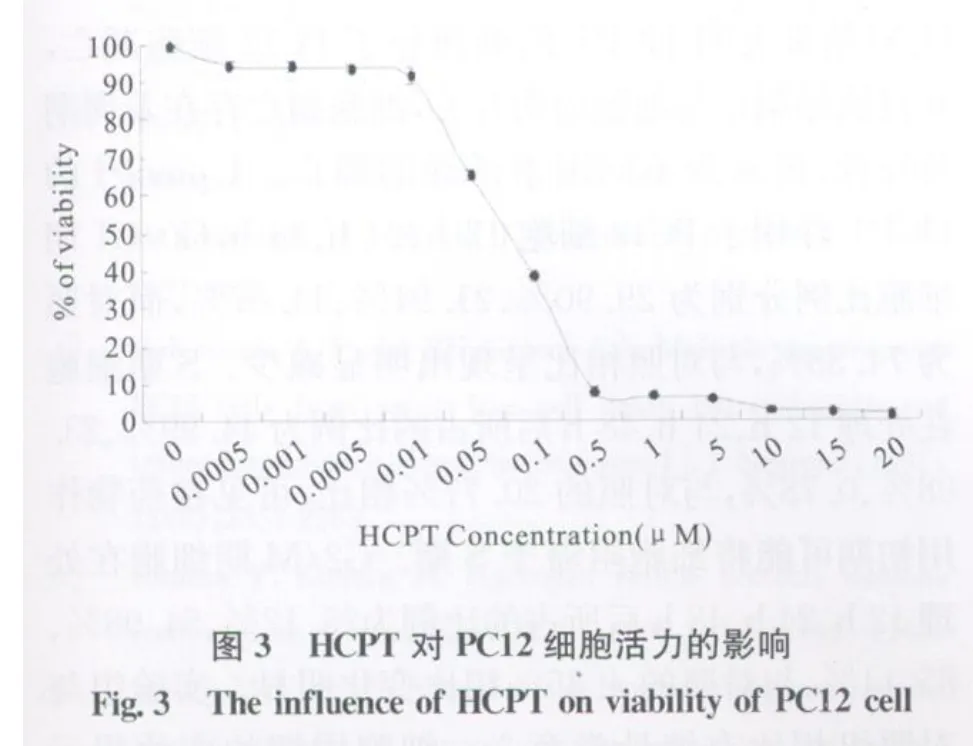
各浓度的HCPT对PC12细胞皆有一定的增殖抑制作用,且随着药物作用浓度的升高,增殖抑制率逐渐升高(见图3)。当HCPT的浓度在0.01μm ol/l以下时对PC12细胞的生长影响不大,作用48 h后细胞活力在90%以上;当HCPT的浓度在0.05 μmol/l~0.5μmol/l范围内时,随着HCPT浓度增加,PC12细胞的细胞活力从87.80%降到了8.03%;但当HCPT浓度继续升高,细胞活力的下降不明显。
2.3 DNA琼脂糖凝胶电泳分析
HCPT处理PC12细胞36 h后,琼脂糖凝胶电泳显示空白组为单一的DNA条带;不同浓度的实验组都可见片状模糊条带,梯状DNA条带不明显;且当浓度为0.1μmo l/l时DNA片段化最为严重(见图4)。
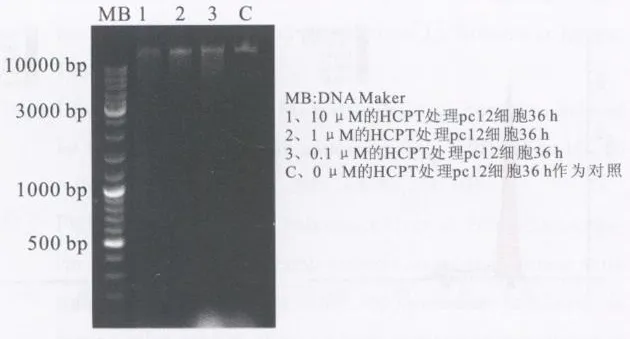
图4 DNA凝胶电泳分析Fig.4 DNA gel electrophoresis
2.4 HCPT对PC12细胞凋亡和细胞周期的影响
1μm ol/l的HCPT对PC12细胞有明显抑制生长的作用。在流式细胞图上可看到细胞周期分布明显变化(见表1和图5),随着药物作用时间的延长,G0/G1期细胞、S期细胞逐渐减少,而G2/M期细胞和凋亡率逐渐增加。
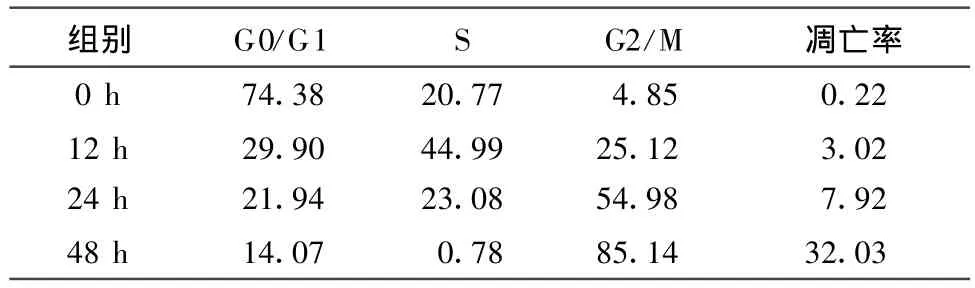
表1 1μmol/l的HCPT处理PC12细胞后对细胞周期和凋亡的影响Tab.1 The influence of 1μmol/l HCPT on cell cycle and apoptosisof PC12 cell
3 讨论
导致黑素瘤高死亡率的原因是凋亡相关信号的缺失和对化疗的耐受[22],研究开发新的抗癌药物和研究现成抗癌药物的抗癌活性及抗癌机制十分必要。HCPT是DNA拓扑异构酶I(Topo-I)特异性抑制剂,其在体内可导致双链DNA断裂,从而控制DNA复制,阻断RNA合成,干扰细胞分裂周期[8],所以HCPT被广泛应用于临床抗肿瘤治疗中。有研究报道,HCPT的抗肿瘤作用是通过诱导S期细胞发生凋亡[9],但其诱导肿瘤细胞凋亡的分子机制及其信号转导途径尚不清楚[10,11]。而细胞凋亡与细胞周期有密切的关系,有研究表明细胞凋亡存在着周期特异性,表现为不同因素诱导的凋亡发生在细胞的不同周期时段[12]。而HCPT在抗肿瘤的同时,必定对机体各个系统的正常细胞都有不同程度的影响。神经系统是人体内起主导作用的功能调节系统,体内各器官、系统的功能和各种生理过程都不是各自孤立地进行,而是在神经系统的直接或间接调节控制下,互相联系、相互影响、密切配合,实现和维持正常的生命活动,故HCPT对神经细胞的毒副作用广泛,应受到研究者的重视。
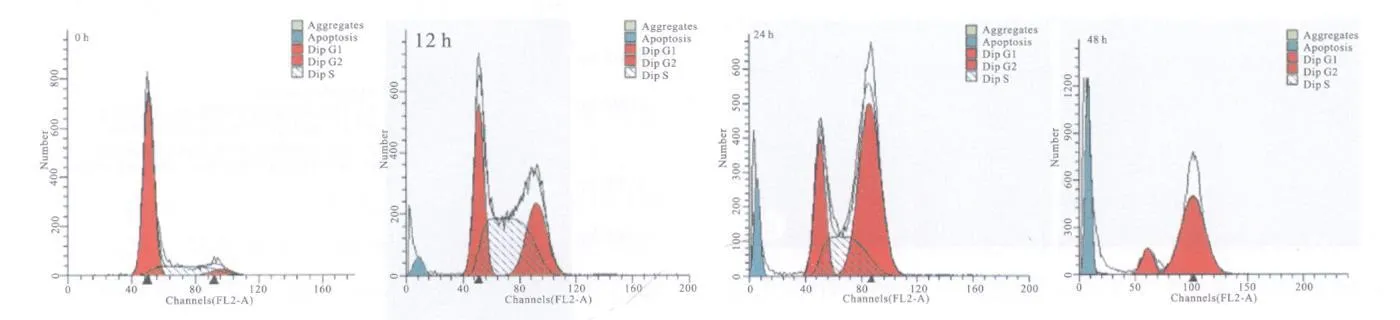
图5 1μmol/l的HCPT处理PC12细胞后的流式细胞结果Fig.5 Flow cytometry test resu lts of PC12 cell after treatment with 1μmol/l HCPT
本研究通过光镜从形态学观察HCPT对PC12细胞的毒副作用,发现实验组细胞出现细胞数量明显减少,细胞体积缩小、核浓缩等变化,且随着作用浓度的增加,上述改变愈加显著,因此推测HCPT对PC12细胞的毒副作用除了抑制细胞增殖外还可能诱导了其凋亡。HCPT对PC12细胞增殖的影响结果表明,高浓度的HCPT抑制细胞生长明显,可能使细胞死亡,低浓度的HCPT抑制细胞生长的作用不明显。研究发现当HCPT的浓度在0.01 μmol/l以下时对PC12细胞的生长影响不大,将这段浓度区域称为HCPT对PC12低浓度耐受期。而当HCPT的浓度从0.05μm ol/l增加到0.5μm ol/l,随着HCPT浓度的增加PC12细胞的细胞活力从87.80%降到了8.03%,可见在这个浓度范围内细胞的毒副作用与HCPT的浓度有非常密切的关系,我们将这段浓度区域称为HCPT对PC12的效量骤变区。而当HCPT的浓度继续升高,细胞活力的变化也不明显,在这个浓度区域的HCPT对细胞有明显的致死效应,此结果与张一等[13]用HCPT作用BRA-3A细胞的生长抑制曲线一致,把这段浓度区域称为HCPT对PC12细胞的高浓度致死区。HCPT的浓度与PC12细胞活力的关系在指导临床HCPT的用量上有指导意义,抗癌药物HCPT的减毒增效可以通过控制抗癌药物的用量来优化。
为了探讨HCPT对PC12细胞是否有诱导凋亡的作用,选择浓度为1μmol/l的HCPT做进一步的研究。通过AO/EB染色发现,当1μmol/l HCPT处理细胞24 h后,细胞形态还可见,但细胞膜和核膜已经受到了破坏,EB可以与DNA结合部分被染成红色。可见典型的早期凋亡细胞细胞核被染成绿色,呈碎片状,此外可能因为DNA漏出到细胞核之外而被EB染成红色,细胞内可见红色致密斑块弥散于细胞内部。可见细胞核被染成橘红色的晚期凋亡细胞,以及凋亡小体形成。也可见极少数的被均匀染成红色的坏死细胞。
为了进一步证明HCPT的毒副作用与细胞凋亡有关,探讨细胞凋亡与细胞周期的关系,可通过流式细胞技术(FCM)来进一步研究细胞凋亡和细胞周期。FCM结果表明HCPT的确诱导了PC12细胞凋亡,并且诱导凋亡与细胞周期有关,细胞凋亡存在着周期特异性,提示为不同因素诱导的凋亡。1μmol/l的HCPT作用于PC12细胞12 h、24 h、48 h,G0/G1期细胞比例分别为29.90%、21.94%、14.07%,而对照为74.38%,与对照相比呈现出明显减少。S期细胞在处理12 h、24 h、48 h后所占的比例为44.99%、23.08%、0.78%,与对照的20.77%相比,可见在药物作用初期可能将细胞阻滞于S期。G2/M期细胞在处理12 h、24 h、48 h后所占的比例为25.12%、54.98%、85.14%,与对照的4.85%相比变化明显。实验组与对照组相比有统计学意义。细胞周期的变化提示HCPT的毒副作用可能与将PC12细胞阻滞于G2/M期有关。
抗癌药物能恢复周期控制点的作用,使肿瘤细胞在任何一个环节出现障碍致细胞不能增殖[14]。有研究报道,HCPT诱导凋亡的机制可能与阻滞G1期和S期细胞有关[12]。许青等[15]研究了HCPT诱导胃癌细胞、肺癌细胞凋亡的机制,揭示了诱导细胞凋亡是其抗肿瘤作用的主要机制之一。同时本研究也表明HCPT对PC12细胞的毒副作用与细胞凋亡有关。用低剂量HCPT作用于喉鳞癌细胞,表现出G2/M阻滞,高剂量时表现出S期细胞阻滞[16]。本研究提示HCPT对PC12细胞的毒副作用也与细胞周期有关。
有关HCPT诱导肿瘤细胞凋亡的作用机制研究很多,而应用HCPT对机体的毒副作用同样受到重视,本实验结果表明:HCPT在体外对PC12细胞的毒副作用表现在抑制生长,并且对细胞的抑制作用与HCPT的浓度有密切关系,在研究中发现细胞活性和HCPT的浓度可以分为三段。当选用HCPT抗肿瘤治疗时,如果HCPT的浓度位于正常细胞的低浓度耐受区,而该浓度不位于癌细胞的低浓度耐受区,对机体而言就达到了减毒增效的作用。本研究提示在选用抗癌药物治疗时,癌细胞对药物的敏感性和对机体的毒副作用值得进一步的研究。
[1] Seo MD,Lee KW,Lim JH,et al.Irinotecan combined with 5-fluorou racil and leucovorin as second-line chemotherapy for metastatic or relapsed gastric can cer[J].Jpn JC lin Oncol,2008,38(9):589-595.
[2] Yao Y,Zhao H,Sun Y,et al.Combined chemotherapy of hydroxycampothecin with oxaliplatin as an adjuvant treatment for hum an colo rectal can cer[J].Tohoku J Ex p M ed,2008,215(3):267-278.
[3] Yu ZJ,Yu JW,CaiW,et al.Evaluation of HCPT d14-double passaged intervening chem otherapy protocol for hepatocellular carcinoma[J].World J Gastroenterol,2005,11(33):5221-5225.
[4] Rukenstein A,Rydel RE,Greene LA.Multiple agentsrescue PC12 cells from serum-free cell death by translationb and transcription independent mechanisms[J].JNeurosci,1991,11(8):2552-2563.
[5] Kimura Y,Kimura H.H ydrogen sulfide protects neu rons from oxidative stress[J].FASEB J,2004,18(10):1165-1167.
[6] Joanne M,Rirka G,Anna J,et al.Inositol steroisomer stebilize an oligometric aggregate of Alzhemier amyloid-induced toxicity[J].Biol Chem,2000,275(24):18495-18502.
[7] Shafer TJ,A tchison WD.Transmitter ion channel and receptor properties of pheochrom ocytoma(pc l2)cells:amodel for neurotoxicological studies[J].Neurotoxicology,1991,12(3):473-492.
[8] Sinha BK.Topoisomerase inhibiters Areview of their therapeu ticpotential in cancer[J].Drugs,1995,49(1):11-19.
[9] Malonne H,Atassi G.DNA topoisomerases targeting drugs:mechanism s of action and perspectives[J].Anticancer Drugs,1997,8(9):811-822.
[10] Lansiaux A,Facompre M,Wattez N,et al.Apoptosis induced by the homocam ptothecin anticancer d rug BN 80915 in H L-60 cells[J].Mol Pharmacol,2001,60(3):450-461.
[11] Philippart P,H arper L,Chaboteaux C,et al.Homocamptothecin,an E-ring-modified camp tothecin,exertsmo repotent antip roliferative activity than other topoisomerase Iinhibitors in hum an colon cancers obtained from surgeryand m ain tained in vitro under histotyp ical culture conditions[J].C lin Cancer Res,2000,6(4):1557-1562.
[12] 罗执芬,周云,刘明月.羟基喜树碱对胃癌细胞凋亡和细胞周期的影响[J].医药论坛杂志,2007,28(9):1-2.
[13] 张一,邓群,胡国信,等.羟基喜树碱对HSC-T6细胞增殖与凋亡的影响[J].中华肝脏病杂志,2010,18(3):199-203.
[14] 王红宁,左国伟,陈地龙,等.人参皂苷Rbl、Rgl、Re对白血病细胞株KG1α增殖的影响[J].生物技术,2010,20(2):56-58.[15] 许青,王杰军,郭静,等.羟基喜树碱诱导人肺癌细胞SPC-A-1的凋亡[J].肿瘤,2000,20(1):12-22.
[16] Chai LP,Su ZZ,Xian ZX.Inhibition of hyd roxycam ptothecin on laryngeal squamous carcinom a cell line[J].Ai Zheng,2003,22(4):372-375.
[17] Fu YR,Yi ZJ,Yan YR,et al.H ydroxycamptothecin-induced apoptosisin hepatoma SMMC-7721 cells and the role of mitochond rial pathway[J].Mitochondrion,2006,6(4):211-217.
[18] Fan H T,Li Z,Zhu DC,et al.Inhibition of proliferation,antiinvasion and induction of apoptosis in bladder cancer cells by 10-HCPT[J].Life Science Research,2005,9(1):90-93.
[19] Wu Y,Zeng FQ,Wang YB,et al.Hydroxycam ptothecin promotes the apoptosis of prostate cancer cell line PC-3[J].National Journal of And rology,2007,13(10):890-894.
[20] Tu SP,Jiang SH,Tan JH,et al.Themechanisms of apoptosis induced by hydroxycamptothecin in gastric cancer cells[J].Chinese Jou rnalof Digestion,2001,21(5):274-277.
[21] 杜江,魏寿江,刘博,等.结直肠癌术中区域化疗的安全性评价[J].成都医学院学报,2009,4(2):91-96.
[22] Franke JC,Plotz M,Prokop A,et al.New caspase-independen t but ROS-dependent apoptosis path way s are targeted in melanoma cells by an iron-containing cytosine analogue[J].Biochemical Pharmacology,2010,79(4):575-586.