NR1磷酸化在神经生长因子加剧大鼠骨癌痛中的作用
2011-02-03姚鹏丁远远马佳明蒋晶晶张锦孟凌新
姚鹏,丁远远,马佳明,蒋晶晶,张锦,孟凌新
(中国医科大学附属盛京医院1.疼痛科;2.麻醉科,沈阳 110004)
NR1磷酸化在神经生长因子加剧大鼠骨癌痛中的作用
姚鹏1,丁远远1,马佳明1,蒋晶晶2,张锦2,孟凌新1
(中国医科大学附属盛京医院1.疼痛科;2.麻醉科,沈阳 110004)
目的探讨骨癌痛大鼠背根神经节(DRG)神经生长因子(NGF)表达及NR1磷酸化情况,并观察鞘内注射神经生长因子抗体(anti-NGF)对NR1磷酸化及骨癌痛大鼠疼痛行为的影响。方法 检测骨癌痛大鼠DRG NGF的表达及NR1磷酸化:雌性SD大鼠随机分成假手术(sham)组及cancer组,每组10只,分别在左胫骨注射PBS液或walker256瘤细胞,21d取左侧L4-5DRG。检测anti-NGF对NR1磷酸化及大鼠疼痛行为的影响:骨癌痛大鼠鞘内置管,随机分成生理盐水(NS)组及anti-NGF组,于接种瘤细胞16d开始分别鞘内注射生理盐水或anti-NGF。于接种瘤细胞前、接种后13、18及21d进行疼痛行为测试,接种21d取大鼠左侧L4-5DRG,Western blot方法检测NR1磷酸化。结果 与sham组比较,cancer组大鼠DRG NGF表达显著上调,NR1磷酸化水平增加(P<0.01)。鞘内注射anti-NGF后,与NS组比较,机械痛阈降低和热辐射潜伏期延长。NS组NR1磷酸化水平高于anti-NGF组(P<0.05)。结论anti-NGF减弱骨癌痛、抑制NR1磷酸化,提示NGF通过NR1磷酸化加剧大鼠骨癌痛。
神经生长因子;N-甲基-D-天冬氨酸受体;磷酸化;骨癌痛
肿瘤患者发病率呈逐年上升的趋势,Thun等[1]2010年的统计结果显示:肿瘤已成为危及人类生命的主要原因之一。据统计,70%~90%的肿瘤患者发生癌痛,乳腺癌、前列腺癌及肺癌等肿瘤容易发生骨转移而引起骨癌痛,我们前期的研究[2]显示,大鼠胫骨注射walker256瘤细胞诱发的骨肿瘤模型中,神经生长因子(nerve growth factor,NGF)加剧骨癌痛,大鼠鞘内注射抗神经生长因子抗体(nerve growth factor polyclonal antibodies,anti-NGF) 可明显抑制骨肿瘤引起的痛敏。
NGF 在炎性疼痛[3]和神经病理性疼痛[4]中发挥重要作用。电生理研究发现:伤害性感受器的兴奋性与NGF的含量密切相关。NGF不仅可直接活化感觉神经元,还可调控一些神经递质、受体、通道的活性。N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体在炎性痛和神经病理性疼痛中发挥重要作用[5],Traynelis等[6]也总结了 NGF 对 NMDA受体的调制作用,但是在骨癌痛中是否存在这样的调制作用尚不清楚。
我们推测NGF可以上调脊髓背根神经节(dorsal root ganglion,DRG)NMDA 受体 NR1亚单位,因此本研究探讨骨癌痛大鼠背根神经节NGF表达及NR1磷酸化情况,并观察鞘内注射anti-NGF对NR1磷酸化及骨癌痛大鼠疼痛行为的影响。
1 材料与方法
1.1 实验动物
雌性SD大鼠,体质量200~220g,由中国医科大学附属盛京医院动物室提供。动物饲养于铺垫锯末塑料盒内,每笼5只饲养,室内温度(22±0.5)℃,湿度40%~60%,自然照明,自由摄食、饮水。实验获得中国医科大学附属盛京医院伦理委员会的批准。
1.2 实验分组及方法
1.2.1 骨癌痛大鼠DRG NGF的表达及NR1磷酸化:雌性SD大鼠随机分成假手术(sham)组及cancer组,分别在左胫骨注射PBS液或walker256瘤细胞,方法参照文献[2]的实验方法,每组10只,21d取左侧L4-5DRG。
1.2.2 Anti-NGF对NR1磷酸化及大鼠疼痛行为学的影响:骨癌痛大鼠接种瘤细胞13d鞘内置管,随机分成生理盐水(NS)组及anti-NGF组,每组10只,于接种瘤细胞16d开始分别鞘内注射生理盐水(10μl/只)或 anti-NGF(10μl/只,用生理盐水稀释为 1μg/μl),每日 2次,连续 5d。于接种瘤细胞前、接种后13、18及21d观察热辐射缩爪潜伏期(paw withdrawal latency,PWL)及机械性缩爪阈值(paw withdrawal threshold,PWT),接种21d测试后取大鼠左侧L4-5DRG,Western blot方法检测NR1磷酸化。
1.3 主要仪器和试剂
walker 256细胞(中国医学科学院肿瘤研究所提供),von Frey细丝(美国 Stoeling公司),BME-410A热辐射刺激仪(中国医学科学院生物工程研究所),银汞混合器(北京四泰新技术开发公司),兔抗NGF,anti-NGF及P-NR1抗血清(Santa Cruz公司)。
1.4 瘤细胞提取
walker 256细胞为来源于大鼠乳腺癌的腹水瘤细胞,保存在中国医科大学附属盛京医院中心实验室液氮罐中,用快融方法复苏并接种于大鼠腹腔传代,抽取腹水、离心、计数。
1.5 大鼠胫骨癌痛模型的建立及鞘内置管
采用以往的方法[2]建立大鼠胫骨骨癌痛模型。水合氯醛麻醉(10%,3.5×10-3ml/g)大鼠胫骨骨髓腔缓慢注入10μl含walker256的PBS细胞悬液,共含癌细胞1×105个,注射时间为2min,注射完毕后迅速用银汞合剂封住针孔,分别用75%乙醇和无菌生理盐水冲洗切口,皮肤分层缝合。sham组大鼠左侧胫骨上段注入等体积的PBS液,其余操作同cancer组。鞘内置管采用PE-10导管,L2-3椎间隙置管,导管尖端置于接近L5DRG位置,取无感觉和运动障碍的动物作为研究对象,实验结束时确认导管尖端的正确位置[7]。
1.6 PWL及PWT测定
测定热辐射刺激引起的缩爪潜伏期,将大鼠置入观察笼内,待其安静后将光辐射焦点对准足趾底中部,打开光源,从照射开始至大鼠抬腿或逃走的潜伏期作为热痛阈值,测定3次,时间间隔10min,取其平均值。为防止烫伤,将PWL的上限值定为20s;机械测试时大鼠在刺激时间内或在移开von Frey细丝时立即出现快速的缩足反应,记为阳性反应,直到找到1个纤维细丝,用其连续测试5次中有3次阳性反应,认定其为阈值(g),最高阈值设为26g,前后两次不同刺激间隔10s。
1.7 Western blot检测
大鼠接种瘤细胞后21d,水合氯醛麻醉,断头处死,取左侧L4-5DRG。应用凯基生物试剂盒(KGP350)提取胞膜蛋白,采用BCA法进行蛋白定量。按每孔40μg总蛋白煮沸变性后上样,SDSPAGE电泳(成层胶浓度5%,分离胶浓度10%)分离蛋白,4℃,200mA,2h湿转印至PVDF膜上。PVDF膜用5%脱脂奶粉室温封闭1h,分别与封闭液稀释的 P-NR1抗血清(1∶1000)或 NGF抗体(1∶1000),4℃孵育过夜。然后加入稀释的辣根过氧化物酶标记的二抗山羊抗兔IgG(1∶2000)室温杂交2h,最后采用ECL化学发光法检测蛋白条带信号。每个标本重复实验3次,以β-actin为内参进行相对定量分析。
1.8 统计学分析
选用SPSS 13.0进行统计处理,计量资料以x±s表示,组间比较采用成组t检验或单因素方差分析,继以LSD或SNK处理。P<0.05为差异有统计学意义。
2 结果
2.1 骨癌痛诱导NGF表达上调及NR1磷酸化
NGF在cancer组大鼠DRG表达显著上调,与sham组比较,差异有统计学意义(P<0.01);cancer组大鼠DRG NR1磷酸化水平也显著高于sham组。提示骨癌痛诱导NGF表达及NR1磷酸化水平上调。见图 1,2。

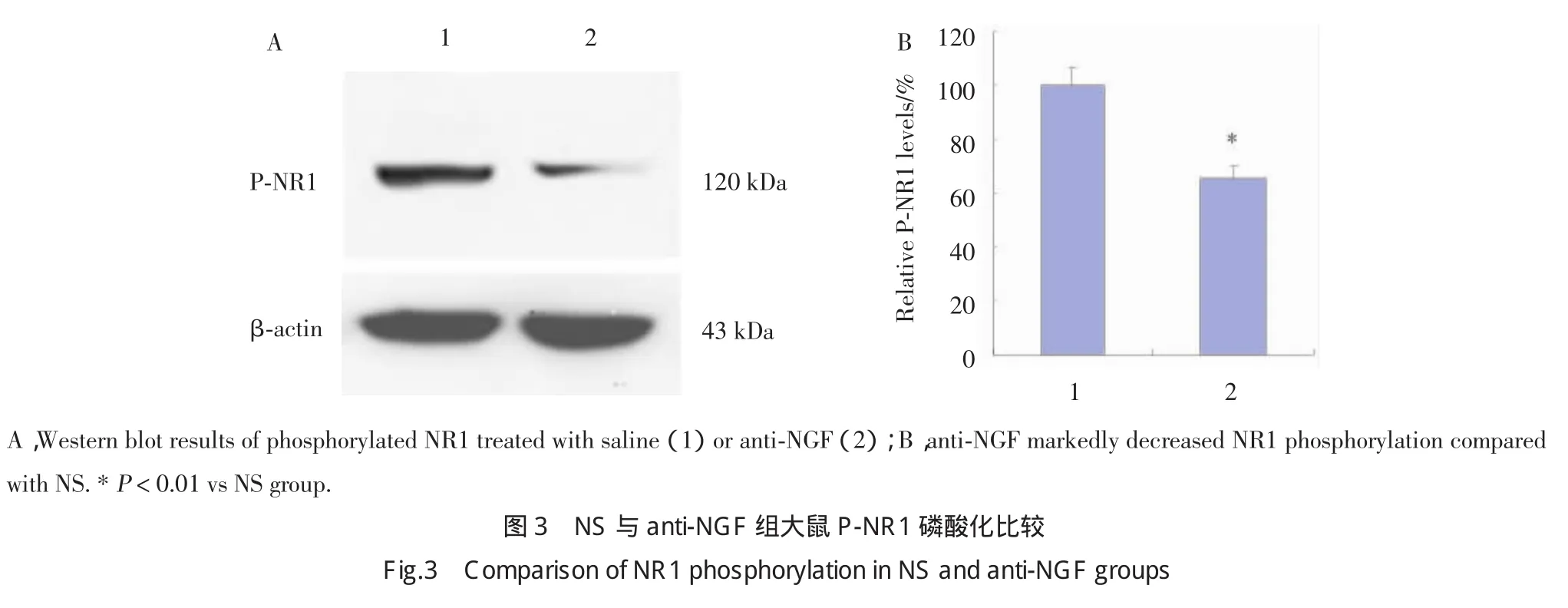
2.2 anti-NGF减弱机械和热痛敏并降低NR1磷酸化水平
大鼠胫骨接种瘤细胞前(基础值)PWL和PWT无统计学差异,接种13d,PWL缩短,PWT降低,大鼠出现机械和热痛敏。鞘内注射anti-NGF后,与NS组比较,PWL 延长,PWT 增高,见表 1,2。

表1骨癌痛大鼠P WL变化(±s,s)T a b.1C h a n g e s o f P WL i n b o n e c a n c e r r a t s(±s,s)Post-inoculation day 13 day 18 day 21NS 13.2±1.4 8.5±1.2 6.8±0.4 4.0±0.5Anti-NGF 13.1±1.5 8.7±1.3 9.1±0.61) 9.6±1.11)1)P<0.05vs NS group;PWL,paw withdrawal latency.Group Baseline

表2骨癌痛大鼠P WT变化(±s,g)T a b.2C h a n g e s o f P WTi n b o n e c a n c e r r a t s(±s,g)Post-inoculation day 13 day 18 day 21NS 15.9±2.4 5.5±1.1 3.9±0.6 3.7±0.6Anti-NGF 16.1±2.1 5.7±1.2 9.5±1.61) 9.8±1.21)1)P<0.05vs NS group;PWT,paw withdrawal threshold.Group Baseline
鞘内注射NS或anti-NGF后,anti-NGF组大鼠DRG NR1磷酸化水平明显低于NS组,结果显示骨癌痛大鼠DRG NGF表达上调促进了NR1磷酸化水平,见图3。
3 讨论
骨癌痛是一种机制极为复杂的慢性疼痛,涉及神经损伤所致病理性痛、瘤细胞的压迫、缺血、细胞因子及其他炎性介质释放所致的炎性痛等,共同构成骨癌痛的慢性疼痛综合征。这种复杂的、不断演变的疼痛类型导致骨癌痛很难控制。本研究中NGF在骨癌痛大鼠DRG表达显著上调。以往的一些研究显示NGF在炎性疼痛[3]和神经病理性疼痛[4]中发挥重要作用,NGF可以介导炎症和免疫反应,产生感觉超敏,当组织受到伤害性刺激时,NGF可以激活神经元终末的TrkA、P75受体,从而激活细胞内的信号级联反应,调制、活化不同的离子通道,引起中枢敏化,产生痛觉超敏或痛觉异常。一些基于骨肿瘤的研究显示,肿瘤细胞在骨髓腔内不断生长,肿瘤细胞本身会释放NGF;肿瘤浸润组织的白细胞增多,占整个肿瘤组织的80%,活化的白细胞会合成并释放大量高浓度的生长因子[8]。本研究结果提示DRG也存在NGF的高表达。
NMDA受体是一种配体门控型Ca2+通道,在伤害性疼痛信号传导、整合过程中发挥重要作用,而NR1是NMDA受体的功能性亚单位,代表NMDA受体的活性状态。有研究显示[9],大鼠DRG神经元中约90%显示NMDA受体样免疫染色阳性,提示外周NMDA受体在疼痛产生过程中可能起重要作用。本研究中骨癌痛大鼠DRG NR1磷酸化水平增高,显示磷酸化NR1参与骨癌痛的产生和维持过程,这与以往在炎性痛和神经病理性痛模型的研究结果一致[5]。
本研究同时显示鞘内注射anti-NGF减弱骨癌痛的机械和热痛敏,与Sevcik等[10]腹腔内注射anti-NGF缓解小鼠骨肉瘤疼痛的结果一致。疼痛行为学结果提示NGF参与大鼠骨癌痛的伤害性信号由外周向中枢的传递过程,加剧骨肿瘤诱发的疼痛。另外,anti-NGF显著抑制骨肿瘤诱导的NR1磷酸化水平。这一结果提示NGF表达上调增加了NR1的磷酸化,从而促进骨肿瘤诱发的疼痛反应,而anti-NGF缓解骨癌痛可能与抑制了NR1的磷酸化有关。然而,由于骨癌痛的复杂性及NGF的多效性,阻断NGF通路,其产生的反应也是复杂的[11],NGF加剧骨癌痛,但并不能排除有其他信号传导通路的参与。Zou等[12]研究显示PKC抑制剂有明显的抗伤害感受作用,且其作用与抑制NR1的磷酸化有关,提示NR1磷酸化受PKC的调制。以往研究显示[13]骨髓发出的感觉传入神经纤维86%是降钙素基因相关肽(calcitonin gene-related peptide,CGRP)神经纤维,而几乎所有表达CGRP的纤维都表达TrkA。因此,骨肿瘤时局部释放大量的NGF与TrkA结合,激活肽能伤害感受器,促进CGRP的释放,通过PKC途径调制NR1亚单位磷酸化。另外,NMDA受体同时也存在于脊髓背角及上位中枢,传递、整合伤害性信息,我们将在今后的研究中进一步探讨NGF、NR1亚单位磷酸化在骨癌痛敏化过程中的中枢作用。
综上,anti-NGF减弱骨癌痛、抑制NR1磷酸化,提示NGF通过NR1磷酸化加剧大鼠骨癌痛。
[1]Thun MJ,DeLancey JO,Center MM.The global burden of cancer:priorities for prevention[J].Carcinogenesis,2010,31(1):100-110.
[2]姚鹏,张锦,蒋晶晶,等.神经生长因子对骨癌痛大鼠疼痛行为学的影响[J].中国医科大学学报,2010,39(12):1009-1012.
[3]Mousa SA,Cheppudira BP,Shaqura M,et al.Nerve growth factor governs the enhanced ability of opioids to suppress inflammatory pain[J].Brain,2007,130(Pt 2):502-513.
[4]Fukui Y,Ohtori S,Yamashita M,et al.Low affinity NGF receptor(p75neurotrophin receptor)inhibitory antibody reduces pain behavior and CGRP expression in DRG in the mouse sciatic nerve crush model[J].J Orthop Res,2010,28(3):279-283.
[5]Gao X,Kim HK,Chung JM,et al.Reactive oxygen species(ROS)are involved in enhancement of NMDA-receptor phosphorylation in animal models of pain[J].Pain,2007,131(3):262-271.
[6]Traynelis SF,Wollmuth LP,McBain CJ,et al.Glutamate receptor ion channels:structure,regulation,and function [J].Pharmacol Rev,2010,62(3):405-496.
[7]Tsuda M,Masuda T,Kitano J,et al.IFN-gamma receptor signaling mediates spinal microglia activation driving neuropathic pain[J].Proc Natl Acad Sci USA,2009,106(19):8032-8037.
[8]Zhang F,Lu W,Dong Z.Tumor-infiltrating macrophages are involved in suppressing growth and metastasis of human prostate cancer cells by INF-beta gene therapy in nude mice[J].Clin Cancer Res,2002,8(9):2942-2951.
[9]Marvizón JC,McRoberts JA,Ennes HS,et al.Two N-methyl-D-aspartate receptors in rat dorsal root ganglia with different subunit composition and localization[J].J Comp Neurol,2002,446(4):325-341.
[10]Sevcik MA,Ghilardi JR,Peters CM,et al.Anti-NGF therapy profoundly reduces bone cancer pain and the accompanying increase in markers of peripheral and central sensitization[J].Pain,2005,115(1-2):128-141.
[11]Zhang RX,Liu B,Wang L,et al.Spinal glial activation in a new rat model of bone cancer pain produced by prostate cancer cell inoculation of the tibia[J].Pain,2005,118(1-2):125-136.
[12]Zou X,Lin Q,Willis WD,et al.Effect of protein kinase C blockade on phosphorylation of NR1in dorsal horn and spinothalamic tract cells caused by intradermal capsaicin injection in rats [J].Brain Res,2004,1020(1-2):95-105.
[13]Walsh GS,Krol KM,Kawaja MD.Absence of the p75neurotrophin receptor alters the pattern of sympathosensory sprouting in the trigeminal ganglia of mice overexpressing nerve growth factor[J].J Neurosci,1999,19(1):258-273.
(编辑武玉欣,英文编辑王又冬)
Roles of NMDA Receptor NRl Subunit Phosphorylation on Nerve Growth Factor-facilitated Bone Cancer Pain in Rats
YAO Peng1,DING Yuan-yuan1,MA Jia-ming1,JIANG Jing-jing2,ZHANG Jin2,MENG Ling-xin1
(1.Department of Pain,Shengjing Hospital,China Medical University,Shenyang 110004,China;2.Department of Anaesthesiology,Shengjing Hospital,China Medical University,Shenyang 110004,China)
ObjectiveTo evaluate the expression of nerve growth factor(NGF)and NMDA receptor NR1subunit phosphorylation and investigate the effects of anti-NGF on dorsal root ganglion(DRG)NR1phosphorylation and pain in the rats with bone cancer pain.MethodsTwenty rats were randomly divided into sham and cancer group(n=10per group)by inoculating PBS or walker256cancer cell solution into the left tibia.On day 21,the left lumbar 4-5DRG were removed for detecting the expression of NGF and phosphorylated NR1with Western blot.Cancer rats,in which the intrathecal catheter were surgically implanted,were randomly assigned to NS and anti-NGF group (n=10per group).Intrathecal injection of saline or anti-NGF was given from day 16to 21after inoculation.Mechanical and thermal hyperalgesia was assessed before inoculation (baseline),on day 13,18and 21after inoculation.After the behavioral test on day 21,the left lumbar 4-5DRG were removed to measure phosphorylated NR1with Western blot.ResultsThe expression of NGF and the levels of phosphorylated NR1were significantly up-regulated in the DRG of the cancer group rats compared with those of sham group.Intrathecal injection of anti-NGF attenuated the mechanical and thermal hyperalgesia compared with the rats of group NS,a reduced tendency in paw withdrawal latency(PWL)and a decreased paw withdrawal threshold(PWT)were observed in anti-NGF group rats.Phosphorylated NR1levels were significantly higher in NS group rats than anti-NGF group rats,which indicated that anti-NGF inhibited DRG NR1phosphorylation during bone cancer pain.ConclusionAnti-NGF might attenuate bone cancer pain and inhibit NR1phosphorylation,which indicated that NGF could enhance NR1phosphorylation to facilitate bone cancer pain.
nerve growth factor;N-methyl-D-aspartate receptor;phosphorylation;bone cancer pain
R738
A
0258-4646(2011)02-0117-05
doiCNKI:21-1227/R.20110212.0950.005
辽宁省自然科学基金资助项目(20082111)
姚鹏(1971-),男,讲师,博士.
张锦,E-mail:jinzhang_cmu2h@yahoo.com.cn
2010-11-23
