C3胞外酶抑制缓激肽诱导的血肿瘤屏障通透性的增加
2011-02-03马腾刘啸白薛一雪
马腾,刘啸白,薛一雪
(中国医科大学 1.基础医学院神经生物学教研室;2.第96期临床医学7年制,沈阳 110001)
C3胞外酶抑制缓激肽诱导的血肿瘤屏障通透性的增加
马腾1,刘啸白2,薛一雪1
(中国医科大学 1.基础医学院神经生物学教研室;2.第96期临床医学7年制,沈阳 110001)
目的研究Ras基因家族成员A(RhoA)的特异性抑制剂C3胞外酶(exoenzyme)对缓激肽诱导的血肿瘤屏障通透性的作用。方法 应用C3exoenzyme预处理大鼠原代脑微血管内皮细胞后,测量跨内皮阻抗值(TEER)、辣根过氧化物酶(HRP)流量,分析血肿瘤屏障的通透性的改变;应用Western blot检测紧密连接相关蛋白(ZO-1)的表达;应用免疫荧光法观察原代大鼠脑微血管内皮细胞紧密连接相关蛋白ZO-1和丝状肌动蛋白(F-actin)结构和分布的改变。结果 C3exoenzyme显著抑制缓激肽诱导TEER值的降低、HRP流量的升高及ZO-1的表达,抑制ZO-1由内皮细胞的边缘向细胞质转移,抑制丝状肌动蛋白由细胞膜边缘向细胞中央区分布,分布于细胞边缘的F-actin明显增加,应力纤维形成明显减少。结论RhoA能够介导缓激肽开放血肿瘤屏障。
RhoA;缓激肽;血肿瘤屏障;紧密连接;ZO-1;肌动蛋白重排
治疗药物进入脑组织发挥作用必须通过由紧密连接(tight junction,TJ)为主要构成成分的血脑屏障(blood-brain barrier,BBB)[1]。虽然肿瘤血管与正常血管相比有不同的结构和功能特征,但同样存在血肿瘤屏障(blood-tumor barrier,BTB),能阻止大部分抗癌药物通过BTB进入肿瘤组织[2]。研究显示,如果肿瘤组织的药物浓度提高2倍,其治疗效应则增加10倍[3]。因此增强药物的转运,提高到达治疗部位的药物浓度是提高治疗效果的关键因素。我们的前期工作证明了缓激肽(bradykinine,BK)可以选择性开放BTB[4],但其具体机制仍不十分清楚。
研究显示,在凝血酶介导内皮细胞屏障功能损坏的过程中,伴随着环腺苷酸(cyclic adenosine monophosphate,cAMP)表达的快速下降和Ras基因家族成员A(Rashomolog gene family member A,RhoA)激活[5]。同样,我们的前期工作证实了cAMP和蛋白激酶A(protein kinase A,PKA)催化亚单位(PKAcs)在BK开放BTB过程中呈低表达[6],提示低表达PKA有助于RhoA的激活[7]。有学者认为,RhoA高表达使内皮细胞中丝状肌动蛋白(filamentous actin,F-actin)聚集成束,变成应力纤维,且其分布由原来的细胞膜边缘区域变成细胞质的中央区域,并使血管内皮细胞钙黏蛋白(VE-cadherin)和紧密连接相关蛋白occludin重分布,造成内皮间的通透性升高[8]。因此我们推测RhoA可能参与BK开放BTB调节过程,拟通过本研究探讨RhoA的特异性抑制剂C3胞外酶(exoenzyme)对缓激肽诱导的血肿瘤屏障通透性的作用。
1 材料与方法
1.1 材料
NU血清(BD Biosciences公司);FBS(杭州四季青公司);DMEM细胞培养基(Gibco公司);zonula occludens-1(ZO-1)抗体(Zymed公司);抗 β-actin抗体(Santa Cruz公司);羊抗兔辣根过氧化物酶标记的IgG二抗(北京中山生物技术公司);phalloidin-TRITC荧光抗体,RhoA特异性抑制剂肉毒梭菌C3胞外酶,缓激肽,辣根过氧化物酶(horseradish peroxidase,HRP)(Sigma公司)。
1.2 方法
1.2.1 脑微血管内皮细胞的培养和体外BTB模型的制作:用CO2吸入法处死<1周的胎大鼠,开颅取全脑,去除脑膜。提取大鼠脑微血管内皮细胞(rat brain microvascular endothelial cells,RBMECs) 及建立体外BTB模型的方法参照文献[6]。首先,大鼠C6胶质瘤细胞经胰酶消化后,将106个细胞种植在胶原包被的Transwell小室的下层,并加入适宜的培养基。2h后翻转小室,加入新鲜培养基。当细胞融合至80%时,将RBMECs接种至Transwell小室的上室(大约105个细胞)。细胞在共培养7~10d后融合。从此,每2d更换1次培养基。在共培养7~10d后,加入药物进行后续实验。
1.2.2 BK及抑制剂的作用和分组:我们的前期研究发现,BK(1μmol/L)处理 RBMECs 15min 时,BTB的通透性达到峰值,以后逐渐恢复。紧密连接相关蛋白ZO-1是RhoA的下游分子,因此我们将RBMECs随机分为7组(每组8例,每组BK终浓度为1μmol/L):BK 0min 组、5min 组、10min 组、15min组、30min组和15min+C3exoenzyme组、对照组(无C6细胞共培养的RBMECs单层,加入等量的1μmol/L无菌生理盐水作用15min)。取C3exoenzyme(50μg/ml)加入 BK 15min 组 Transwell小室的上室培养基中,作用4h后移去上室的所有培养基,加 BK(1μmol/L)至上室。
1.2.3 HRP流量测定:将Transwell中与C6细胞共培养的和单独培养的RBMECs分别转移至1个新的24孔板中。将含有0.5μmol/L HRP的无血清DMEM培养基加入Transwell小室的上室中。在经过BK作用后的特定时间点上,收集下室的培养基,通过色度法测量样品中HRP的含量。HRP流量用通过每平方厘米表面积的皮摩尔数(pmol/cm2)表示。
1.2.4 Western blot检测紧密连接相关蛋白的表达和分布:当Transwell小室的上室的细胞生长至融合时,用含有0.1mmol/L EDTA(不含钙、镁离子)的PBS冲洗,细胞铲小心刮取细胞,倒入1ml裂解液A (2mmol/L EDTA,10mmol/L EGTA,0.4%NaF,20mmol/L Tris-HCl,protease inhibitor cocktail,PMSF,1%Triton X-100,pH 7.5),4℃匀浆,离心,上清液为蛋白样品液。加入抗ZO-1抗体(1︰500),抗β-actin抗体(1︰800),4℃孵育过夜,在羊抗兔辣根过氧化物酶标记的IgG二抗中室温孵育1h,ECL化学发光,X线片曝光、显像,所得胶片用Chemi Imager 5500V2.0软件扫描,通过Fluor Chen 2.0软件进行定量分析,测得光密度值(integrated density value,IDV)。
1.2.5 免疫荧光法观察紧密连接相关蛋白和细胞骨架蛋白的表达和分布:将生长在盖玻片上RBMECs单层用4%多聚甲醛固定,0.5%TritonX-100透化,5%BSA封闭。间接免疫荧光技术步骤进行操作,ZO-1抗体稀释浓度1︰150,阴性对照用0.01mol/L PBS代替一抗,应用FITC标记的荧光二抗 (1︰150),避光条件下染色,甘油封片,荧光显微镜观察,采集图像。直接免疫荧光技术步骤进行操作,phalloidin-TRITC荧光抗体(1︰200)孵育2h,荧光显微镜观察。
1.3 统计学分析
2 结果
2.1 C3exoenzyme抑制BK介导BTB通透性的增加
HRP流量测定结果显示,BK以时间依赖性方式显著增加HRP流量,BK 15min组HRP流量显著高于对照组和BK 0min组(P<0.05),但BK 15min+C3exoenzyme组HRP流量较BK 15min组显著降低(P<0.05)。见图 1。
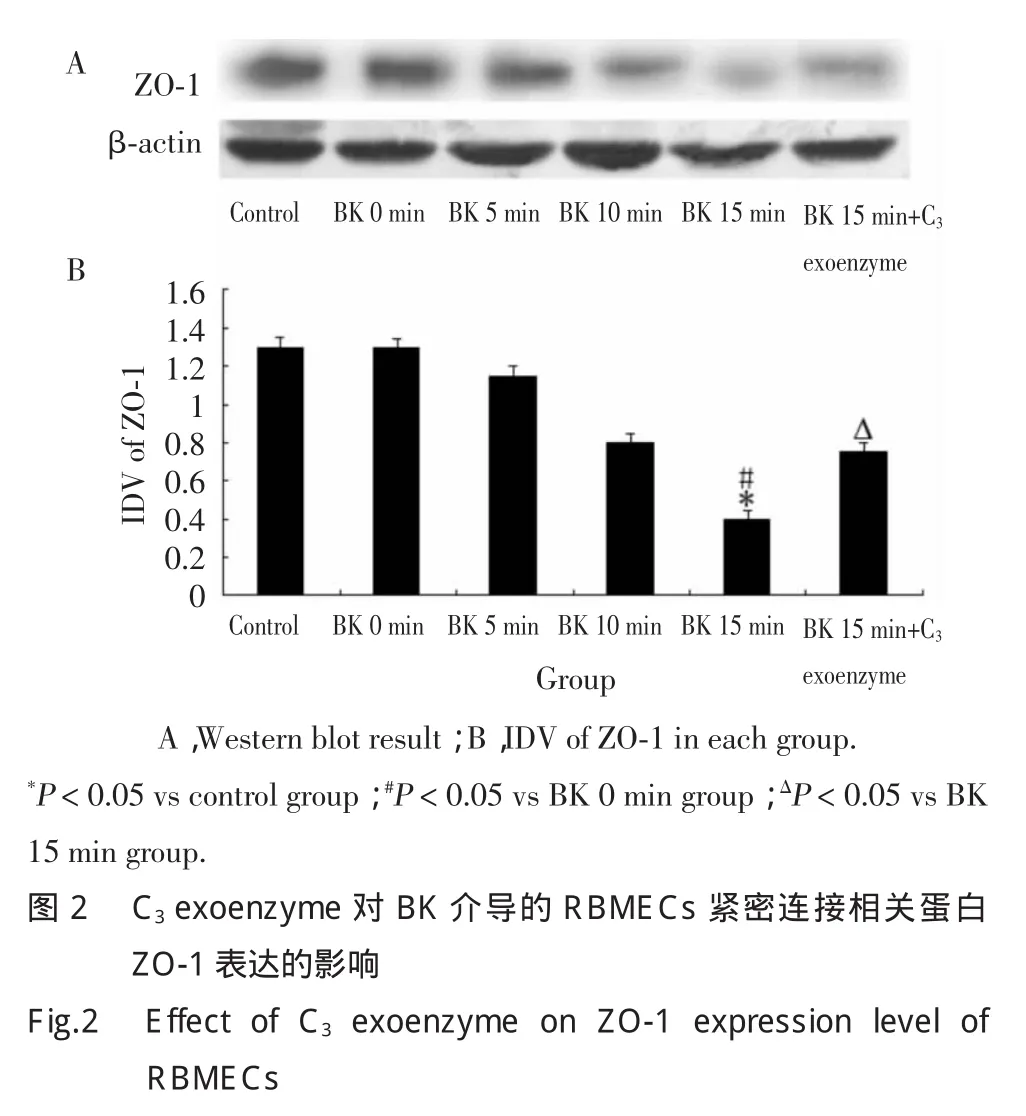
2.2 C3exoenzyme抑制BK介导RBMECs的紧密连接相关蛋白ZO-1表达减少

Western blot结果显示,BK作用5min开始,ZO-1表达逐渐降低。BK 15min组ZO-1表达量显著低于对照组和BK 0min组(P<0.05),但BK 15min+C3exoenzyme组ZO-1表达量较BK 15min组ZO-1表达量显著升高(P<0.05)。见图2。
2.3 C3exoenzyme抑制BK介导的RBMECs紧密连接相关蛋白ZO-1的重分布及细胞骨架F-actin的重排
免疫荧光分析显示,在未处理的细胞中,ZO-1位于内皮细胞边缘,呈连续分布,ZO-1在细胞核中有表达(图3A)。BK处理后,ZO-1的分布由连续状态变为不连续,由内皮细胞的边缘向细胞质转移(图3B)。C3exoenzyme预处理后,ZO-1部分恢复连续分布状态,ZO-1由内皮细胞边缘向细胞质的转移明显减少(图3C)。BK作用前,F-actin呈环状连续分布于RBMECs的边缘,未见应力纤维(图3D)。BK作用后,分布于细胞边缘的F-actin减少,应力纤维形成增加,且分布在细胞中央区(图3E)。C3exoenzyme预处理后,分布于细胞边缘的F-actin明显增加,应力纤维形成明显减少(图3F)。

3 讨论
本研究中,HRP流量实验结果显示,BK作用后HRP流量显著增加,与Easton等[9]的研究结果一致。本研究进一步发现,应用RhoA特异性抑制剂C3exoenzyme预处理后,BTB的通透性显著升高,证明RhoA信号通路参与调节BK介导的BTB通透性增加的过程。
胞质附着蛋白Zonula occludens家族中的ZO-1同样是构成TJ的一个主要蛋白[10]。作为连接跨膜蛋白occludin和claudin-5与细胞骨架蛋白F-actin的桥梁蛋白,ZO-1的分布和表达的变化同样影响TJ的结构和功能[11]。本研究发现,BK作用后,ZO-1表达显著下降,C3exoenzyme预处理后,ZO-1表达量则显著升高,说明RhoA信号通路参与BK介导的TJ开放。
最近的研究显示,F-actin在紧密连接复合物的结构支撑和功能调节方面都发挥着重要的作用[12]。为了进一步明确RhoA信号通路,与细胞骨架重排、紧密连接相关蛋白重分布、BTB通透性增高的关系,我们采用C3exoenzyme预处理后,应用免疫荧光技术观察细胞骨架重排,紧密连接相关蛋白重分布的变化,明确RhoA信号通路与细胞骨架重排、紧密连接相关蛋白重分布的关系。细胞骨架有丝状肌动蛋白、中间纤维和微管3种组成成分,其中F-actin与内皮细胞的通透性的关系最为密切,在某些生理和病理条件下,F-actin聚集成束,变成应力纤维,使细胞收缩。Birukova等[13]研究证实,RhoA具有激发应力纤维形成,引起内皮细胞通透性增高的作用。本研究发现,BK作用后,ZO-1重新分布,由细胞膜及细胞边缘向细胞质转移,同时F-actin由环状连续分布于RBMECs的边缘向细胞质中发生分布转移,同时伴有大量应力纤维形成。应力纤维收缩,牵拉ZO-1蛋白,使细胞膜上跨膜蛋白重分布,紧密连接结构变化,使BTB通透性升高。C3exoenzyme抑制了ZO-1的重分布、F-actin的重排和应力纤维的形成。说明RhoA信号通路参与了BK介导的细胞骨架重排,紧密连接相关蛋白重分布,BTB通透性增高的过程。
[1]Siegal T,Zylber-Katz E.Strategies for increasing drug delivery to the brain:focus on brain lymphoma [J].Clin Pharmacokinet,2002,41(3):171-186.
[2]Erdlenbruch B,Schinkhof C,Kugler W,et al.Intracarotid administration of short-chain alkylglycerols for increased delivery of methotrexate to the rat brain [J].Br J Pharmacol,2003,139(4):685-694.
[3]Samoto K,Perng GC,Ehtesham M,et al.A herpes simplex virus type 1mutant deleted for gamma 34.5and LAT kills glioma cells in vitro and is inhibited for in vivo reactivation [J].Cancer Gene Ther,2001,8(4):269-277.
[4]刘丽波,薛一雪,王萍.缓激肽对脑胶质瘤大鼠occludin和ZO-1mRNA 的调节和机制[J].中国医科大学学报,2010,39(7):497-500.
[5]Baumer Y,Spindler V,Werthmann RC,et al.Role of Rac 1and cAMP in endothelial barrier stabilization and thrombin-induced barrier breakdown[J].J Cell Physiol,2009,220(3):716-726.
[6]Liu LB,Xue YX,Liu YH,et al.Bradykinin increases blood-tumor barrier permeability by down-regulating the expression levels of ZO-1,occludin,and claudin-5and rearranging actin cytoskeleton [J].J Neurosci Res,2008,86(5):1153-1168.
[7]Meiri D,Greeve MA,Brunet A,et al.Modulation of Rho guanine exchange factor Lfc activity by protein kinase A-mediated phosphorylation[J].Mol Cell Biol,2009,29(21):5963-5973.
[8]Li B,Zhao WD,Tan ZM,et al.Involvement of Rho/ROCK signalling in small cell lung cancer migration through human brain microvascular endothelial cells[J].FEBS Lett,2006,580(17):4252-4260.
[9]Easton AS,Abbott NJ.Bradykinin increases permeability by calcium and 5-lipoxygenase in the ECV304/C6cell culture model of the blood-brain barrier[J].Brain Res,2002,953(1-2):157-169.
[10]Nakagawa S,Deli MA,Kawaguchi H,et al.A new blood-brain barrier model using primary rat brain endothelial cells,pericytes and astrocytes[J].Neurochem Int,2009,54(3-4):253-263.
[11]Hopkins AM,Walsh SV,Verkade P,et al.Constitutive activation of
Rho proteins by CNF-1influences tight junction structure and ep
ithelial barrier function[J].J Cell Sci,2003,116(Pt 4):725-742.[12]Dudek SM,Garcia JG.Cytoskeletal regulation of pulmonary vascular permeability[J].J Appl Physiol,2001,91(4):1487-1500.
[13]Birukova AA,Smurova K,Birukov KG,et al.Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction[J].Microvasc Res,2004,67(1):64-77.
(编辑王又冬,英文编辑王又冬)
C3Exoenzyme Inhibits Bradykinin-induced Selective Increase of the Permeability of Blood-tumor Barrier
MA Teng1,LIU Xiao-bai2,XUE Yi-xue1
(1.Department of Neurobiology,College of Basic Medical Sciences,China Medical University,Shenyang 110001,China;2.The 96th Class,7-year Program,Clinical Medicine,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the effect of C3exoenzyme,a specificRashomolog gene family member A (RhoA)inhibitor,on bradykinin(BK)-induced increase in blood-tumor barrier (BTB)permeability.MethodsRat brain microvascular endothelail cells(RBMECs)were pretreated with C3exoenzyme and then treated with BK for 15minutes.Horseradish peroxidase (HRP)flux and TEER assays were employed to reveal BTB permeability.The protein expression level of ZO-1was observed by Western blot.The stress fiber formation and distribution of filamentous actin (F-actin)and ZO-1were assessed by immunofluorescence microscopy.ResultsC3exoenzyme could partially inhibit endothelial leakage and restored normal TEER values in RBMECs.The expression level of ZO-1protein decreased significantly and it was prevented by C3exoenzyme.C3exoenzyme inhibited BK-induced relocation of ZO-1from cellular borders into the cytoplasm as well as stress fiber formation in RBMECs.ConclusionRhoA plays a key role in BK-induced openning of blood-tumor barrier.
RhoA;bradykinin;blood-tumor barrier;tight junction;ZO-1;actin rearrangement
R338.2
A
0258-4646(2011)02-0097-04
doiCNKI:21-1227/R.20110212.0957.029
国家自然科学基金资助项目(30872656,30670723,30973079);高等学校博士学科点专项科研基金资助项目(20092104110015);沈阳市科学技术计划项目(1072033-1-00,1081266-9-00)
马腾(1976-),男,讲师,博士.
薛一雪,E-mail:xueyxiue888@yahoo.com.cn
2010-11-11
