液相色谱-串联质谱法检测反应性代谢物
2011-02-02钟大放陈笑艳
谢 岑,钟大放,陈笑艳
(中国科学院上海药物研究所,上海 201203)
液相色谱-串联质谱法检测反应性代谢物
谢 岑,钟大放,陈笑艳
(中国科学院上海药物研究所,上海 201203)
已有报道一些药物进入体内后在各种代谢酶的作用下转化为反应性代谢物,然后与生物大分子(如蛋白、DNA)共价结合,导致毒性。在药物发现和开发阶段进行反应性代谢物筛查,对上市药物进行反应性代谢物监测已经成为一个重要的研究领域。通常,反应性代谢物具有亲电性,能被小分子亲核试剂(如谷胱甘肽及其衍生物、氰离子、胺类等)体外捕获,采用液相色谱-串联质谱法检测并鉴定这些结合物的结构是研究反应性代谢物的基本方法。本文综述了液相色谱与不同质谱仪联用(三重四极杆、离子阱、四极杆-线性离子阱、高分辨质谱仪)检测反应性代谢产物的方法以及应用进展。
液相色谱-串联质谱(LC-MS/MS);反应性代谢物;捕获试剂
药物在体内经过生物转化后,生成的代谢产物大多数极性增加、水溶性提高、药理活性减弱或完全失活,因此,代谢反应常被认为是生物解毒过程。在某些情况下是经过代谢形成具有亲电性的反应性代谢中间体;但在更多情况下是经代谢形成的具有亲电性的反应性代谢中间体导致毒性的,它们可通过烷化、酰化与生物大分子(DNA或蛋白质)发生共价结合,导致细胞功能瓦解或激发免疫反应[1]。反应性代谢产物或中间体的生成往往是在药物代谢酶介导下产生的,称为生物活化过程。
由于化学不稳定性以及体内存在一些去毒性代谢途径,药物代谢过程中生成的高反应性亲电代谢物或中间体不易被测出。目前,常使用带NADPH的肝微粒体以及适当的亲核性捕获剂鉴定反应性代谢产物[2-3],例如谷胱甘肽(GSH)、半胱氨酸或N-乙酰半胱氨酸、氰离子、氨基脲和甲氧基胺类等。根据与反应性代谢物结合的亲核物质类型,可以将反应性代谢物分为“强”亲电性代谢物和“弱”亲电性代谢物。其中,与含N、O和C亲核物质反应的为“强”亲电性代谢物,与含S亲核试剂反应的为“弱”亲电性代谢物[3]。
目前,已有很多关于药物在CYP450等酶的催化下,在体内形成反应性代谢物而导致药物毒性的报道[4-9]。如降糖药曲格列酮、抗抑郁药萘法唑酮等药物,被证明产生反应性代谢中间体,与蛋白生成加合物可以导致严重的肝毒性,因此先后撤出市场。一些药用植物成分,如马兜铃酸、吡咯里西啶类生物碱、异喹啉类生物碱等,也被证明生成的反应性代谢物导致毒性。在药物的发现和开发阶段进行反应性代谢物筛查,对上市药物进行反应性代谢物监测已经成为药物代谢毒理学的重要研究领域。本文将主要介绍液相色谱-串联质谱(LC-MS/MS)法应用于反应性代谢物检测和鉴定以及应用进展。
1 谷胱甘肽捕获反应性代谢物
谷胱甘肽(glutathione,GSH)是由3个氨基酸(谷氨酸、半胱氨酸、甘氨酸)组成的小肽,分子中存在1个巯基,可以与反应性代谢中间体的亲电基团(如苯醌、苯醌亚胺、Michael受体等)反应,形成稳定的结合物。在正离子扫描模式下,GSH结合物具有相似的质谱裂解规律,示于图1。通常易中性丢失129 u(焦谷氨酸)产生e型碎片离子,因此,利用中性丢失扫描129 u可以快速检测 GSH结合物,这是筛选 GSH结合物的传统方法[10]。但在正离子模式下,中性丢失扫描检测 GSH结合物的方法主要存在两方面不足:其一是选择性差,基质中的许多内源性物质均能产生与GSH结合物无关的129 u中性丢失,因此,在进行复杂生物样品分析时易出现假阳性结果[11];其二,并非所有 GSH结合物都会产生129 u中性丢失,如在正离子模式下,脂肪族及苄位的硫醚型 GSH结合物通常产生307 u(GSH)中性丢失,而硫酯一般先丢失焦谷氨酸,然后脱去一分子水,即产生147 u中性丢失[12],对于这些类型的结合物,如果只扫描129 u中性丢失就会引入假阴性结果。
为了提高选择性,减少假阳性结果的产生,可以采用 Q-TOF质谱精确中性丢失扫描129.042 6 u(焦谷氨酸的精确分子质量)以检测GSH结合物[13]。一般情况,内源性物质会产生与GSH结合物相同理论质量的中性丢失(129 u),但很难产生相同精确质量的中性丢失(129.042 6 u),因此,采用Q-TOF高分辨质谱可以有效减少内源性物质对结果的干扰,从而减少假阳性结果的产生。Q-TOF质谱并不具有真正的中性丢失扫描,而是在两次不同碰撞能量的全扫描之间来回切换,低能量(5 eV)下获得前体离子,高能量(20 eV)下获得产物离子,从而实现“伪”中性丢失扫描。当仪器检测到能产生129.042 6 u中性丢失的前体离子时,即可对其进行产物离子扫描。与传统的中性丢失扫描相比,利用Q-TOF质谱进行中性丢失扫描可以提供更高的选择性,高分辨的碎片离子信息有助于GSH结合物的结构解析,一次进样的同时采集了前体离子和产物离子,大大缩短了分析时间。
应用稳定同位素标记的GSH作为捕获剂,可以有效的识别假阳性结果[15-16]。将天然存在的GSH与稳定同位素标记的 GSH(GSX,13C2-15N标记在甘氨酸残基)等摩尔比混合,以捕获微粒体孵化液中的反应性代谢物,采用中性丢失扫描129 u进行检测。GSH/GSX结合物在对应的质谱图中能产生相差3 u的同位素峰,丰度比为1∶1。采用这种方法检测对乙酰氨基酚在人肝微粒体中的反应性代谢物,在中性丢失扫描的总离子流图中主要检测到3个色谱峰,但仅在1个峰对应的质谱图中观察到m/z457/460一对等丰度的同位素峰,因此确定另2个峰为假阳性结果。
为了减少假阴性结果的产生,Dieckhaus等[17]研究各种类型(苯环、苄基、脂肪族和硫酯)的GSH结合物在负离子模式下的二级质谱图后发现,尽管结合位点和类型不同,但是所有的结合物具有与GSH分子相同的质谱裂解规律,即均能产生响应较强的m/z272碎片离子,示于图2。因此,可以在负离子模式下对m/z272碎片离子进行前体离子扫描,更全面地筛选各种类型的GSH结合物。通常,GSH结合物在负离子下产生的碎片离子主要来自于 GSH分子,而在正离子下产生的碎片离子主要来自于药物分子,因此,在正离子模式下获得的二级质谱图更有利于结构解析[17]。Wen等[18]利用Q-Trap的正负离子切换功能,在负离子下进行前体离子扫描(m/z272)以作为探测扫描,对于信号强度超过阈值的离子则切换到正离子模式下进行增强的产物离子扫描,以获得探测扫描所得前体离子的高质量产物离子质谱图,从而实现高通量筛选和鉴定反应性代谢物。该方法已被成功地应用于多种药物的反应性代谢物检测,如对乙酰氨基酚[18]、曲唑酮[19]、阿米替林及其代谢物去甲替林[20]。与中性丢失扫描相比,前体离子扫描(m/z272)表现出更高的灵敏度和选择性[18]。为了进一步提高检测灵敏度,并减少假阳性结果,可以同时对m/z272和m/z254(由m/z272碎片离子脱水产生)两个碎片离子进行双前体离子扫描[21]。
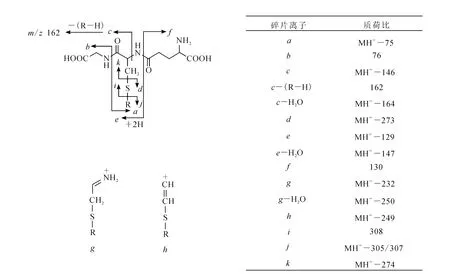
图1 谷胱甘肽结合物的特征碎片离子[14]Fig.1 Characteristic fragment ions of glutathione conjugates under collision-induced dissociation[14]

图2 推测的GSH在负离子模式下的质谱裂解途径[17]Fig.2 Proposed fragmentation of GSHunder negative mode following collision-induced dissociation[17]
Zheng等[22]开发了一种新型的分析方法,采用多反应监测(MRM)结合增强的产物离子扫描快速筛选和鉴定反应性代谢物。在MRM中,根据可能的 GSH结合物类型设定前体离子,将其中性丢失129 u和307 u后的碎片离子作为监测的产物离子,同时对114对的离子反应进行监测,对其中信号强度超过阈值的离子进行增强的产物离子扫描。采用该方法对若干模型化合物(包括对乙酰氨基酚、双氯芬酸和卡马西平的反应性代谢物)进行检测,结果表明,基于MRM的方法灵敏度比传统的中性丢失扫描最多可提高179倍,比前体离子扫描提高了10倍。与传统的中性丢失扫描相比,该方法的选择性也有较大的提高。例如,采用该方法检测出卡马西平在人肝微粒体孵化液中的7种 GSH结合物,而由于受到内源性物质干扰,传统的中性丢失扫描仅能检测出其中的2种。然而,这种方法的应用也有局限性,它只能用于检测常规的可被预测的 GSH结合物,而对那些非常规的结合物,采用中性丢失和前体离子扫描则更有效。
高分辨质谱多数不具备中性丢失、前体离子扫描和MRM功能,这就限制其在检测复杂基质代谢物中的应用。为了克服这一缺点,Zhang[22]和Zhu等[23]利用代谢物与原形药物具有相近的质量亏损,开发了质量亏损过滤(mass defect filter,MDF)技术,它属于数据后处理技术,可用于筛选各种常规和非常规的代谢产物。常见GSH结合物的质量亏损列于表1。对7种模型化合物的肝微粒体孵化液或胆汁中 GSH结合物的检测表明,该方法具有更高的灵敏度和选择性,高分辨质谱数据也有助于结合物分子式组成的确定和结构解析[24]。
Zhang等[25]开发了一种新型的数据处理技术,称为背景扣除法。它是通过比较特定时间段内给药样品与对照样品的高分辨质谱数据,自动识别并扣除与背景相关的信号,从而筛查可能的代谢物相关离子。这种方法被用于双氯芬酸在人肝微粒体孵化液中反应性代谢物的检测。色谱图经背景扣除处理后,共检测到10种 GSH结合物,而这些结合物在未经处理的色谱图中是难以观察到的;同样,质谱图经背景扣除处理后,可以清晰地观察到 GSH结合物的双电荷离子峰和三电荷离子峰,但在未经处理的质谱图中,这两个离子被大量的内源性干扰离子包围。该方法与MDF技术联合使用已成功地用于检测大鼠血浆、胆汁和尿中曲格列酮的反应性代谢物[26]。由此可见,背景扣除法可以有效地检测各种复杂生物基质中的反应性代谢物,减少内源性物质的干扰,且不需要对代谢物的质量数和质谱裂解途径进行预判,它对于在离子源中形成的多电荷离子GSH结合物的检测尤为重要。

表1 在人肝微粒体孵化液中常见反应性代谢物的GSH结合物的质量变化和质量亏损[11]Table 1 Mass shifts and mass defects of GSHadducts of common reactive metabolites formed in human liver microsomes[11]
为了进一步提高选择性,将天然存在的GSH与稳定同位素标记的 GSX按摩尔比2∶1混合,用于捕获微粒体孵化液中的反应性代谢物[27]。采用L TQ-Orbitrap质谱检测,对于能产生特征同位素峰的离子自动进行产物离子扫描;采用MDF、同位素峰分布过滤和背景扣除技术进行数据后处理,能快速、高效地筛选对乙酰氨基酚等药物的反应性代谢物。
2 谷胱甘肽衍生物捕获反应性代谢物
通常,为了满足质谱检测灵敏度的要求而使用高浓度的底物与肝微粒体共同孵化,但如果化合物的溶解度较差,则不能获得高浓度的孵化液,这可能导致无法检测到反应性代谢物。由于GSH结构中含有羧基,会降低正离子检测的灵敏度,因此以谷胱甘肽乙酯(GSH-EE,图3a)为捕获试剂,在正离子模式下可获得较强的质谱响应;GSH-EE的谷氨酸残基未发生改变,会产生129 u中性丢失,因此可采用中性丢失扫描129 u进行检测[28]。实验表明,GSH-EE结合物的质谱响应比普通的 GSH结合物高了近10倍,对于溶解度差的化合物,即使降低其在孵化体系中的浓度,也不影响反应性代谢产物的检测。Wen等[29]以 GSH-EE作为捕获剂,在负离子下进行前体离子扫描(m/z300),再切换到正离子模式下进行增强的产物离子扫描,可以有效地消除肝微粒体中少量内源性GSH结合物的干扰。
γ-谷氨酰半胱氨酰赖氨酸(GSK,图3b)是一种将GSH中的甘氨酸用赖氨酸替换的新型捕获试剂,它可以同时筛选“软”和“硬”反应性代谢产物[30]。由于 GSK结构中保留了谷氨酸残基,因此其结合物在正离子模式下仍可产生129 u中性丢失。将 GSK与13C6-15N2-GSK(标记在赖氨酸残基)等摩尔比混合,捕获反应性代谢物,利用中性丢失扫描129 u,GSK/13C6-15N2-GSK结合物能产生相差8 u的等丰度同位素峰。该方法具有快速、灵敏和可靠的特点,可以在体外筛选不同类型的反应性代谢物。
除 GSH外,N-乙酰半胱氨酸(NAC,图3c)也可以作为“软”反应性代谢物的捕获试剂。在负离子模式下,NAC会产生特征的129 u中性丢失(由NAC硫醚键断裂产生的),因此可通过中性丢失扫描快速筛选NAC结合物,也可根据可能的NAC结合物设定前体离子,将其中性丢失129 u后的碎片离子作为监测的产物离子,同时对多对离子反应进行 MRM检测[31]。Jian等[32]采用负离子模式下的中性丢失扫描(或MRM)结合正离子模式下的增强产物离子扫描,快速筛查和鉴定了肝微粒体和尿中的NAC结合物。在某些情况下,NAC可代替 GSH作为亲核捕获剂,但当加合反应由谷胱甘肽转移酶催化(即使是部分催化)时,NAC不再适用。
如上文所述,将 GSH和稳定同位素标记的GSX按一定比例混合作为捕获剂,通过同位素峰分布过滤的方法可以有效地筛查反应性代谢物。但稳定同位素标记的 GSX较为昂贵,限制了该方法的广泛使用。因此,LeBlanc[33]设计了一种新型捕获试剂N-2-溴-苄氧羰基谷胱甘肽(GSH-Br,图3d),它与反应性代谢物形成的结合物在质谱中会产生相差2 u的等丰度同位素峰,利用同位素峰分布过滤和MDF技术对结果进行筛选,可以提高选择性,消除假阳性结果。
将谷胱甘肽与荧光基团丹磺酰基反应生成丹磺酰谷胱甘肽(d-GSH,图 3e),采用 LCFLD-MS/MS法进行测定,可以实现对反应性代谢物的定量分析[34]。d-GSH结合物的最大激发和发射波长分别为340 nm和525 nm。实验表明,d-GSH和 GSH具有相近的反应活性,但d-GSH不是谷胱甘肽转移酶的辅酶,所以对筛选需要谷胱甘肽转移酶催化的化合物不适用。此外,该方法需要较长的色谱运行时间,不能用于高通量筛选。
Soglia[35]报道了以季铵型谷胱甘肽衍生物(QA-GSH,图 3f)作为捕获剂,采用 LC-MS/MS法对反应性代谢物进行半定量分析。QAGSH带1个正电荷,可以增强离子化效率而提高检测灵敏度,也可以使不同的QA-GSH结合物具有相近的质谱响应。对3种化合物及其QA-GSH结合物的对照品进行质谱分析发现,3种化合物的质谱响应具有19倍的差异,但是结合物对照品的质谱响应差别在3倍以内,表明不同QA-GSH结合物的质谱响应具有均一性。因此,可以用具有对照品的QA-GSH结合物对候选化合物的QA-GSH结合物进行半定量分析,从而评价化合物生物活化水平。通过对不同QA-GSH结合物的二级质谱分析发现,它们均具有相同的m/z144碎片离子,因此以 QAGSH结合物的相对分子质量作为前体离子,以m/z144碎片离子作为监测的产物离子,采用MRM法进行半定量测定,示于图4。但这种方法存在3点不足:1)只能与“软”反应性代谢物结合,因此无法对所有的反应性代谢物进行半定量分析;2)不适用于双QA-GSH或多QA-GSH结合物;3)不适用于需要谷胱甘肽转移酶催化的化合物。

图3 各种GSH衍生物的化学结构式Fig.3 Chemical structures of different GSH derivatives

图4 LC-MS/MS法对 QA-GSH结合物进行半定量分析[35]Fig.4 A semiquantitative method for the determination of QA-GSHconjugate by LC-MS/MS[35]
3 氰离子捕获反应性代谢物
氰离子(CN-)是一种“硬”亲核试剂,可用于捕获亚胺正离子型反应性代谢物,示于图5。文献[36-37]采用 K14CN作为捕获试剂,检测并定量亚胺正离子型的反应性代谢物。这种方法虽然选择性高,但是成本高,限制了它的使用。
正离子模式下,氰基结合物会产生特征的27 u(HCN)中性丢失,因此,可通过中性丢失扫描(27 u)快速筛选氰基结合物[38]。但进行中性丢失扫描(27 u)时发现,许多内源性物质也会产生相同的中性丢失,极易产生假阳性结果。因此,可以采用等摩尔比混合的 KCN和稳定同位素标记的 K13C15N作为捕获剂,对27 u和29 u(HCN和 H13C15N)进行中性丢失扫描,氰基结合物会产生相差2 u(单加合物)或4 u(双加合物),且丰度比为1∶1的1对同位素峰[39]。这种方法可以有效地检测亚胺正离子型的反应性代谢物,目前已广泛应用于脂环胺类药物(氯氮平、酮康唑、环丙沙星、噻氯匹啶等)的反应性代谢物研究中[2,39-40]。
4 氨基脲和甲氧基胺捕获反应性代谢物

图5 氰离子捕获亚胺正离子型反应性代谢物[40]Fig.5 Use of cyanide to trap an iminium ion reactive metabolite[40]
有些药物经代谢活化会生成带有醛基的反应性代谢物,代谢物可与蛋白上的碱性氨基反应形成希夫氏碱,这种醛型反应性代谢物也可被氨基脲或甲氧基胺等“硬”亲核试剂所捕获。代表性的实验方法是向孵育体系中加入5 mmol/L氨基脲或甲氧基胺,然后进行 LC-MS/MS分析[2,14,39]。
Zhang等[41-42]以氨基脲和甲氧基胺作为捕获剂,研究了L-739010和L-746530的生物活化途径。结果发现,两个化合物结构中的呋喃环均会在CYP3A酶的催化下开环,形成醛型反应性代谢物,后者可被氨基脲和甲氧基胺捕获,通过LC-MS/MS分析,鉴定了结合物的结构,从而推测了可能的生物活化途径,示于图6。
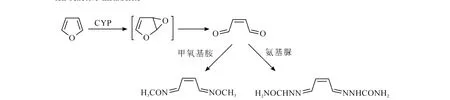
图6 采用甲氧基胺或氨基脲捕获呋喃的醛型反应性代谢物Fig.6 Use of methoxylamine and semicarbazide to trap an aldehyde reactive metabolite
5 反应性代谢物研究举例
蝙蝠葛碱为一种双苄基四氢异喹啉类生物碱,含有亚甲基苯酚结构。本实验室[6]采用LC/MSn法检测其在人肝微粒体孵化液和SD大鼠胆汁中的反应性代谢物。在人肝微粒体孵化液中共检测到4种 GSH结合物(M6、M7-1、M7-2和M8,示于图7),在大鼠胆汁中共检测到3种GSH结合物(M6、M7-1和M7-2)。为了确定结构,选择性的进行多级全扫描质谱分析,M6~M8产生的主要中性丢失均为129 u(焦谷氨酸)、273 u(GSH-H2S)和 307 u(GSH)。通过与化学合成的对照品比对,最终确定M6为原形蝙蝠葛碱GSH结合物,M7-1和M7-2为2-N-去甲基蝙蝠葛碱GSH结合物,M8为N-去甲基-O-去甲基蝙蝠葛碱 GSH结合物,GSH均结合在C-17位上。这表明,蝙蝠葛碱的生物活化途径主要是经代谢酶氧化生成对亚甲基醌型反应性代谢中间体。Zheng等[43]采用CD-1小鼠和人肺细胞株进行毒性研究,发现蝙蝠葛碱可导致严重的肺毒性,且与反应性代谢物生成有关。
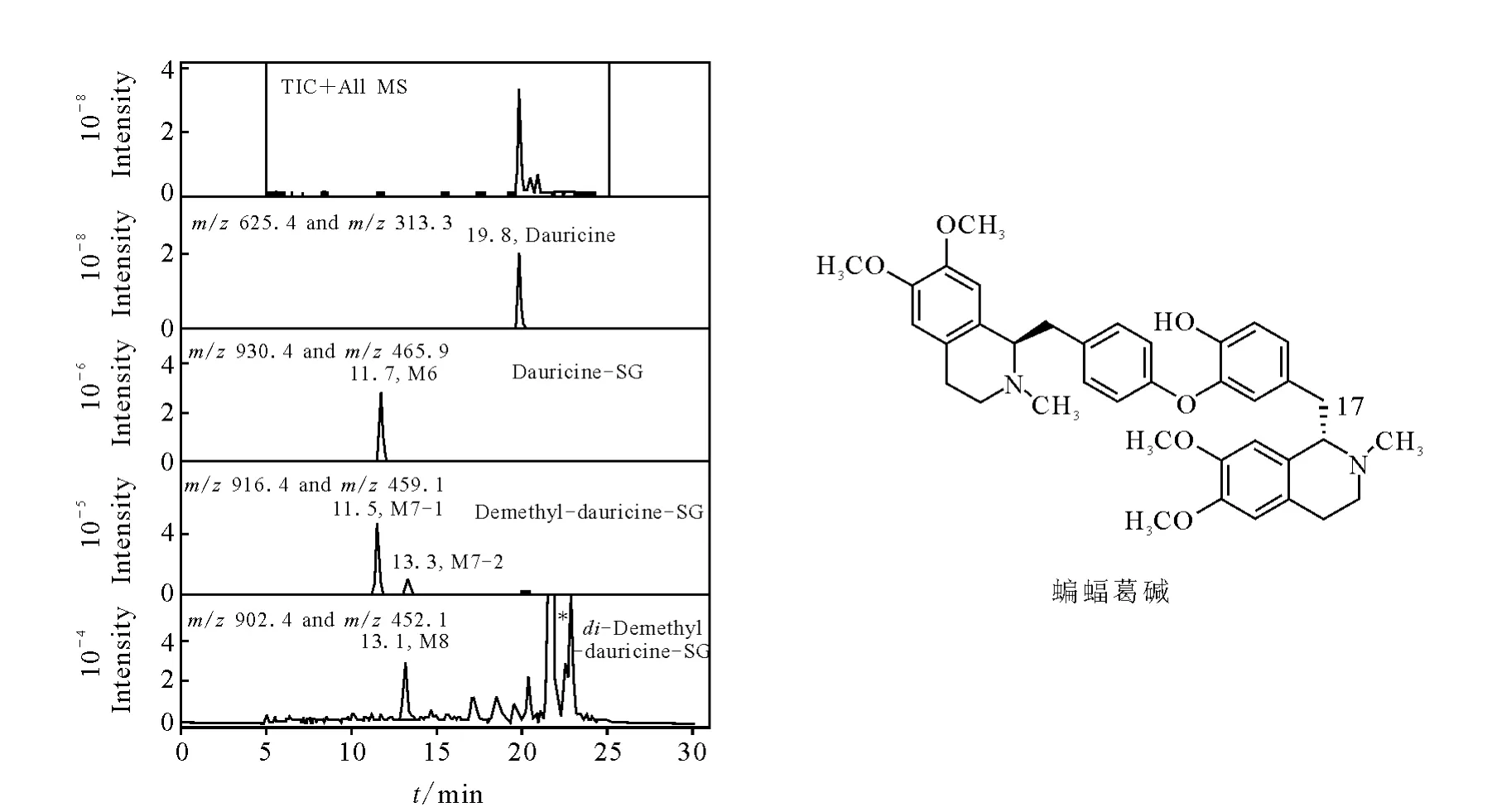
图7 蝙蝠葛碱人肝微粒体孵化液中检测到的 GSH结合物[6]Fig.7 Extracted ion[M+H]+and[M+2H]2+chromatograms of four dauricine-derived GSH conjugates in human liver microsomal incubations[6]
4-壬基苯酚(4-NP)为常见的环境污染物,具有生殖毒性。本实验室[44]采用 UPLC/QTOF MS法研究了4-NP在人肝微粒体中的生物活化过程。将4-NP与人肝微粒体共同孵化,加入NADPH启始反应,GSH捕获反应性代谢物,采用 MDF的 GSH筛查功能处理色谱图。在孵化体系中共检测到6种结合物,示于图8。采用MDF的常规代谢物筛选功能处理色谱图,在孵化体系中共检测到19种氧化代谢物。根据获得的高分辨质谱信息,鉴定了代谢产物的结构,证明4-NP主要有两种生物活化途径:其一是4-NP直接氧化为亚甲基醌型反应性中间体;其二是4-NP先经羟基化生成邻二酚羟基,后者再自氧化形成邻醌型反应性中间体。

图8 采用 Q-TOF质谱法和MDF技术检测到4-壬基苯酚在人肝微粒体中的 GSH结合物[44]Fig.8 Q-TOF MS and MDF analysis of 4-nonylphenol-derived GSH conjugates formed in the human liver microsomal incubations[44]
绿原酸为多种中药注射剂(双黄连、清开灵、脉络宁注射液等)的主要成分之一,本文作者[45]采用UPLC/Q-TOF MS法研究了SD大鼠静脉注射绿原酸后,胆汁、尿、粪和血浆中可能的代谢产物。采用MDF技术对高分辨质谱数据进行处理,除原形药物外,共检测到35种代谢产物,其中,胆汁中19种、尿中18种、粪中12种、血浆中3种,推测的代谢途径示于图9。在胆汁中检测到了多种 GSH结合物,如绿原酸及O-甲基绿原酸的 GSH结合物(M4和M5)和绿原酸水解产物咖啡酸的 GSH结合物(M6),此外,在胆汁及粪中还检测到了 GSH结合物的次级降解产物O-甲基绿原酸半胱氨酰甘氨酸结合物(M2)和O-甲基绿原酸半胱氨酸结合物(M3)。实验结果提示,绿原酸的烯酮双键具有很强的亲电性,可能与蛋白的巯基共价结合导致过敏性不良反应,该项研究为认识含绿原酸中药注射剂的过敏性反应机理提供了重要线索。

图9 推测的大鼠体内绿原酸主要代谢途径[45]Fig.9 Proposed major metabolic pathways of chlorogenic acid in rats[45]
6 挑战与展望
检测反应性代谢物在药物发现和发展阶段越来越受到重视。尽早进行反应性代谢物研究,鉴定易代谢活化的位点,有助于设计新的候选药物,降低药物毒性、提高药物开发的成功率。LC-MS/MS已经成为检测和鉴定反应性代谢物的重要方法。目前,质谱技术(包括三重四极杆、离子阱、四极杆-线性离子阱、高分辨质谱)的发展、数据处理方法(MDF和背景扣除法)的开发、各种捕获试剂的应用,极大推动了反应性代谢物的研究,可实现高通量筛选。
然而,由于药物结合 GSH后,结合物的质谱响应通常与原形差异较大,所以常规的质谱方法无法实现对反应性代谢物的定量测定和该代谢途径规模的获知。反应性代谢物最直接的定量方法是通过化学合成对照品或采用放射性标记方法进行定量,但是一般反应性代谢物筛查是在早期的药物发现阶段进行,化学合成对照品或标记化合物周期长且难度大,不能满足高通量的要求。LC/UV法可以用于 GSH结合物的定量测定,但受到灵敏度的限制[11]。一些新型的捕获试剂,如连有荧光基团的丹磺酰谷胱甘肽[34]和季铵型谷胱甘肽[35],也被用于反应性代谢物的定量或半定量研究中,但是这些结构修饰是否会影响 GSH的反应活性仍不明确,且 GSH衍生物绝大多数不是谷胱甘肽转移酶的底物。Valaskovic等[46]利用超低流速的纳升喷雾(nanospray)技术,可大致按等摩尔比将代谢物的质谱响应归一化,从而初步实现对代谢物的定量分析,但这种方法尚未被广泛地用于反应性代谢物的研究中。总体来说,定量评价反应性代谢物仍面临极大的挑战,因此,需要进一步开发新的质谱技术和适用性更广的捕获试剂,以实现快速准确定量反应性代谢物。
[1]PARK B K,KITTERINGHAM N R,MAGGS J L,et al.The role of metabolic activation in druginduced hepatotoxicity[J]. AnnualReview of Pharmacology and Toxicology, 2005, 45:177-202.
[2]EVANS D C,WATT A P,NICOLL-GRIFFITH D A,et al.Drug-protein adducts:an industry perspective on minimizing the potential for drug bioactivation in drug discovery and development[J].Chemical Research in Toxicology,2004,17(1):3-16.
[3]ZHOU S,CHAN E,DUAN W,et al.Drug bioactivation,covalent binding to target proteins and toxicity relevance[J].Drug Metabolism Reviews,2005,37(1):41-213.
[4]TANGJ,AKAO T,NAKAMURA N,et al.In vitro metabolism of isoline,a pyrrolizidine alkaloid from Ligularia duciformis,by rodent liver microsomal esterase and enhanced hepatotoxicity by esterase inhibitors[J].Drug Metab Lism and Disposition:The Biological Fate of Chemicals,2007,35(10):1 832-1 839.
[5]XIA Q,YAN J,CHOU M W,et al.Formation of DHP-derived DNA adducts from metabolic activation of the prototype heliotridine-type pyrrolizidine alkaloid,heliotrine[J].Toxicology Letters,2008,178(2):77-82.
[6]WANG Y,ZHONG D,CHEN X,et al.Identification of quinone methide metabolites of dauricine in human liver microsomes and in rat bile[J].Chemical Research in Toxicology,2009,22(5):824-834.
[7]KAL GU TKAR A S,VAZ A D,LAM E M E,et al.Bioactivation of the nontricyclic antidepressant nefazodone to a reactive quinone-imine species in human liver microsomes and recombinant cytochrome P450 3A4[J].Drug Metab Lism and Disposition:The Biological Fate of Chemicals,2005,33(2):243-253.
[8]KASSA HUN K,PEARSON P G,TAN G W,et al.Studies on the metabolism of troglitazone to reactive intermediates in vitro and in vivo.Evidence for novel biotransformation pathways involving quinone methide formation and thiazolidinedione ring scission[J].Chemical Research in Toxicology,2000,14(1):62-70.
[9]ZHOU S F,XUE C C,YU X Q,et al.Metabolic activation of herbal and dietary constituents and its clinical and toxicological implications:An update[J].Curr Drug Metab,2007,8(6):526-553.
[10]CHEN W G,ZHANG C,AVERY M J,et al.Reactive metabolite screen for reducing candidate attrition in drug discovery[J].Advances in Experimental Medicine and Biology,2001,500:521-524.
[11]MA S,ZHU M.Recent advances in applications of liquid chromatography-tandem mass spectrometry to the analysis of reactive drug metabolites[J].Chemico-Biological Interactions,2009,179(1):25-37.
[12]GRILLO M P,HUA F,KNUTSON C G,et al.Mechanistic studies on the bioactivation of diclofenac:identification of diclofenac-S-acyl-glutathione in vitro in incubations with rat and human hepatocytes[J].Chemical Research in Toxicology,2003,16(11):1 410-1 417.
[13]CASTRO-PEREZ J,PLUMB R,L IAN G L,et al.A high-throughput liquid chromatography/tandem mass spectrometry method for screening glutathione conjugates using exact mass neutral loss acquisition[J].Rapid Communications in Mass Spectrometry,2005,19(6):798-804.
[14]MA S,SUBRAMANIAN R.Detecting and characterizing reactive metabolites by liquid chromatography/tandem mass spectrometry[J].Journal of Mass Spectrometry,2006,41(9):1 121-1 139.
[15]YAN Z,CALDWELL G W.Stable-isotope trapping and high-throughput screenings of reactive metabolites using the isotope MS signature[J].Analytical Chemistry,2004,76(23):6 835-6 847.
[16]MU TL IB A,LAM W,A THERTON J,et al.Application of stable isotope labeled glutathione and rapid scanning mass spectrometers in detecting and characterizing reactive metabolites[J].Rapid Communications in Mass Spectrometry,2005,19(23):3 482-3 492.
[17]DIECKHAUS C M,FERN NDEZ-METZL ER C L,KING R,et al.Negative ion tandem mass spectrometry for the detection of glutathione conjugates[J].Chemical Research in Toxicology,2005,18(4):630-638.
[18]WEN B,MA L,NELSON S D,et al.High-throughput screening and characterization of reactive metabolites using polarity switching of hybrid triple quadrupole linear ion trap mass spectrometry[J].Analytical Chemistry,2008,80(5):1 788-1 799.
[19]WEN B,MA L,RODRIGUES A D,et al.Detection of novel reactive metabolites of trazodone:evidence for CYP2D6-mediated bioactivation of m-chlorophenylpiperazine[J].Drug Metabolism and Disposition,2008,36(5):841-850.
[20]WEN B,MA L,ZHU M.Bioactivation of the tricyclic antidepressant amitriptyline and its metabolite nortriptyline to arene oxide intermediates in human liver microsomes and recombinant P450s[J]. Chemico-Biological Interactions,2008,173(1):59-67.
[21]MAHAJAN M K,EVANS C A.Dual negative precursor ion scan approach for rapid detection of glutathione conjugates using liquid chromatography/tandem mass spectrometry[J].Rapid Communications in Mass Spectrometry,2008,22(7):1 032-1 040.
[22]ZHENGJ,MA L,XIN B,et al.Screening and identification of GSH-trapped reactive metabolites using hybrid triple quadruple linear ion trap mass spectrometry[J].Chemical Research in Toxicology,2007,20(5):757-766.
[23]ZHANG H,ZHANGD,RAY K.A software filter to remove interference ions from drug metabolites in accurate mass liquid chromatography/mass spectrometric analyses[J].Journal of Mass Spectrometry,2003,38(10):1 110-1 112.
[24]RUAN Q,PETERMAN S,SZEWC M A,et al.An integrated method for metabolite detection and identification using a linear ion trap/orbitrap mass spectrometer and multiple data processing techniques:application to indinavir metabolite detection[J].Journal of Mass Spectrometry,2008,43(2):251-261.
[25]ZHANG H,YANG Y.An algorithm for thorough background subtraction from high-resolution LC/MS data:Application for detection of glutathione-trapped reactive metabolites[J].Journal of Mass Spectrometry,2008,43(9):1 181-1 190.
[26]ZHANG H,MA L,HE K,et al.An algorithm for thorough background subtraction from highresolution LC/MS data:Application to the detection of troglitazone metabolites in rat plasma,bile,and urine[J].Journal of Mass Spectrometry,2008,43(9):1 191-1 200.
[27]LIM H K,CHEN J,COOK K,et al.A generic method to detect electrophilic intermediates using isotopic pattern triggered data-dependent highresolution accurate mass spectrometry[J].Rapid Communications in Mass Spectrometry,2008,22(8):1 295-1 311.
[28]SO GL IA J R,HARRIMAN S P,ZHAO S,et al.The development of a higher throughput reactive intermediate screening assay incorporating micro-bore liquid chromatography-microelectrospray ionization-tandem mass spectrometry and glutathione ethyl ester as an in vitro conjugating agent[J].Journal of Pharmaceutical and Biomedical Analysis,2004,36(1):105-116.
[29]WEN B,FITCH W L.Screening and characterization of reactive metabolites using glutathione ethyl ester in combination with Q-trap mass spectrometry[J].Journal ofMass Spectrometry,2009,44(1):90-100.
[30]YAN Z,MAHER N,TORRES R,et al.Use of a trapping agent for simultaneous capturing and high-throughput screening of both“soft”and“hard”reactive metabolites[J].Analytical Chemistry,2007,79(11):4 206-4 214.
[31]SCHOLZ K,DEKANT W,VOL KEL W,et al.Rapid detection and identification of N-acetyl-L-cysteine thioethers using constant neutral loss and theoretical multiple reaction monitoring combined with enhanced product-ion scans on a linear ion trap mass spectrometer[J].Journal of the American Society for Mass Spectrometry,2005,16(12):1 976-1 984.
[32]J IAN W,YAO M,ZHANG D,et al.Rapid detection and characterization of in vitro and urinary N-acetyl-L-cysteine conjugates using quadrupolelinear ion trap mass spectrometry and polarity switching[J].Society,2009:1 246-1 255.
[33]LEBLANC A,SHIAO T C,ROY R,et al.Improved detection of reactive metabolites with a bromine-containing glutathione analog using mass defect and isotope pattern matching[J].Rapid Communications in Mass Spectrometry,2010,24(9):1 241-1 250.
[34]GAN J,HARPER T W,HSUEH M M,et al.Dansyl glutathione as a trapping agent for the quantitative estimation and identification of reactive metabolites[J].Chemical Research in Toxicology,2005,18(5):896-903.
[35]SOGLIA J R,CONTILLO L G,KAL GUTKAR A S,et al.A semiquantitative method for the determination of reactive metabolite conjugate levels in vitro utilizing liquid chromatography-tandem mass spectrometry and novel quaternary ammonium glutathione analogues[J].Chemical Research in Toxicology,2006,19(3):480-490.
[36]BAILLIE T A.Metabolism and toxicity of drugs.Two decades of progress in industrial drug metabolism[J].Chemical Research in Toxicology,2008,21(1):129-137.
[37]INOU E K,SHIBA TA Y,TA KA HASHI H,et al.A trapping method for semi-quantitative assessment of reactive metabolite formation using[35S]cysteine and[14C]cyanide[J].Drug Metab Pharmacokinet,2009,24(3):245-254.
[38]ZHANG Z,CHEN Q,LI Y,et al.In vitro bioactivation of dihydrobenzoxathiin selective estrogen receptor modulators by cytochrome P450 3A4 in human liver microsomes:Formation of reactive iminium and quinone type metabolites[J].Chemical Research in Toxicology,2005,18(4):675-685.
[39]ROUSU T,PEL KONEN O,TOLONEN A.Rapid detection and characterization of reactive drug metabolites in vitro using several isotope-labeled trapping agents and ultra-performance liquid chromatography/time-of-flightmass spectrometry[J].Rapid Communications in Mass Spectrometry,2009,23(6):843-855.
[40]ARGOTI D,LIANGL,CONTEH A,et al.Cyanide trapping of iminium ion reactive intermediates followed by detection and structure identification using liquid chromatography-tandem mass spectrometry(LC-MS/MS)[J].Chemical Research in Toxicology,2005,18(10):1 537-1 544.
[41]CHAURET N,NICOLL-GRIFFITH D,FRIESEN R,et al.Microsomal metabolism of the 5-lipoxygenase inhibitors L-746,530 and L-739,010 to reactive intermediates that covalently bind to protein:the role of the 6,8-dioxabicyclo[3.2.1]octanyl moiety[J].Drug Metab Lism and Disposition:The Biological Fate of Chemicals,1995,23(12):1 325-1 334.
[42]ZHAN G K E,NAU E J A,ARISON B,et al.Microsomal metabolism of the 5-lipoxygenase inhibitor L-739,010:Evidence for furan bioactivation[J].Chemical Research in Toxicology,1996,9(2):547-554.
[43]J IN H,DAI J,CHEN X,et al.Pulmonary toxicity and metabolic activation of dauricine in CD-1 mice[J].Journal of Pharmacology and Experimental Therapeutics,2010,332(3):738-746.
[44]DENG P,ZHONG D,NAN F,et al.Evidence for the bioactivation of 4-nonylphenol to quinone methide and ortho-benzoquinone metabolites in human liver microsomes[J].Chemical Research in Toxicology,2010,23(10):1 617-1 628.
[45]谢 岑,钟大放,陈笑艳.鉴定大鼠注射绿原酸体内的代谢产物[J].药学学报,2011,46(1):88-95.
[46]VALASKOVIC G A,U TL EY L,L EE M S,et al.Ultra-low flow nanospray for the normalization of conventional liquid chromatography/mass spectrometry through equimolar response:standard-free quantitative estimation of metabolite levels in drug discovery[J].Rapid Communications in Mass Spectrometry,2006,20(7):1 087-1 096.
Applications of Liquid Chromatography-Tandem Mass Spectrometry to Detection and Characterization of Reactive Metabolites
XIE Cen,ZHONG Da-fang,CHEN Xiao-yan
(S hanghai Institute of Materia Medica,Chinese Academy of Sciences,Shanghai201203,China)
A number of therapeutical drugs were reported to undergo metabolic activation by drug-metabolizing enzymes.The bioactivation forms reactive metabolite(s),which readily covalently bind to macromolecules,such as proteins and DNA,and then lead to toxicities.In recent years,screening drug candidates for their tendency to generate reactive metabolites during drug discovery and development process and as well monitoring the bioactivation for post-marketing drugs have become increasingly important.Most reactive metabolites are electrophilic in nature and can react with nucleophiles.In vitro microsomal incubations,small nucleophilic molecules,such as glutathione,cyanide and amines are generally used to trap reactive metabolites.Structural elucidation of these stable adducts are conducted by liquid chromatography-tandem mass spectrometry.In this review,different mass spectrometers including triple quadrupole,ion trap,quadrupole-linear ion trap,and high-resolution mass spectrometer,employed for assessing reactive metabolites are described.The recent advances of different techniques and approaches are also discussed.
liquid chromatography-tandem mass spectrometry(LC-MS/MS);reactive metabolites;trapping agents
陈笑艳(1971~),女,黑龙江人,研究员,从事药物代谢与药物动力学研究。E-mail:xychen@mail.shcnc.ac.cn
O 657.63
A
1004-2997(2011)01-0001-12
2010-12-14;
2010-12-27
国家自然科学基金项目(30873119)资助
谢 岑(1985~),女,浙江人,博士研究生,从事药物代谢与药物动力学研究。E-mail:carolxc@hotmail.com
