利用QqQ-MS碰撞能量自动优化功能确定磷脂脂肪酰基位置
2011-02-02苏小玲徐继林陈娟娟严小军
苏小玲,徐继林,陈娟娟,赵 鹏,严小军
(宁波大学,应用海洋生物技术教育部重点实验室,浙江宁波 315211)
利用QqQ-MS碰撞能量自动优化功能确定磷脂脂肪酰基位置
苏小玲,徐继林,陈娟娟,赵 鹏,严小军
(宁波大学,应用海洋生物技术教育部重点实验室,浙江宁波 315211)
利用三重四极杆质谱碰撞能量自动优化功能,在正、负离子检测模式下,对磷脂标准品(包括 PA,PC,PE,PS,PG,PI)不同碰撞能量下子离子的裂解规律进行研究。实验发现:在负离子模式下,各类磷脂的子离子[M-H-R2COOH]-强度总是高于[M-H-R1COOH]-强度,而[M-H-R’2CH=CO]-丰度总是高于[M-H-R’1CH=CO]-丰度,这个规律可以用于确定左右磷脂的酰基位置。另外,在负离子模式下,PA和PS母离子裂解产生的羧酸阴离子丰度比均为R1COO-高于R2COO-,PC则为R1COO-低于R2COO-;在正离子模式下,PS裂解产生的酰基阳离子R1CO+丰度总是低于R2CO+,PA和PC在低碰撞能量下,sn-1脂肪酰基基团作为烯酮的中性丢失而产生离子丰度总是低于sn-2位上产生的对应离子;而PE和PG的sn-1位脂肪酰基基团作为羧酸的中性丢失而产生的离子在低碰撞能量下的丰度高于sn-2位上产生的离子。这些规律可用于辅助确定磷脂脂肪酰基的位置。
三重四极杆质谱;磷脂;脂肪酰基位置
天然磷脂是含磷酸的类脂化合物,它除了构成生物膜外,还参与细胞膜对蛋白质的识别和信号传导功能[1],同时,在影响植物光合作用效率[2-3]等方面也发挥着重要作用。磷脂的基本结构示于图1。同一类磷脂之间的差别体现在酰基脂肪酸组成和位置的不同,而确定磷脂不同位置的脂肪酰基组成对研究生物体磷脂的合成途径有着重要的意义[4]。
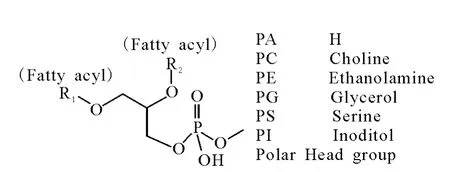
图1 磷脂的基本结构Fig.1 The general structure of glycerophospholipids
目前,多采用三重四极杆质谱(QqQ-MS)或线性离子阱质谱(L IT-M S)研究磷脂脂肪酰基的裂解规律[5-10],但均是取某一特定碰撞能量研究磷脂的裂解情况,而并未将整个碰撞能量范围进行全面的考虑。Hvattuma等[11]研究发现,18:0/20:4 PE在低碰撞能量下更有利于 sn-2的丢失,而在高能量下,sn-1则更易丢失。这说明某些磷脂在不同碰撞能量下其子离子的相对丰度会发生变化。三重四极杆质谱碰撞能量自动优化功能可以直观给出同一母离子的不同子离子丰度与碰撞能量的变化曲线,从而根据各离子相对丰度的变化来研究磷脂分子中不同酰基的位置。
1 实验部分
1.1 仪器与试剂
TSQ Quantum Access三重四极杆质谱联用分析系统:美国 Thermo Fisher公司产品;超纯水系统:美国M illipore公司产品。
磷脂酸(PA)、卵磷脂(PC)、磷脂酰乙醇胺(PE)、磷脂酰甘油(PG)、磷脂酰肌醇(PI)、磷脂酰丝氨酸(PS)标准品:美国Avanti Polar Lipids公司产品;甲酸(色谱纯):美国 Sigma-A ldrich公司产品;其他试剂(色谱纯):美国 Tedia公司产品;纯水由超纯水系统制备。
1.2 实验方法
1.2.1 标准溶液的配制 取各标准溶液,用甲醇稀释至 1 g/L,再用V(氯仿)∶V(甲醇)∶V(乙酸铵)=300∶665∶35的溶液进一步稀释至10 mg/L,直接进样上机分析。
1.2.2 质谱条件 采用电喷雾电离(ESI)源正、负离子电离模式,喷雾电压2 800 V,鞘气流量12 L/m in,辅助气流量 4 L/m in,离子传输毛细管温度350℃,选择反应监测(SRM)模式,碰撞室能量采用5~80 V进行扫描。正离子模式下蠕动泵流速10μL/m in;负离子模式下蠕动泵流速 8μL/min。碰撞气为氩气,碰撞气压力23.79 Pa。
2 结果与讨论
2.1 负离子模式下各磷脂分子裂解规律
磷脂骨架是甘油骨架,其中sn-1和sn-2位两个羟基通过酯键分别连接两个脂肪酸链,另一羟基连接极性头部。ESI源负离子模式下,磷脂多以[M-H]-离子存在,对其做二级质谱分析,在5~80 V范围内改变碰撞能量,观察得到的子离子形式包括sn-1羧酸阴离子(R1COO-),sn-2羧酸阴离子(R2COO-),也会形成对应于 sn-1和sn-2位脂肪酰基基团作为羧酸和烯酮的中性丢失而产生的离子[M-H-RXCOOH]-和[M-H-R’XCH=CO]-(RX=RX’CH2)。
选择得到的子离子作为研究对象,利用三重四极杆质谱碰撞能量自动优化的功能,对产生相应子离子的碰撞能量进行自动优化,仪器可以自动给出各子离子丰度随着碰撞能量改变而变化的曲线,示于图2。
2.1.1 羧酸阴离子(RXCOO-)的裂解规律以PA为例,图2是 16∶0/18∶1 PA的m/z673([M-H]-)母离子产生子离子时,碰撞能量自动优化后各子离子丰度随着碰撞能量变化而变化的曲线。从图中可以看出,在碰撞能量变化的整个范围内,处在sn-1位的脂肪酰基基团形成的m/z255负离子(R1COO-)的丰度总是大于处在sn-2位的脂肪酰基基团形成的m/z281(R2COO-)(图2a),此规律在 18∶0/22∶6 PA的m/z747([M-H]-)母离子产生的相应子离子变化中同样出现。可见在本实验中,无论是16∶0/18∶1 PA 还是 18∶0/22∶6 PA,都是sn-1位更容易断裂,在对应变化图上位于上方的曲线代表的酰基基团就位于sn-1,位于下方的曲线代表的酰基基团就位于 sn-2位。Hsu等[5]利用 ESI源QqQ-M S在低碰撞能量下研究了 PA的裂解规律,发现 16∶0/18∶1、18∶0/20∶4 PA子离子丰度比为 R1COO->R2COO-。因此可以认为,PA的子离子丰度R1COO-总是大于R2COO-。

图2 16∶0/18∶1 PA[M-H]-离子所产生的不同子离子在不同碰撞能量下的相对丰度Fig.2 The relative intensity of product ion arising from the dissociation of[M-H]-ion of C16∶0/18∶1 PA at different collision energies
对于其他磷脂而言,由于极性头部的不同,各子离子丰度随着碰撞能量变化的规律并不一致。Vensen[12]利用快原子轰击质谱(FAB-M S)研究PC负离子模式时的裂解情况,发现sn-2位羧酸阴离子的相对丰度大约是sn-1位的2倍;而 Hsu等[6]利用多级串联离子阱质谱详细研究正负离子模式下的 PS裂解,发现负离子模式下R1COO-的丰度高于 R2COO-。他们均是取某一特定碰撞能量研究磷脂的裂解情况,而并未将整个碰撞能量范围进行全面考虑。本实验另外选取 2种 PA、PC、PS、PE、PG、PI,观察其在不同碰撞能量下羧酸阴离子的相对丰度,结果列于表1。由表1可知,与 PA类似,PS sn-1位的羧酸阴离子丰度也总是高于sn-2位,即 R1COO->R2COO-。Hvattuma等[11]研究了 18∶0/20∶4 PS、PA,也得到了相同的规律,这证实了本实验结果的正确性。而对于PC而言,无论是14∶0/18∶1还是 18∶1/14∶0,结果均显示R2COO->R1COO-。Han等[13]研究了碰撞能量为18~25 V PC(16∶0/18∶1、16∶0/18∶2、18∶0/18∶1、16∶0/20∶4),发现 sn-2位产生的羧酸阴离子是sn-1位的3倍,这与本实验得到的结果一致。
这种具有同样酰基阴离子相对丰度大小的规律并非存在于所有磷脂裂解过程中。有报道指出,磷脂分子甘油骨架上酰基链的位置对分子离子解离影响较大,sn-1与sn-2裂解丰度比值取决于sn-2位上酰基链的长短及不饱和键的数目[13]。本实验中,PE、PG、PI在负离子模式下羧酸阴离子未发现一致的规律。例如 PG,16∶0/18∶1 PG在不同的碰撞能量下,R2COO-曲线始终高于 R1COO-曲线;而对于18∶0/22∶6 PG而言,当碰撞能量在5~30 V时,sn-1位酰基离子丰度与sn-2位几乎一样,当能量提高时,R1COO-丰度高于R2COO-丰度,示于图3,所以无法用这两个离子的相对丰度变化来定性这些磷脂的酰基位置。
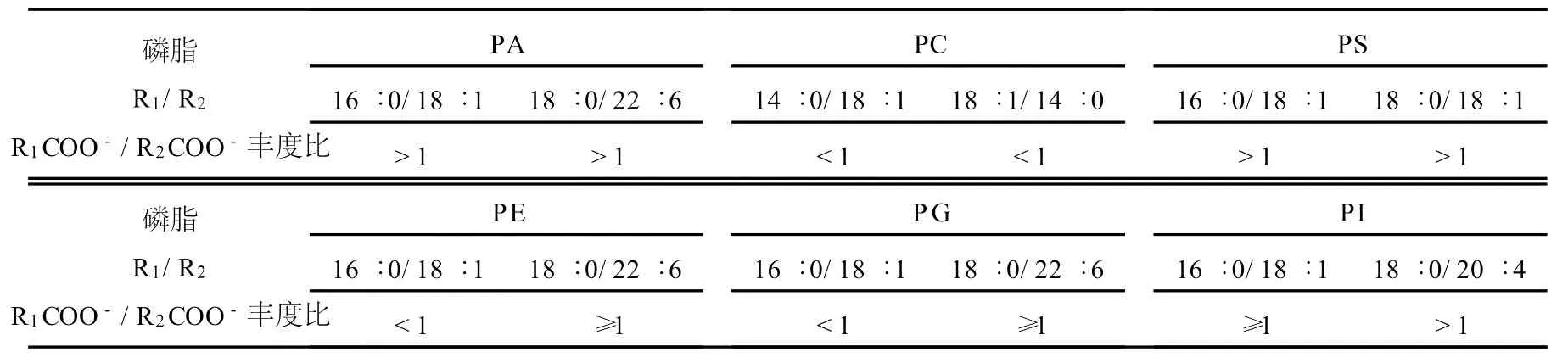
表1 各类磷脂标准品在5~80 V碰撞能量下,sn-1和sn-2位羧酸阴离子的相对丰度比Table 1 The relative abundance ratio of carboxylate anion from sn-1 or sn-2 from 6 classes of phospholipids under different collision energies(5~80 V)
2.1.2 负离子模式下[M-H-R’XCH=CO]-,[M-H-RXCOOH]-的裂解规律 仍以PA为例,进一步观察16∶0/18∶1 PA的m/z673([M-H]-)母离子产生的其他子离子可见,子离子m/z391[M-H-R2COOH]-的丰度在各碰撞能量下总是高于m/z417[MH-R1COOH]-;而子离子m/z409[M-HR’2CH=CO]-的丰度始终高于m/z435[MH-R’1CH=CO]-,这些结果说明 ,16∶0/18∶1 PA的sn-2位比sn-1位更有利于脂肪酰基基团作为羧酸和烯酮的中性丢失。
从表1可见,PE、PG、PI各羧酸阴离子的丰度之间没有类似 PA、PC、PS所具有的共同规律。为了确认PA、PC、PS其他子离子是否也具有一致的裂解规律,进一步考察了其他子离子之间的丰度变化。选择对比[M-H-R’XCH=CO]-、[M-H-RXCOOH]-相对离子丰度发现,随着碰撞能量的增加,所有标准脂[M-HR1COOH]-丰度总是小于[M -HR2COOH]-,同时 ,[M-H-R’1CH=CO]-丰度也总是小于[M-H-R’2H=CO]-。Hsu等[7-10]在某一能量下对 PE 18∶0/16∶0,PG 18∶1/16∶0、18∶0/20∶4,PI的研究也得到了同样的结论。故这6种磷脂分子均可根据[MH-R’XCH=CO]-或[M-H-RXCOOH]-(PC根据[M-H-CH3-R’XCH=CO]-或[M-H-CH3-RXCOOH]-,PS根据[M-H-87-R’XCH=CO]-或 [M-H-87-RXCOOH]-,且X=1,2)丰度直接确定酰基所在的位置。但是由于羧酸阴离子的丰度都高于其他子离子的丰度(例如 PA),所以对于PA、PC、PS 来说 ,用 R1COO-和 R2COO-丰度比确定酰基所在位置更简便、直观。
2.2 正离子模式下各磷脂分子裂解规律
2.2.1 PA ESI源正离子模式下,PA多以[M+H]+离子存在,同时,PA易发生中性丢失极性头部(H3PO4)而产生[M+H-98]+子离子。以 16∶0/18∶1 PA为例,对[M+H-98]+做二级质谱,观察所产生的碎片离子,发现包含裂解产生的m/z339[M+H-98-R’1CH=CO]+、m/z313[M+H-98-R’2H=CO]+。另外,PA[M+H-98]+做二级质谱碎裂得到酰基阳离子分别为m/z239 R1CO+和m/z265 R2CO+。
比较上述观察所得到的子离子相对丰度,发现m/z239的相对丰度低于m/z265,但在整个碰撞能量范围内,二者的丰度比较接近;在低碰撞能量(<30 V)下,m/z339相对丰度明显低于m/z313,在碰撞能量30~45 V下,m/z339的丰度则高于m/z313。对18∶0/22∶6 PAm/z651[M+H-98]+做二级质谱,观察到m/z267(R1CO+)丰度明显高于m/z311(R2CO+)。当碰撞能量小于50 V时,m/z385[M+H-98-R’1CH=CO]+丰度明显低于m/z341[M+H-98-R’2H=CO]+;当碰撞能量高于45 V时,二者的丰度均很低。对于m/z367[M+H-98-R1COOH]+和m/z323[M+H-98-R2COOH]+而言,在能量小于40 V时,m/z367明显高于m/z323。据此,在低碰撞能量下可以根据[M+H-98-R’1CH=CO]+和[M+H-98-R’2H=CO]+的相对离子强度确定 PA酰基所处的位置。
2.2.2 PC 14∶0/18∶1 PC和18∶1/14∶0 PC在正离子模式下不仅可以产生[M+H]+离子,还可以产生[M+Na]+,但[M+Na]+信号强度较低,故选择[M+H]+离子做二级质谱。对两种PC酰基阳离子做碰撞能量自动优化,得到的信号强度均很低,不利于做比较。在本实验中,发现sn-2位比sn-1位更有利于脂肪酸酰基基团丢失,这体现在碰撞能量小于50 V时,[M+H-R’2H=CO]+的相对丰度高于[M+H-R’1H=CO]+(能量大于 50 V时,[M+H-R’XH=CO]+信号强度很低,接近于 0)。Hsu等[6]利用串联四极杆质谱研究了16∶0/18∶1 PC,同样发现了正离子模式下[M+HR’2H=CO]+的相对丰度总是高于[M+HR’1H=CO]+。所以,对于 PC而言,正离子模式下脂肪酰基在甘油骨架的位置可通过此规律来确定。
2.2.3 PE PE易中性丢失C2H8O4NP(141 u)形成[M+H-141]+离子 ,故 16∶0/18∶1 PE和18∶0/22∶6 PE的母离子m/z718[M+H]+和m/z792[M+H]+在正离子模式的主要子离子是m/z577和m/z651。观察 16∶0/18∶1 PE的其他子离子,发现R1CO+丰度明显低于R2CO+;[M+H-141-R1COOH]+的离子丰度在碰撞能量小于35 V时总是高于[M+H-141-R2COOH]+丰度,高碰撞能量下二者得到的信号均很低;另外,能量小于30 V时,m/z339[M+H-141-R’1H=CO]+的强度高于m/z313[M+H-141-R’2H=CO]+,能量大于30 V时,m/z339低于m/z313,示于图4。观察18∶0/22∶6 PE则发现,R1CO+丰度总是高于R2CO+,[M+H-141-R1COOH]+的离子丰度总是高于[M+H-141-R2COOH]+丰度 ,[M+H-141-R’1H=CO]+的强度低于[M+H-141-R’2H=CO]+。仔细分析上述规律,可发现共有规律为PE所产生的子离子[M+H-141-R1COOH]+丰度在低碰撞能量下总是高于[M+H-141-R2COOH]+丰度,因此,可以直接确定出PE酰基所处的位置。
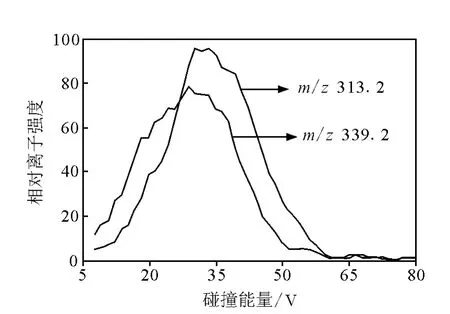
图4 16∶0/18∶1 PE子离子[M-140-R1 COOH]+和[M-140-R2 COOH]+的相对离子强度Fig.4 The relative intensity of the[M-140-R1COOH]+and the[M-140-R2 COOH]+from C16∶0/18∶1 species of PGat different collision energies
2.2.4 PG PG在正离子模式下极易丢失包括磷酸在内的极性头部基团而形成特征离子[M-171]+。另外,16∶0/18∶1 PG[M+H]+离子强度很低,故选择[M-171]+做二级质谱,分别观察比较16∶0/18∶1 PG和18∶0/22∶6 PG子离子的相对强度,结果发现:16∶0/18∶1 PG碎裂形成的酰基阳离子相对强度为R1CO+低于R2CO+,而18∶0/22∶6 PG碎裂形成的酰基阳离子相对强度为R1CO+高于R2CO+;但两种PG丢失脂肪酰基基团作为烯酮的中性丢失而产生的离子[M-171-R’XH=CO]+均为[M-171-R’1H=CO]+的强度高于[M-171-R’2H=CO]+。故正离子模式下,PG可根据 M-171-R’1H=CO]+和[M-171-R’2H=CO]+相对强度来确定脂肪酰基位置。
2.2.5 PS PS在正离子 ESI源下易形成[M+H]+离子,此类离子也易通过失去极性头部基团而产生[M-184]+。分别对 16∶0/18∶1PS和18∶0/18∶1 PS的[M+H]+离子做二级质谱发现,这两种PS裂解形成酰基阳离子的相对离子丰度均为R1CO+低于R2CO+,而其他子离子的相对丰度则较低。所以对于 PS而言,正离子模式下可根据R1CO+和R2CO+相对丰度高低直接确定酰基的位置。
3 结论
综上所述,ESI源负离子模式下,PA、PC、PS、PE、PG、PI均可以根据 [M-H-R’XCH=CO]-或[M-H-RXCOOH]-(PC根据[M-H-CH3-R’XCH=CO]-或[M-HCH3-RXCOOH]-,PS根据[M-H-87-R’XCH=CO]-或 [M-H-87-RXCOOH]-,且X=1,2)相应的相对离子强度大小来确定磷脂脂肪酰基的位置,即[M-HR2COOH]-的离子强度总是高于[M-HR1COOH]-强度 ,而[M-H-R’2CH=CO]-丰度总是高于[M-H-R’1CH=CO]-丰度。
考虑到某类磷脂在一定条件下,上述离子丰度可能较低,则可以选择其他离子丰度比变化来进行辅助定性。在负离子模式下,对于 PA、PC、PS而言,可利用sn-1、sn-2位羧酸阴离子的丰度比来确定酰基的位置,其中PA和 PS母离子裂解产生的羧酸阴离子丰度比均为 R1COO->R2COO-,PC则为 R1COO-<R2COO-。由于PA、PC、PS产生的羧酸阴离子的丰度都高于其它子离子的丰度,故利用 R1COO-和 R2COO-的丰度比确定酰基所在位置是简便、直观的。
在正离子模式下,PS的酰基阳离子R1CO+丰度总是低于R2CO+;PA和PC在低碰撞能量下,sn-1脂肪酰基基团作为烯酮的中性丢失而产生的离子丰度总是低于sn-2位上产生的对应离子;而对于PE和 PG而言,在低碰撞能量下,其sn-1脂肪酰基基团作为羧酸的中性丢失而产生的离子丰度高于sn-2位上产生的对应离子。这些规律可以作为对应磷脂在对应条件下的辅助定性。
[1]WANG X M.Lipid signaling[J].Current Opinion in Plant Biology,2004,7(3):329-336.
[2]HAGIO M,GOMBOS Z,VÁRKONYI Z,et al.Direct evidence for requirement of phosphatidylglycerol in photosystem IIof photosynthesis[J].A-merican Society of Plant Physiologists,2000,124(2):795-804.
[3]JONESM R.Lipids in photosynthetic reaction centres:Structural roles and functional holes[J].Progress in Lipid Research,2007,46(1):56-87.
[4]SOM ERV ILLE C,BROWSE J.Plant lipids:Metabolism,mutants,and membranes[J].Science,1991,252(5 002):80-87.
[5]HSU F F,TURKJ.Charge-driven fragmentation processes in diacyl glycerophosphatidic acids upon low-energy collisional activation.A mechanistic p roposal[J].J Am Soc Mass Spectrom,2000,11(9):797-803.
[6]HSU F F,TURK J.Studies on phosphatidylserine by tandem quadrupole and multip le stage quadrupole ion-trap mass spectrometry with electrosp ray ionization:Structural characterization and the fragmentation processes[J].J Am Soc Mass Spectrom,2005,16(9):1 510-1 522.
[7]HSU F F,TURK J.Charge-remote and chargedriven fragmentation processes in diacyl glycerophosphoethanolamine upon low-energy collisional activation:A mechanistic p roposal[J].J Am Soc Mass Spectrom,2000,11(10):892-899.
[8]HSU F F,TURK J.Studieson phosphatidylglycerol with triple quadrupole tandem mass spectrometry with electrosp ray ionization:Fragmentation processes and structural characterization[J].J Am Soc Mass Spcctrom,2001,12(9):1 036-1 042.
[9]HSU F F,TURK J.Characterization of phosphatidylinositol, phosphatidylinositol-4-phosphate,and phosphatidylinositol-4,5-bisphosphate by electrosp ray ionization tandem mass spectrometry:A mechanistic study[J].J Am Soc Mass Spcctrom,2000,11(11):986-999.
[10]HSU F F,TURK J.Electrosp ray ionization with low-energy collisionally activated dissociation tandem mass spectrometry of glycerophospholipids:Mechanisms of fragmentation and structural characterization[J].Journal of Chromatography B,2009,877(26):2 673-2 695.
[11]HVA TTUM E,HAGEL IN G,LARSEN A.Study of mechanism s involved in the collision-induced dissociation of carboxylate anions from glycerophospholipids using negative ion electrosp ray tandem quadrupole mass spectrometry[J].Rapid Commum Mass Spectrom,1998,12(19):1 405-1 409.
[12]JENSEN N J,TOM ER KB,GROSSM L.Fast atom bombardment and tandem mass spectrometry of phosphatidylserine and phosphatidylcholine[J].Lipids,1986,21(9):580-588.
[13]HAN X L,GROSS R W.Structural determination of picomole amounts of phospholipids via electrosp ray ionization tandem mass spectrometry[J].J Am Soc Mass Spcctrom,1995,6(12):1 202-1 210.
Characterization of Fatty Acyl Location in Phospholipids by Triple Quadrupole Tandem Mass Spectrometry Using the Function of Collision Energy Automatic Optim ization
SU Xiao-ling,XU Ji-lin,CHEN Juan-juan,ZHAO Peng,YAN Xiao-jun
(Key Laboratory of A pp lied M arine Biotechnology,Ministry of Education,N ingbo University,Ningbo 315211,China)
Utilizing the function of collision energy automatic op timization,the fragmentation patterns of the phospholipids standards,including classes of glycerophosphatidic acid(PA),glycerophosphocholine(PC),glycerophosphoethanolamine(PE),glycerophosphoserine(PS),glycerophosphoglycerol(PG)and glycerophosphoinositol(PI)were studied both in negative and positive modes by triple quadrupole tandem mass spectrometry.It could be inferred that,for all classes of phospholipids,the intensities of the ions arising from neutral loss of the sn-2 substituent as a free fatty acid([M-H-R2COOH]-)or ketene([M-H-R‘2CH=CO]-)are stronger than those of corresponding ions generated byloss of the sn-1 substituent.According to this rule,it was readily to confirm the position of acyl group.In addition,it was easy to elimination of carboxylate substituent from sn-2 position for PC,which meant that the intensity of R2COO-was higher than that of R1COO-.While for PA and PS,the phenomena were totally opposite to that of PC and the intensity of R2COO-was weaker than that of R1COO-.W hen in the positive ion mode,the intensity of acylium ion from the sn-1 position was weaker than the acylium ion from the sn-2 position for PS.Moreover,at low collision energy,for PA and PC species it could be found that the intensities of the ions arising from neutral loss of the sn-2 substituent as a ketene([MH-R’2CH=CO]-)w ere greater than those of ions reflecting corresponding losses of the sn-1 substituent at low collision energy.However,for PE and PG,the intensity of the ion by loss of R1CO2H was stronger than that of ion by elimination of R2CO2H.These fragmentation rules could be used to determine the position of the fatty-acyl substituent of glycerol backbone.
triple quadrupole tandem mass spectrometry;phospholipids;fatty-acyl location
O 657.63
A
1004-2997(2011)04-0200-07
2010-09-25;
2010-12-10
教育部长江学者与创新团队项目 (IRT0734)、浙江省公益性项目(2010C32G2070011)、浙江省自然科学基金(Y3100534)、宁波市自然科学基金(2009A 610117)资助
苏小玲(1988~),女(汉族),浙江温州人,硕士研究生,从事微型藻类的生物化学研究。E-mail:lingluck312@163.com
严小军(1968~),男(汉族),江苏苏州人,研究员,从事微型藻类的生物化学研究。E-mail:yanxiaojun@nbu.edu.cn
